Behandeling EUG: Chirurgie
Uitgangsvraag
Wat is de optimale chirurgische techniek voor de behandeling van een tubaire EUG?
Aanbeveling
Verricht bij voorkeur een laparoscopische tubectomie bij een tubaire EUG indien peroperatief de contralaterale tuba een normaal aspect heeft.
Bij contralaterale tubapathologie heeft laparoscopische tubotomie de voorkeur in het geval de vrouw een spontane zwangerschap na wil streven.
Overwegingen
Sinds het verschijnen van de vorige EUG richtlijn is een aantal goed uitgevoerde studies verschenen die het toelaten enkele conclusies te trekken over de chirurgische behandeling van de tubaire EUG (Fernandez, 2013; Mol, 2014).
Zowel na de laparoscopische tubectomie als tubotomie is de kans op een succesvolle spontane vervolgzwangerschap hoog, zonder duidelijke verschillen tussen de behandelingen bij patiënten met een normale contralaterale tuba. Uit de literatuur blijkt dat de kans op een persisterende trofoblast waarvoor re-interventie in de vorm van MTX of heroperatie noodzakelijk is, mogelijk verhoogd is na tubasparende chirurgie/tubotomie.
Er lijkt geen verschil te zijn in opnieuw optreden van een EUG bij een vervolgzwangerschap. Er is een klein verschil in kosten in het voordeel van tubectomie.
Een richtlijn van de NVOG is van toepassing op de gemiddelde praktijksituatie in Nederland. De behandeling van een tubaire EUG heeft (mogelijk) een spoedeisend karakter, waardoor patiënten door hulpverleners met uiteenlopende vaardigheden worden gezien. Een tubectomie vraagt minder laparoscopische competenties dan een tubotomie, hetgeen de implementatie van de adviezen uit deze richtlijn waarschijnlijk zal bespoedigen.
Bij een tubotomie is er een verhoogde kans op peroperatieve bloedingen en persisterende trofoblast. Patiënten bij wie het vermoeden is dat zij zich niet zullen melden voor vervolgonderzoek zijn beter af met een tubectomie waarbij het vervolgen van de hCG waarden niet is geïndiceerd. De mogelijkheid van een ‘one-stop’ behandeling zoals mogelijk bij een tubectomie resulteert in een grotere patiënttevredenheid en een eenvoudigere organisatie van zorg. Op macro-economisch niveau geeft de tubectomie minder kosten.
Onderbouwing
Achtergrond
De afgelopen jaren bestond een grote praktijkvariatie in de chirurgische behandeling van de tubaire EUG. Ten tijde van het schrijven van de vorige richtlijn was onvoldoende bewijs beschikbaar om een voorkeur uit te kunnen spreken voor een sparende (tubotomie) dan wel radicale techniek (tubectomie) Inmiddels is een aantal nieuwe studies gepubliceerd waardoor het nu beter mogelijk is om hierover aanbevelingen op te stellen.
Conclusies
Fecunditeit
|
Hoog GRADE |
De kans op een intra-uteriene zwangerschap is niet verschillend tussen tubotomie en tubectomie als behandeling van EUG bij vrouwen met een tubaire zwangerschap en een normale contralaterale tuba. Bronnen: Mol, 2014; Fernandez, 2013 |
Recidief EUG
|
- |
Het is niet mogelijk om een conclusie te trekken voor de uitkomstmaat recidief EUG bij vrouwen met een tubaire extra-uteriene graviditeit. |
Persisterende trofoblast
|
Matig GRADE |
Persisterende trofoblast komt mogelijk vaker voor na tubotomie dan na tubectomie als behandeling van extra-uteriene graviditeit. Bron: Mol, 2014 |
Kosteneffectiviteit
|
Matig GRADE |
De gemiddelde directe kosten van een tubotomie zijn iets hoger dan van een tubectomie. Bron: Mol, 2015 |
Samenvatting literatuur
Beschrijving studies
Mol, 2015 beschreven een kosteneffectiviteitsanalyse die parallel is uitgevoerd aan de ESEP-trial (zie Mol, 2014). In deze trial werden tubotomie en tubectomie met elkaar vergeleken als behandeling van vrouwen met een tubaire EUG.
Voor de kosteneffectiviteitsanalyse werden de data gebruikt van 446 vrouwen uit de ESEP-trial. De primaire klinische uitkomstmaat was fecunditeit; secundaire uitkomstmaten waren persisterende trofoblast en recidief EUG. De kostenanalyse werd uitgevoerd vanuit het ziekenhuisperspectief in een Nederlandse situatie waarbij alleen de directe medische kosten werden geïncludeerd. De kosten werden ingedeeld in vier categorieën: primaire operatie, heropname (voor andere redenen dan persisterende trofoblast), persisterende trofoblast en recidief EUG. Voor de verschillende uitkomstmaten werden ICERs berekend: de ratio van het verschil in kosten en het verschil in effectiviteit tussen de twee interventies. De ICER geeft aan welke kosten gepaard gaan met één extra ‘eenheid’ van de uitkomstmaat (dus bijvoorbeeld één extra natuurlijke zwangerschap).
Mol, 2014 beschreven een open-label, multicentrische, internationale RCT (ESEP-trial) waarbij tubotomie werd vergeleken met tubectomie als behandeling bij vrouwen met een tubaire zwangerschap en een contralaterale normale tuba. De primaire uitkomstmaat was een doorgaande zwangerschap door natuurlijke conceptie. Secundaire uitkomstmaten waren recidief EUG en persisterende trofoblast.
Fernandez, 2013 beschreven een multicentrische RCT (DEMETER-trial) waarbij het effect van diverse behandelingen van tubaire EUG op de vruchtbaarheid werd vergeleken. De Fernandez score werd gebruikt om de activiteit van de EUG te bepalen aan de hand van zes items: zwangerschapsduur, buikpijn, serum-hCG, progesteron, grootte van de tuba en hemoperitoneum.
Vrouwen werden op basis van de activiteit van de EUG ingedeeld in twee groepen:
- Groep 1 (lage activiteit EUG (Fernandez score <13 en hemodynamisch stabiel)): binnen deze groep werden vrouwen gerandomiseerd tussen tubotomie met een enkele (single) dosis MTX 24 uur na de operatie en alleen een enkele (single) dosis MTX.
- Groep 2 (actieve EUG (Fernandez score ≥ 13 of klinische ruptuur)): binnen deze groep werden vrouwen gerandomiseerd tussen tubotomie en tubectomie, waarbij de tubotomie werd gevolgd door een enkele (single) dosis MTX (1 mg/kg) binnen 24 uur na de operatie.
In beide groepen kon een tubotomie worden omgezet naar een tubectomie in het geval van persisterend bloedverlies.
De primaire uitkomstmaat was spontane vruchtbaarheid twee jaar na behandeling, gedefinieerd als een IUG. De secundaire uitkomstmaat was recidief EUG. De totale duur van de follow up was vijf jaar.
Resultaten
Fecunditeit
Twee studies beschreven de uitkomstmaat fecunditeit: Mol, 2014 en Fernandez, 2013.
Fernandez, 2013 includeerden 101 vrouwen in de tubotomiegroep en 98 vrouwen in de tubectomiegroep (afkomstig uit groep 2). Van de 199 vrouwen waren 18 vrouwen lost to follow-up. Bij 52 vrouwen bestond geen nieuwe zwangerschapswens. Daarom werden 129 vrouwen meegenomen in de analyse. De intra-uteriene zwangerschapskans na tubotomie was 70% ten opzichte van 64% na tubectomie.
Mol, 2014 includeerden 446 vrouwen in hun studie, 215 in de tubotomie arm en 231 in de tubectomie arm. Van de 215 vrouwen in de tubotomie groep ondergingen er 164 daadwerkelijk een tubotomie, 51 vrouwen ondergingen alsnog een tubectomie vanwege persisterend bloedverlies. Elf vrouwen waren lost to follow-up in de tubotomiegroep ten opzichte van dertien vrouwen in de tubectomiegroep. In de intention to treat analyse hadden 222 vrouwen een spontane zwangerschap door natuurlijke conceptie; 108 na tubotomie en 114 na tubectomie. De cumulatieve kans op een doorgaande zwangerschap na een periode van 36 maanden was 60,7% na tubotomie en 56,2% na tubectomie, met een fecunditeitratio van 1,06; 95% BI 0,81 – 1,39. In de per protocol analyse werden 164 vrouwen geïncludeerd die een tubotomie hadden ondergaan en 231 vrouwen met een tubectomie. Tweehonderdeen (201) vrouwen hadden een spontane zwangerschap door natuurlijke conceptie, waarvan 87 vrouwen na een tubotomie en 114 na een tubectomie. De cumulatieve kans op een doorgaande zwangerschap door natuurlijke conceptie was 62,3% na tubotomie en 56,2% na een tubectomie, met een fecundititeitsratio van 1,10; 95% BI 0,83 – 1,46.
Mol, 2014 voerden een meta-analyse uit, waarbij de resultaten uit de studie van Fernandez, 2013 voor de uitkomstmaten fecunditeit en herhaalde ectopische zwangerschap tussen tubotomie en tubectomie zijn vergeleken met de resultaten van de studie van Mol et al.
Voor de meta-analyse met de uitkomstmaat fecunditeit is een hazard ratio berekend met behulp van een random-effect model. De resultaten van de analyse lieten zien dat de cumulatieve doorgaande zwangerschapskans gelijk was tussen tubotomie en tubectomie met een HR 1,079 (95% BI 0,856 – 1,361).
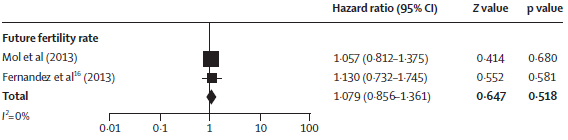
Figuur 1. Meta-analysis van de studies die tubotomie met tubectomie vergelijken bij vrouwen met een EUG (Mol, 2014).
Bewijskracht van de literatuur
De literatuur werd beoordeeld aan de hand van GRADE waarbij de bewijskracht van een RCT begint op een hoog niveau. De bewijskracht voor de uitkomstmaat fecunditeit werd beoordeeld met een hoog niveau.
In de studies van Fernandez, 2013) en Mol, 2014 werd de behandelaar niet geblindeerd, maar degene die de gegevens over de uitkomsten verzamelde wel. Ook werd duidelijk omschreven wanneer de behandelaar beargumenteerd mag afwijken van de initiële chirurgische behandeling. Het niet blinderen van de behandelaar heeft geen effect op de beoordeling van de uitkomst van de studie. Lost to follow-up is in beide studies voor allebei de interventiegroepen beschreven en varieerde tussen de 5 en de 10%. In geen enkele studie werd de reden van lost to follow-up omschreven.
Recidief EUG
Twee van de drie studies beschreven de uitkomstmaat recidief EUG: Mol, 2014 en Fernandez, 2013.
Mol, 2014 rapporteerden dat er geen significant verschil was in de incidentie van recidief EUG, namelijk 18 (8%) vrouwen in de tubotomie groep versus 12 (5%) vrouwen in de tubectomie groep met een RR 1,6 (95% BI 0,8 – 3,3).
Fernandez, 2013 beschreven dat recidief EUG voorkwam bij 8% na tubotomie versus 12,5% na tubectomie.
Het is niet mogelijk om de resultaten voor de uitkomstmaat recidief EUG te poolen vanwege heterogeniteit. De twee studies laten een lage incidentie van recidief EUG zien maar tonen ook een tegengesteld effect op de kans op recidief EUG. Mol, 2014 rapporteerden een niet significante hogere kans op recidief EUG na tubotomie (RR= 1,6; 95% BI 0,8 – 3,3), terwijl Fernandez, 2013 een niet significante lagere kans op recidief EUG laat zien (RR=0,6; 95% BI 0,2 – 2,2). Daarnaast heeft het RR een breed 95% berouwbaarheidsinterval en bevat de meta-analyse een laag aantal events.
Bewijskracht van de literatuur
Omdat de studies een tegengesteld effect rapporteerden is het niet mogelijk een conclusie te trekken en de bewijskracht van de literatuur vast te stellen.
Persisterende trofoblast
Eén studie beschreef de uitkomstmaat persisterende trofoblast, namelijk Mol, 2014.
Persisterende trofoblast kwam significant vaker voor in de tubotomie groep (N= 14; 7%) in vergelijking met de tubectomie groep (N= 1; <1%) met een RR van 15,0 (95% BI 2,0 – 113,4).
Bewijskracht van de literatuur
De literatuur werd beoordeeld aan de hand van GRADE waarbij de bewijskracht van een RCT begon op een hoog niveau. In de studie van Mol, 2014 werd de behandelaar niet geblindeerd maar is duidelijk omschreven wanneer de behandelaar beargumenteerd mag afwijken van de initiële chirurgische behandeling. Lost to follow-up in beide interventiegroepen was ongeveer 5% en reden van lost to follow-up was niet beschreven. Hiervoor werd niet gecorrigeerd. De studie van Mol, 2014 werd voor de uitkomstmaat persisterende trofoblast beoordeeld met een matig niveau vanwege imprecisie van de effectschatting.
Kosteneffectiviteit
Eén studie beschreef de uitkomstmaat kosteneffectiviteit, namelijk Mol, 2015.
Mol, 2015 rapporteerden dat tubotomie in alle vier de kostencategorieën hoger uitkwam dan tubectomie. Het verschil in kosten per vrouw van de primaire operatie was 89; het verschil in kosten van heropname was €79; het verschil in kosten van persisterende trofoblast €131 en het verschil in kosten van recidief EUG €62. Het gemiddelde verschil in directe kosten was € 361 (95% BI €217 - € 515). Tubotomie liet een klein, niet significant, positief verschil zien in fecunditeit in vergelijking met tubectomie (50,2% na tubotomie ten opzichte van 49,4 % na tubectomie) waardoor de ICER positief uitvalt en een waarde heeft van €40.983. Dus de extra kosten van tubotomie om één extra natuurlijke zwangerschap mogelijk te maken zijn €40.983 (95% BI -€130.319 tot €145.491). Voor de andere uitkomstmaten was het effect van tubotomie op de kosten slechter dan van tubectomie.
Bewijskracht van de literatuur
De literatuur werd beoordeeld aan de hand van GRADE waarbij de bewijskracht van een RCT begon op een hoog niveau. De studie van Mol, 2015 voor de uitkomstmaat kosteneffectiviteit werd met één niveau verlaagd en werd beoordeeld met een matig niveau vanwege imprecisie van de effectschatting.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden werd een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
Wat is de effectiviteit van een tubectomie in vergelijking met een tubotomie bij de chirurgische behandeling van een tubaire EUG?
PICO
P tubaire EUG
I tubectomie
C tubotomie
O persisterende trofoblast en/of recidief EUG en/of fecunditeit, QOL en/of kosteneffectiviteit
Relevante uitkomstmaten
De werkgroep achtte fecunditeit in de toekomst een kritieke uitkomstmaat voor de besluitvorming. Persisterende trofoblast, recidief EUG, kwaliteit van leven en kosten werden voor de besluitvorming belangrijke uitkomstmaten geacht.
Methode
In de databases Medline (OVID), Embase en Cochrane werd met relevante zoektermen gezocht naar systematische reviews of meta-analyses, gerandomiseerde gecontroleerde studies of ander vergelijkend onderzoek vanaf 2011 tot heden, aansluitend op de publicatie van de NICE richtlijn Ectopic pregnancy and miscarriage (2012). De literatuurzoekactie leverde 76 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews of meta-analyses, gerandomiseerde gecontroleerde studies of ander vergelijkend onderzoek;
- waarin de effectiviteit van tubotomie en tubectomie als behandeling werd beschreven;
- bij vrouwen met een tubaire extra-uteriene graviditeit.
Op basis van titel en abstract werden in eerste instantie acht studies voorgeselecteerd. Na raadpleging van de volledige tekst werden zes studies geëxcludeerd en twee studies definitief geselecteerd. De search is uitgevoerd voor de publicatie van een Cochrane review (Mol, 2015). Na publicatie van deze review werd besloten dat een extra studie over kosteneffectiviteit werd geïncludeerd omdat deze paste binnen de zoekcriteria.
Resultaten
Drie studies werden opgenomen in de literatuuranalyse.
Referenties
- Ectopic pregnancy and miscarriage: diagnosis and initial management. NICE guidelines [CG154]. December 2012
- Bangsgaard N1, Lund CO, Ottesen B, Nilas L. Improved fertility following conservative surgical treatment of ectopic pregnancy. BJOG. 2003 Aug;110(8):765-70.
- Calcagno A1, Londero AP, Haag T, Driul L, Bertozzi S, Grassi T, Marchesoni D, Manhes H. Surgical treatment of ectopic pregnancy associated with predisposing factors of tuboperitoneal infertility. Minim Invasive Ther Allied Technol. 2013 Apr;22(2):97-103.
- Fernandez H, Capmas P, Lucot JP, Resch B, Panel P, Bouyer J, et al. Fertility after ectopic pregnancy: the DEMETER randomized trial. Hum Reprod. 2013;28(5):1247-53
- Mol F, van Mello NM, Strandell A, Strandell K, Jurkovic D, Ross J, et al. Tubotomy versus tubectomy in women with tubal pregnancy (ESEP study): an open-label, multicentre, randomised controlled trial. Lancet. 2014;383(9927):1483-9
- Mol F1, van Mello NM2, Strandell A3, Jurkovic D4, Ross JA5, Yalcinkaya TM6, Barnhart KT7, Verhoeve HR8, Graziosi GC9, Koks CA10, Mol BW11, Ankum WM2, van der Veen F12, Hajenius PJ2, van Wely M12; European Surgery in Ectopic Pregnancy (ESEP) study group; European Surgery in Ectopic Pregnancy ESEP study group. Cost-effectiveness of tubotomy and tubectomy in women with tubal pregnancy (a randomized controlled trial). Hum Reprod. 2015 Jul 13.
- Mol BW1, Matthijsse HC, Tinga DJ, Huynh T, Hajenius PJ, Ankum WM, Bossuyt PM, van der Veen F. Fertility after conservative and radical surgery for tubal pregnancy. Hum Reprod. 1998 Jul;13(7):1804-9.
- Tahseen S1, Wyldes M. A comparative case-controlled study of laparoscopic vs laparotomy management of ectopic pregnancy: an evaluation of reproductive performance after radical vs conservative treatment of tubal ectopic pregnancy. J Obstet Gynaecol. 2003 Mar;23(2):189-90.
Evidence tabellen
Tabel Exclusie na het lezen van het volledige artikel
|
Tabel Exclusie na het lezen van het volledige artikel |
|
|
Auteur en jaartal |
Redenen van exclusie |
|
Becker et al 2011 |
Een cohortstudie, voorkeur voor RCT inclusie |
|
Odejinmi F et al 2014 |
Is een samenvatting van de ESEP- trial (Mol et al 2014) |
|
Tulandi T. et al 2014 |
Is een bespreking van de ESEP-trial (Mol et al 2014) |
|
Stock et al 2012 |
Sluit niet aan op de uitgangsvraag |
|
Saranovic 2014 |
Sluit niet aan op de uitgangsvraag |
|
Varma et al 2011 |
Een cohortstudie, voorkeur voor RCT inclusie |
| Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1 This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used | |||||||
| Study reference | Study characteristics | Patient characteristics 2 | Intervention (I) | Comparison / control (C) 3 | Follow-up | Outcome measures and effect size 4 | Comments |
| Mol 2014 | Type of study: Open label RCT | Inclusion criteria: | During surgery | In women assigned to salpingectomy, all techniques were allowed such as clamping, cutting and suturing, use of bipolar forceps and scissors, bipolar | Length of follow-up: 36 months | Primary outcome Ongoing pregnancy2 rate by natural conception: Salpingotomy: 60.7 | Definitions: |
| ( ESEP trial) | -presumptive diagnosis1 of tubal pregnancy and scheduled for surgery | women were randomly assigned to salpingotomy or salpingectomy. | cutting forceps, | % | 1presumptive | ||
| vessel sealing instruments, ultrasonic devices and endeloop snares. | Loss-to-follow-up: Salpingotomy (N): 11 No reasons reported Salpingectomy (N): 13 | Salpingectomy: 56.2 | diagnosis was reached by an algorithm based on transvaginal ultrasonography with serum human chorionic gonadotropin (hCG) measurements | ||||
| Setting: Inpatients, multicentre | In women | No reasons reported | % | ||||
| Exclusion criteria: | assigned to | Fecundity rate ratio: 1.06, 95 % CI 0.81 – | 2Ongoing pregnancy was defined as intrauterine pregnancy visible on ultrasound at a gestational age of ≥ 12 weeks with fetal cardiac activity or a pregnancy that resulted in livebirth | ||||
| Country: The Netherlands, | -Women aged < 18 yr | salpingotomy a linear salpingotomy was done. | Incomplete outcome data: | 1.38 | |||
| Sweden, UK and USA | -haemodynamically unstable | Salpingotomy: | 3 Persistent trophoblast was defined as rising or | ||||
| -no desire for future pregnancy | Whenever necessary salpingotomy was converted to salpingectomy and laparoscopy was converted to open surgery. | -N: 43 converted to salpingectomy because of | Secondary outcome Persistent trophoblast3 (RR, 95 | ||||
| Source of funding: | -pregnant after IVF | persistent tubal | % CI) | ||||
| Non- commercial | -women with only one tube, contralateral tubal occlusion or hydrosalpinx documented at previous hysterosalpinogography or laparoscopy | bleeding during initial surgery | 15.0 (95 % CI 2.0 – | ||||
| - N: 3 salpingectomy at reintervention because of | 113.4) | ||||||
| N total at baseline: Salpingotomy: 215 | suspected tubal bleeding | ||||||
| Salpingectomy: 231 | - N: 5 salpingectomy because of | Repeat ectopic pregnancy4 (RR, 95 % CI) | |||||
| 1,6 (0.8 – 3.3) | |||||||
| Important prognostic factors2: | persistent trophoblast | plateauing serum hCG concentrations postoperatively that necessitated systemic methotrexate treatment or surgical intervention | |||||
| Age (mean± SD): | |||||||
| Salpingotomy: 30.9 | Salpingectomy: | 4Any ectopic pregnancy or persisting pregnancy of unknown location for which surgery or medical treatment with methotrexate was necessary | |||||
| (5.5) | No incomplete outcome data | ||||||
| Salpingectomy: 30.9 | Conclusion: | ||||||
| (5.5) | The authors conclude that salpingotomy does not significantly improve fertility prospects compared with salpingectomy in women with tubal pregnancy and a healthy contralateral tube. However taken patient preference in mind, salpingectomy should be preferred. | ||||||
| Sex: 100 % Female History of ectopic pregnancy (N, %): Salpingotomy: 9 (4) | |||||||
| Salpingectomy: 5 (2) | |||||||
| Groups comparable at baseline? | |||||||
| Yes, no imbalances between groups are noted | |||||||
| Mol 2015 | Type of study: Open label RCT with cost- | Inclusion criteria ESEP trial: | During surgery | In women assigned to salpingectomy, all techniques were allowed such as | Length of follow-up: 36 months | Direct medical costs (mean) Salpingotomy: € 3319 | Definitions: |
| -presumptive diagnosis1 of tubal pregnancy and | women were randomly assigned | 1presumptive | |||||
| Loss-to-follow-up: | diagnosis was reached by an | ||||||
| effectiveness analysis | scheduled for surgery | to salpingotomy or salpingectomy. | clamping, cutting and suturing, use of bipolar forceps and scissors, bipolar | Salpingotomy (N): 11 No reasons reported Salpingectomy (N): 13 | Salpingectomy: € 2958 | algorithm based on transvaginal ultrasonography with serum human chorionic gonadotropin (hCG) measurements | |
| cutting forceps, | No reasons reported | Mean difference: € 361 (95 % CI € 217 - € | |||||
| Setting: Inpatients, multicentre | Exclusion criteria ESEP trial: | In women | vessel sealing instruments, ultrasonic devices and endeloop snares. | 515) | 2Ongoing pregnancy was defined as intrauterine pregnancy visible on ultrasound at a gestational age of ≥ 12 weeks with fetal cardiac activity or a pregnancy that resulted in livebirth | ||
| -Women aged < 18 yr | assigned to | Incomplete outcome data: | |||||
| Country: The Netherlands, | -haemodynamically unstable | salpingotomy a linear salpingotomy was done. | Salpingotomy: | ICER | 3 Persistent trophoblast was defined as rising or plateauing serum hCG concentrations postoperatively that necessitated systemic methotrexate treatment or surgical intervention | ||
| Sweden, UK and USA | -no desire for future pregnancy | -N: 43 converted to salpingectomy because of | € 40 982 (95 % € | ||||
| -pregnant after IVF | Whenever necessary salpingotomy was converted to salpingectomy and laparoscopy was converted to open surgery. | persistent tubal | 130319 – 145 491) | 4Any ectopic pregnancy or persisting pregnancy of unknown location for which surgery or medical treatment | |||
| Source of funding: | -women with only one tube, contralateral tubal occlusion or hydrosalpinx documented at previous hysterosalpinogography or laparoscopy | bleeding during initial surgery | |||||
| Non- commercial | Direct medical | - N: 3 salpingectomy at reintervention because of | |||||
| N total at baseline: Salpingotomy: 215 | costs5 were assessed from a hospital perspective. | suspected tubal bleeding | |||||
| Salpingectomy: 231 | - N: 5 salpingectomy because of | ||||||
| persistent trophoblast | |||||||
| Important prognostic factors2: | |||||||
| Age (mean± SD): | Salpingectomy: | ||||||
| Salpingotomy: 30.9 | No incomplete outcome data | ||||||
| (5.5) | |||||||
| Salpingectomy: 30.9 | |||||||
| (5.5) | |||||||
| Sex: 100 % Female History of ectopic pregnancy (N, %): Salpingotomy: 9 (4) | |||||||
| Salpingectomy: 5 (2) | |||||||
| Groups comparable at baseline? | with methotrexate was necessary. | ||||||
| Yes, no imbalances between groups are noted | |||||||
| 5 Direct medical costs included the surgical treatment of the initial tubal pregnancy, readmissions including reinterventions, treatment for persistent trophoblast and | |||||||
| interventions for repeat ectopic pregnancy | |||||||
| Conclusion: | |||||||
| The authors conclude that salpingotomy resulted in a higher ongoing pregnancy rate compared with salpingectomy leading to an ICER of | |||||||
| € 40 982 per ongoing pregnancy. So the mean costs are higher after salpingotomy compared to salpingectomy without benefits in ongoing pregnancy rates. They advise to | |||||||
| perform an salpingectomy, supported by patient preferences. | |||||||
| Fernandez (2013) | Type of study: RCT | Inclusion criteria: | Arm 1 (less active ectopic pregnancy i.e.Fernandez1 score < 13 and no haemodynamic failure)): | Arm 2 (active ectopic pregnancies i.e. Fernandez score ≥ | Length of follow-up: 5 yrs | Primary outcome: Intrauterine pregnancy rate (2 yrs after treatment): Arm 1: | Definitions: 1Fernandez score evaluates the activity level of ectopic pregnancy according to 6 items: |
| -women with an ectopic pregnancy confirmed by sonography (mass, sac or fetal pole seen outside the uterus) | Women were randomly allocated to: | 13 or clinical | - Conservative surgery: 71 % | gestational age, | |||
| Setting: Inpatients, multicentre | - a conservative surgery with a systematic post- operative i.m. methotrexate injection within 24 h or | suspicion or rupture) | Loss-to-follow-up: Arm 1: à | abdominal pain, blood level of hCG, progesterone, size of tubal mass and haemoperitoneum. When the score is low (< 13) the ectopic pregnancy is considered as low active and is less likely to cause a tubal rupture. | |||
| Exclusion criteria: | -an i.m. | - Conservative surgery: N: 8 (8%) No reasons reported | HR: 0.85 (95 % CI | ||||
| Country: France | -women whose ectopic pregnancy at inclusion occurred while they were using | methotrexate injection alone | Women were randomly allocated to either radical or conservative surgery. | 0.59 – 1.22) | Conclusion: | ||
| contraception | Radical surgery | Arm 2: à | Arm 2: | The authors conclude that two years after | |||
| Source of funding: | -women pregnant after IVF | Conservative surgery could be converted to radical surgery | consisted of laparoscopic salpingectomy and conservative surgery of a salpingotomy by laparoscopy with one injection of methotrexate in the first 24 hours. | - Conservative surgery: N: 8 (8%) No reasons reported | - Conservative surgery: 70 % | treatment no significant differences in subsequent fertility was found between women receiving medical treatment or conservative treatment for low | |
| Non- commercial (Paris Public Hospital System) | -single Fallopian tube | because of uncontrollable substantial bleeding. | - Radical surgery: N: 10 (10%) | - Radical surgery: 64 | |||
| Conservative surgery could be converted to radical surgery | No reasons reported | % | |||||
| N total at baseline: | because of uncontrollable substantial bleeding. | HR: 1.06 (95 % CI | |||||
| Arm 1: 207 à | 0.69 – 1.63) | ||||||
| -Conservative surgery: N: 97 | Incomplete outcome data (did not attempt pregnancy): Arm 1: à | ||||||
| - Conservative surgery: N: 7 (8 %) | Secondary outcome: EP Recurrence: Arm 1: | ||||||
| Arm 2: 199 à | - Medical treatment: N: 16 (15.5 %) | -Conservative surgery: 12 % | |||||
| -Conservative surgery: N: 101 | Arm 2: à | ||||||
| - Radical surgery: 98 | - Conservative surgery: N: 30 (32%) | Arm 2: | |||||
| - Radical surgery: N: 22 (25%) | - Conservative surgery: 8 % | ||||||
| Important prognostic factors2: | - Radical surgery: | ||||||
| Age (mean, yrs) | 12.5 % | ||||||
| -Arm 1:29.28 | |||||||
| -Arm 2: 31.25 | |||||||
| Results remain | |||||||
| similar after | |||||||
| Smoking | adjustment for age, smoking/parity and centre | activity EP or | |||||
| -Arm 1: 39 % | between those undergoing radical or conservative surgical treatment for active EP. | ||||||
| -Arm 2: 42 % | |||||||
| Previous EP | |||||||
| -Arm 1: 2% | |||||||
| -Arm 2: 2% | |||||||
| Parity (mean) | |||||||
| -Arm 1: 0.80 | |||||||
| -Arm 2: 1.22 | |||||||
| Groups comparable at baseline? | |||||||
| No, arm 1 unbalanced for age and smoking. Arm 2 was unbalanced for age and parity. | |||||||
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls For cohort studies, provide sufficient detail on the (multivariate) analyses used to ad
| Risk of bias table for intervention studies | ||||||||
| Study reference | Describe method of randomisation1 | Bias due to inadequate concealment of allocation?2 | Bias due to inadequate blinding of | Bias due to inadequate blinding of care providers to treatment allocation?3 | Bias due to inadequate blinding of outcome assessors to treatment allocation?3 | Bias due to selective outcome reporting on basis of the results?4 | Bias due to loss to follow-up?5 | Bias due to violation of intention to treat analysis?6 |
| participants to treatment allocation?3 | ||||||||
| (first author, publication year) | (unlikely/likely/un clear) | (unlikely/likely/un clear) | ||||||
| (unlikely/likely/un clear) | (unlikely/likely/un clear) | (unlikely/likely/un clear) | (unlikely/likely/un clear) | |||||
| (unlikely/likely/un clear) | ||||||||
| Mol 2014 | The patients were randomly assigned to salpingectomy or salpingotomy during surgery, after confi rmation of the diagnosis of tubal pregnancy and confi rmation that the contralateral tube was healthy, | Unlikely | Likely (Open label RCT) | Unlikely (treatment could not be blinded, but protocol for | Likely (The researchers who collected data for fertility | Unlikely | Unclear | Unlikely |
| via a central internet-based program running a computer- generated randomisation sequence. | conversion to salpingectomy is clear described) | outcomes were masked to the assigned intervention, but those who analysed the data were not | ||||||
| Randomisation was stratifi ed | ) | |||||||
| by hospital, the woman’s age | ||||||||
| (<35 or ≥35 years), and history of tubal disease (ie, previous ectopic pregnancy, | ||||||||
| tubal surgery, or pelvic infl ammatory disease). | ||||||||
| Mol 2015 | Described in Mol 2014 | Described in Mol 2014 | Described in Mol 2014 | Described in Mol 2014 | Described in Mol 2014 | Described in Mol 2014 | Described in Mol 2014 | Described in Mol 2014 |
| Fernandez 2013 | Randomization was performed by a random sequence of treatments stratified by centre and balanced in blocks of sizes randomized from 2 to 6. A statistician generated | Unlikely | Unclear | Likely (treatment could not be blinded and no protocol described) | Unlikely (other | Unlikely | Unclear | Unlikely |
| the allocation sequence, whereas clinicians enrolled the women | person than physician) | |||||||
| and assigned them to their group. | ||||||||
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients loss to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients loss to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-12-2016
Laatst geautoriseerd : 01-12-2016
Geplande herbeoordeling : 01-01-2022
Deze richtlijn dient te worden herzien binnen een termijn van maximaal 5 jaar na publicatie in het NTOG en op de website van de NVOG en op de Richtlijnendatabase (www.richtlijnendatabase.nl).
Verder moet herziening overwogen worden wanneer nieuwe wetenschappelijk verantwoord vastgestelde inzichten belangrijke wijzigingen in de gegeven aanbevelingen en conclusies van deze richtlijn noodzakelijk maken. Daarnaast is het van belang de belangrijke andere bestaande richtlijnen te volgen en bij herziening van de inhoud daarvan herziening van deze richtlijn te overwegen. Tenslotte dient herziening ook overwogen te worden wanneer op de geformuleerde kennishiaten een afdoend wetenschappelijk verantwoord antwoord is gegeven.
De NVOG is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De NVOG is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Doel en doelgroep
Doel van de richtlijn
Een vrouw met een extra-uteriene graviditeit (EUG) kan zich presenteren zonder of met klachten. Klassieke klachten zijn buikpijn en/of bloedverlies bij een positieve zwangerschapstest. De echoscopische bevindingen kunnen daarbij direct bevestigend zijn voor de diagnose waarbij een zwangerschapsweefsel wel of niet intra/extra-uterien wordt gezien. Een minderheid van deze patiënten zal een EUG hebben. In deze situatie van Zwangerschap met Onbekende Lokalisatie (ZOL; pregnancy with unknown location (PUL)) is het van belang om de diagnose EUG of vroege vitale of niet vitale intra-uteriene zwangerschap accuraat en in een vroeg stadium rond te krijgen. Het serum- hCG in combinatie met een transvaginale echoscopie speelt hierbij een grote rol.
Er zijn verschillende behandelingsopties voor een EUG: een afwachtend beleid (monitoren), een niet- invasieve methotrexaat (MTX) behandeling of een operatieve behandeling. Geprobeerd moet worden de meest effectieve behandeling te kiezen die aansluit bij een (eventueel toekomstige) kinderwens. In deze richtlijn wordt besproken hoe de diagnose EUG te stellen en worden aanbevelingen gedaan ten aanzien van de behandelingsmogelijkheden. Deze richtlijn moet ertoe bijdragen dat elke hulpverlener die een patiënte met een mogelijke ZOL/EUG ziet deze zo effectief en veilig mogelijk kan onderzoeken en behandelen, dan wel verwijzen (zie multidisciplinaire richtlijn “Diagnostiek acute buikpijn bij volwassenen”). Hierdoor kan zwangerschap gerelateerde morbiditeit en mortaliteit worden gereduceerd (Van Mello, 2012).
De NVOG richtlijn “Tubaire EUG, diagnostiek en behandeling” werd in 2001 goedgekeurd. Inmiddels zijn er relevante studies verricht op het gebied van diagnostiek en de niet-invasieve en chirurgische interventies die patiënten met een EUG mogelijk een betere behandeling kunnen bieden.
Beoogde gebruikers van de richtlijn
Deze richtlijn is primair geschreven voor gynaecologen maar kan gebruikt worden door andere beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een zwangerschap en ZOL/EUG, zoals huisartsen, verloskundigen, SEH-artsen (en andere specialisten die betrokken zijn bij een acute buik), echoscopisten en abortusartsen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een Monodisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de NVOG. De werkgroepleden zijn door de NVOG gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Namens de NVOG
Dr. M.H. van der Gaast, gynaecoloog, Havenziekenhuis, Rotterdam (voorzitter) Dr. W.M. Ankum, gynaecoloog, AMC, Amsterdam
Dr. S.F.P.J. Coppus, gynaecoloog, Radboudumc, Nijmegen Dr. F. Mol, gynaecoloog, AMC, Amsterdam
Dr. A. J.C.M. van Dongen, gynaecoloog, Radboudumc, Nijmegen Dr. N. M. van Mello, gynaecoloog, Radboudumc, Nijmegen
Dr. I. A.J. van Rooij, gynaecoloog, ETZ, Tilburg
Dr. S. J. Tanahatoe, gynaecoloog, UMCU, Utrecht
Drs. H. Visser, gynaecoloog, Ter-Gooi Ziekenhuis, Hilversum
Methodologische begeleiding van de werkgroep
Mw. A. Rozeboom MSc, junior adviseur Kennisinstituut van Medisch Specialisten te Utrecht Drs. E.M.E. den Breejen, senior adviseur, Kennisinstituut van Medisch Specialisten te Utrecht Dr. M.A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten te Utrecht
Belangenverklaringen
De “KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroep-lid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie- management |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
Getekend |
|
Van der Gaast |
Voorzitter, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Ankum |
Lid, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Coppus |
Lid, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Mol |
Lid, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Van Dongen |
Lid, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Van Mello |
Lid, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Van Rooij |
Lid, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Tanahatoe |
Lid, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Visser |
Lid, gynaecoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Rozeboom |
Junior adviseur Kennisinstituut van Medisch Specialisten |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Den Breejen |
Adviseur Kennis- instituut van Medisch Specialisten |
Promovendus, Radboudumc, Nijmegen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
|
Pols |
Senior adviseur Kennisinstituut van Medisch Specialisten |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het vragen van input op het raamwerk van de richtlijn en de daaruit voortvloeiende belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. Daarnaast werden indicatoren ontwikkeld om de implementatie van de richtlijn in de praktijk te bevorderen. Deze zijn ook te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org), een internationaal breed geaccepteerd instrument, en op de ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers namens de NVOG, NHG, NPCF, KNOV, IGZ en ZN via een enquête. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen:(AHRQ, NICE, CBO, SUMsearch en SIGN) en naar systematische reviews in de Cochrane Library en via SUMsearch. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
|
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE- methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van zorg bij EUG en ZOL'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes (zie aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd of geaccordeerd.
Literatuur
Bouyer J, Coste J, Fernandez H, Pouly JL, Job-Spira N. Sites of ectopic pregnancy: a 10 year population-based study of 1800 cases. Hum Reprod. 2002 Dec;17(12):3224-30.
Farmacotherapeutisch Kompas. https://www.farmacotherapeutischkompas.nl/
Jauniaux E, Farquharson RG, Christiansen OB, Exalto N. Evidence-based guidelines for the investigation and medical treatment of recurrent miscarriage. Hum Reprod. 2006;21:2216-22.
Jurkovic D, Mavrelos D. Catch me if you scan: ultrasound diagnosis of ectopic pregnancy. Ultrasound Obstet Gynecol 2007; 30: 1–7.
Kirk E, Bottomley C, Bourne T. Diagnosing ectopic pregnancy and current concepts in the management of pregnancy of unknown location. Hum Reprod. Update 2014 20 (2): 250 – 61.
RCOG Green-top Guideline No 21. Diagnosis and Management of Ectopic Pregnancy. July 2015.
Schutte JM, Steegers EA, Schuitemaker NW, Santema JG, de Boer K, Pel M, Vermeulen G, Visser W, van Roosmalen J. Netherlands Maternal Mortality Committee. Rise in maternal mortality in the Netherlands. BJOG. 2010 Mar;117(4):399-406.
Van Mello NM, Zietse CS, Mol F, Zwart JJ, van Roosmalen J, Bloemenkamp KW, Ankum WM, van der Veen F, Mol BW, Hajenius PJ. Severe maternal morbidity in ectopic pregnancy is not associated with maternal factors but may be associated with quality of care. Fertil Steril. 2012 Mar;97(3):623-9.
Van Oppenraaij RHF, Goddijn M, Lok CAR Exalto N. Ned Tijdschr Geneeskd. 2008;152:20-4.
Wilkinson H; Trustees and Medical Advisers. Saving mothers' lives. Reviewing maternal deaths to make motherhood safer: 2006-2008. BJOG. 2011 Oct;118(11):1402-3; 1403-4.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
