Weefselverwerking bij poliepectomie
Uitgangsvraag
Hoe dient het endoscopisch verwijderde weefselspecimen te worden aangeleverd en verwerkt voor een optimale histologische beoordeling?
Aanbeveling
Lever elk poliepectomie preparaat (ook poliepectomieën middels biopt) in een aparte container aan, ter voorkoming van onduidelijkheden over het aantal, de radicaliteit en de lokalisatie van verschillende laesies.
Poliepectomie preparaten van neoplastische laesies endoscopisch verdacht voor maligniteit dienen te worden georiënteerd en opgespeld.
De afmetingen van de poliepectomie preparaten worden door de patholoog aangegeven en de neoplastische laesie wordt beschreven inclusief de grootste diameter hiervan. De door de patholoog gemeten grootste diameter is leidend als deze groter is dan de grootste afmeting die door de endoscopist is aangegeven.
En bloc poliepectomie preparaten vanaf 10 mm die georiënteerd zijn aangeleverd en poliepectomie preparaten endoscopisch verdacht voor een T1 carcinoom bij voorkeur fotografisch documenteren en inkten ter plaatse van het resectievlak (eventueel een tweede kleur inkt bij defect).
Het uitsnijden van poliepectomie preparaten van gesteelde poliepen gebeurt bij voorkeur in lamellen van 3 mm parallel aan de steel.
Snijdt de steel er niet eerst af bij een poliepectomie van een gesteelde poliep.
Snijdt de poliepectomie preparaten van niet gesteelde poliepen in lamellen van 3 mm, loodrecht op het diepe resectievlak, en sluit elk lamel in een cassette in.
Halveer lange lamellen (> 15 mm) indien torsie van de lamel aannemelijk is. Het wordt aanbevolen om de meest bedreigde resectierand in een lamel te laten terugkomen.
Alle neoplastische laesies dienen totaal te worden ingesloten.
Overwegingen
De prevalentie van T1 CRC carcinomen in poliepen kleiner dan 10 mm is heel laag ten opzichte van poliepen van 10 mm of groter, en het overgrote deel is niet diep invasief (Gupta, 2012; Sakamoto, 2013). Uit praktische overwegingen wordt ervoor gekozen om fotografisch te documenteren en te inkten bij georiënteerd aangeleverde poliepectomie preparaten vanaf 10 mm of bij endoscopisch poliepen verdacht voor T1 CRC.
In de huidige aanbeveling wijken we af van de Engelse richtlijnen (Royal College of Pathologists, 2017; NHS, 2018) en oorspronkelijke beschrijving van Burroughs en Williams (2000), in de zin dat we het meest bedreigde resectievlak leidend laten zijn voor de oriëntatie van de lamellen. Dit om te voorkomen dat er kleine niet te oriënteren restant driehoekjes ontstaan die de beoordeling van het resectievlak compromitteren.
In de Europese richtlijn (Quirke, 2011) staat aanbevolen om bij de histologische beoordeling standaard meerdere niveaus te snijden van blokken van neoplastische laesies. De winst die hiermee te behalen is, is onzeker en het proces is arbeidsintensief, mede gezien de huidige aanbeveling om de neoplastische laesies reeds totaal in te sluiten. Deze aanbeveling is daarom vooralsnog niet overgenomen.
Onderbouwing
Achtergrond
De histologische beoordeling van neoplastische laesies in poliepen speelt een belangrijke rol in het management van patiënten die een poliepectomie ondergaan en heeft directe consequenties voor het klinisch beloop van deze patiënten. Een accurate diagnose is hierdoor van cruciaal belang. Deze is sterk afhankelijk van de manier waarop het specimen wordt aangeleverd en verwerkt.
In de huidige richtlijn worden meerdere histologische risicofactoren beschreven voor het hebben van lymfkliermetastasen in T1 carcinomen:
- differentiatiegraad (weinig/ongedifferentieerd);
- lymfvat en veneuze invasie;
- diepte van invasie;
- positief resectievlak;
- budding/PDC.
Er wordt aanbevolen om voor de verslaglegging gebruik te maken van de Palga protocol module.
Voor de definitie en individuele voorspellende waarde van deze risicofactoren wordt verwezen naar de Landelijke Richtlijn colorectaal carcinoom.
Samenvatting literatuur
De aanwezige literatuur over de verwerking van poliepectomie preparaten is summier. Burroughs en Williams beschreven in 2000 specimen handling van poliepectomie preparaten als best practice (Burroughs, 2000) en worden nog geciteerd in de huidige Engelse richtlijn (Loughrey, 2018; NHS, 2012). Aanbevelingen die in deze module worden gedaan zijn daarom met name gebaseerd op Engelse en Europese richtlijnen (Royal College of Pathologists, 2017; NHS, 2018; Quirke, 2011).
In de Europese richtlijnen wordt het belang van weefselverwerking aangehaald en worden aanbevelingen gedaan omtrent het aanleveren en verwerken van endoscopisch verwijderde poliepen. Hiernaast wordt de discrepantie tussen de histologische diagnose op een biopt en die op een en bloc verwijderde laesie middels poliepectomie, EMR/ESD of chirurgische resectie aangekaart (Quirke, 2011).
Wijze van aanleveren
Bij voorkeur wordt elk poliepectomie preparaat (ook poliepectomieën middels biopt) apart in een container aangeleverd ter voorkoming van onduidelijkheden over het aantal, de radicaliteit en de lokalisatie van de verschillende laesies. Laesies verdacht voor maligniteit worden bij voorkeur en bloc gereseceerd, zodat het resectievlak en hiermee de beoordeling van de radicaliteit gewaarborgd blijft. Voor een optimale beoordeling dient het specimen te worden georiënteerd en opgespeld. Dit voorkomt tangentiële aansnijding en bemoeilijking van de beoordeling van de ligging van een eventuele hooggradige neoplasie danwel invasieve groei ten opzichte van de m. mucosae. Indien een laesie verdacht voor maligniteit piecemeal wordt verwijderd is het voor de beoordeling van invasieve groei ten opzichte van de m. mucosae van belang om, indien mogelijk, de delen (of in elk geval het verdachte deel) te oriënteren en op te spelden.
Tips and tricks
- Mucosectomieëen (ESD, EMR) georiënteerd zonder te veel tractie opgespeld op een plaat (piepschuim, was, etcetera) aanleveren.
- Bij gesteelde poliepen met een moeilijk te herkennen steel kan er een dunne naald door de steel op een plaat worden gepind ter oriëntatie. Bij voorkeur gebeurt dit niet door de neoplastische laesie heen, echter indien niet vermijdbaar bij voorkeur door de kop van de gesteelde poliep heen richting de steel opspelden ter voorkoming van prikaccidenten.
- Indien een poliepectomie preparaat verdacht voor maligniteit piecemeal wordt verwijderd, dan bij voorkeur met elk deel (of in ieder geval het verdachte deel) georiënteerd opgespeld op een plaat.
Klinische gegevens
Bij de klinische gegevens dienen minimaal het type ingreep (biopt, poliepectomie, en bloc, piecemeal), de lokalisatie in het colon danwel rectum en de aard van de neoplastische laesie (gesteeld, niet gesteeld), het aspect van de neoplastische laesie en de geschatte diameter hiervan te worden aangegeven. Vermeld hiernaast eventuele bijzonderheden (voorgeschiedenis (bijvoorbeeld FAP), complicaties, klinische diagnose, verdenking op maligniteit, eerdere biopt en/of studies).
Macroscopische beschrijving
Het preparaat wordt indien gemarkeerd, georiënteerd en het aantal delen (biopten) wordt aangeven. De afmetingen van het poliepectomie preparaat worden aangegeven in millimeters en het aspect van de neoplastische laesie wordt beschreven inclusief de grootste diameter hiervan.
En bloc poliepectomie preparaten groter dan 10 mm die georiënteerd zijn aangeleverd en en bloc poliepectomie preparaten endoscopisch verdacht voor een T1 carcinoom worden bij voorkeur fotografisch gedocumenteerd en geïnkt ter plaatse van het resectievlak (eventueel een tweede kleur inkt bij defect). Tevens wordt de minimale afstand tot het laterale resectievlak gemeten ter optimale terugkoppeling bij het klinisch overleg en/of de multidisciplinaire bespreking. Fotografische documentatie van zowel het slijmvlies met de neoplastische laesie(s), als van de bodem worden aanbevolen. Het is zeer gewenst dat de endoscopist bij verdenking op een T1 carcinoom, de poliep georiënteerd opstuurt naar het pathologielaboratorium.
Afmeting poliepectomie
|
Richtlijn |
Conclusion |
|
ESGE |
Omvang is een belangrijke objectieve maat die het beste wordt uitgevoerd door of onder supervisie van een patholoog door het meten van de grootste diameter. De maximale diameter wordt altijd macroscopisch gemeten, maar wordt bij controlemeting tijdens de microscopie indien nodig aangepast. Deze laatste diameter wordt dan aanbevolen om aan te houden. |
|
Nederlandse richtlijn BVO |
De endoscopist stelt de grootte van de poliep vast tenzij de meting van de patholoog groter blijkt te zijn, dan overrulet deze de waarneming van de endoscopist. |
Fotografische documentatie en inkten van het resectievlak
|
Richtlijn |
Conclusion |
|
ESGE 2017 |
Inking of margins is recommended |
|
Royal College of Pathologists Dataset for histopathological reporting of colorectal cancer - December 2017 (Loughrey, 2018) |
The margins of larger, sessile or semipedunculated lesions should be painted and the whole of the specimen transversely sectioned into 3 mm slices and submitted for histology in sequentially labelled cassettes.
Macroscopic images of the intact and sliced specimen may be helpful to illustrate margin status. |
|
NHS Bowel cancer screening program Guidance on reporting lesions - Mei 2021 |
If there is any suspicion of malignancy within a local excision specimen at endoscopic procurement or at dissection, it is advisable to paint any identifiable resection margins
Macroscopic images are helpful to illustrate margin status and block sampling. |
Uitsnijden
Het uitsnijden van poliepectomie preparaten van gesteelde poliepen gebeurt bij voorkeur in lamellen van 3 mm parallel aan de steel. Het verdient aanbeveling om bij het uitsnijden van gesteelde poliepen de steel niet eerst eraf te snijden en apart in te sluiten in verband met de kans op bemoeilijking van de beoordeling van de neoplasie ten opzichte van de m. mucosae en van invasie versus pseudo-invasie in de submucosa; voorts van de beoordeling van het invasieve front bij T1 carcinomen en de beoordeling van de radicaliteit.
De poliepectomie preparaten van niet gesteelde poliepen worden in lamellen van 3 mm gesneden loodrecht op het diepe resectievlak. Het wordt aanbevolen om de meest bedreigde resectierand in een lamel te laten terugkomen. Indien de verkregen lamellen te lang zijn (> 15 mm) waardoor torsie aannemelijk is, dienen deze te worden gehalveerd ter voorkoming hiervan.
Gesteelde poliepen
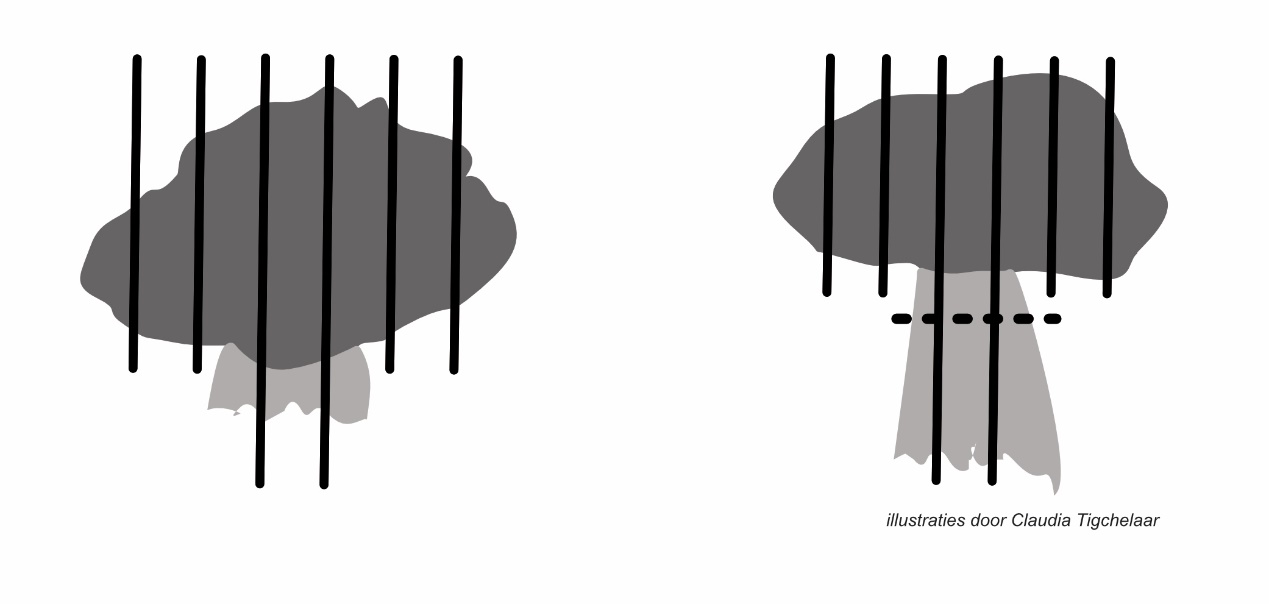
Niet gesteelde poliepen
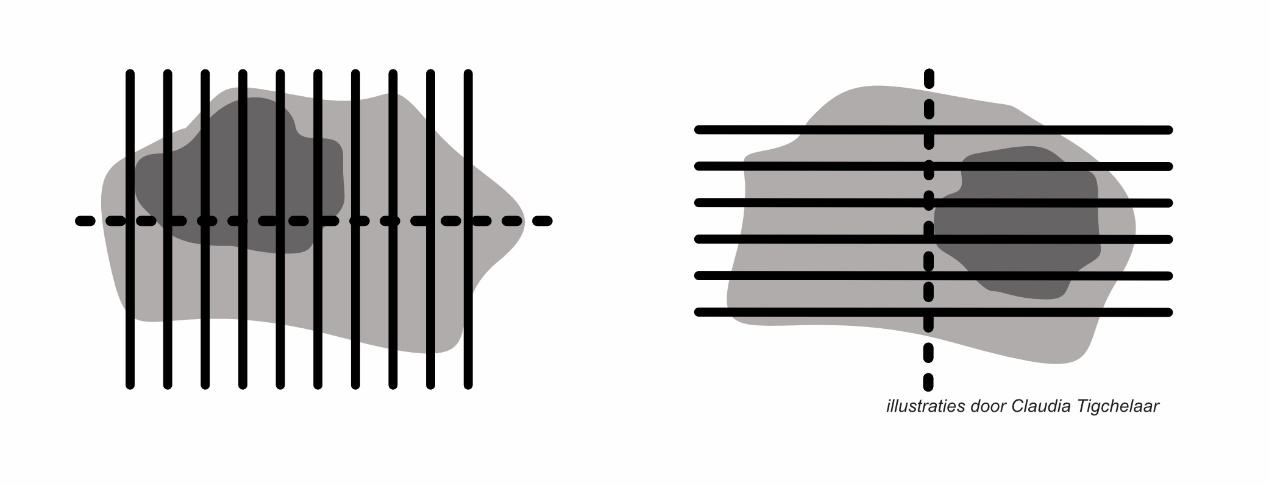
Alle neoplastische laesies dienen totaal te worden ingesloten om het risico van onderdiagnostiek te beperken.
Referenties
- Burroughs, S. H., & Williams, G. T. (2000). Examination of large intestine resection specimens. Journal of clinical pathology, 53(5), 344-349.
- Gupta, N., Bansal, A., Rao, D., Early, D. S., Jonnalagadda, S., Wani, S. B.,... & Rastogi, A. (2012). Prevalence of advanced histological features in diminutive and small colon polyps. Gastrointestinal endoscopy, 75(5), 1022-1030.
- NHS (2021). Bowel cancer screening programme Guidance on reporting lesions – Updated May 2021. (Geraadpleegd via: https://www.gov.uk/government/publications/bowel-cancer-screening-reporting-lesions/bowel-cancer-screening-guidance-on-reporting-lesions#standards op 30 juli 2021).
- Loughrey, M. B., Quirke, P., & Shepherd, N. A. (2018). Standards and datasets for reporting cancers Dataset for histopathological reporting of colorectal cancer September 2018. (Avialable at: https://www. rcpath. org/resourceLibrary/g049-dataset-for-histopathological-reporting-of-colorectalcancer. html accessed July 30, 2021).
- Sakamoto, T., Matsuda, T., Nakajima, T., & Saito, Y. (2013). Clinicopathological features of colorectal polyps: evaluation of the ‘predict, resect and discard’strategies. Colorectal Disease, 15(6), e295-e300.
- Quirke, P., Risio, M., Lambert, R., Von Karsa, L., & Vieth, M. (2011). Quality assurance in pathology in colorectal cancer screening and diagnosis—European recommendations. Virchows Archiv, 458(1), 1-19.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 02-02-2022
Laatst geautoriseerd : 02-02-2022
Geplande herbeoordeling : 01-01-2027
Uiterlijk in 2026 bepaalt het bestuur van de NVMDL of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVMDL is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De voorliggende richtlijn betreft een herziening van de NVMDL richtlijn Endoscopische poliepectomie van het colon uit 2019. Alle modules zijn beoordeeld op actualiteit. Vervolgens is een prioritering aangebracht welke modules een daadwerkelijke update zouden moeten krijgen. Hieronder staan de modules genoemd met de wijzigingen. Tevens is per module een inschatting gemaakt voor de beoordeling voor herziening.
|
Uitgangsvraag/onderwerpen |
Wijzigingen richtlijn 2021 |
Uiterlijk jaar voor herziening |
|
Randvoorwaarden voor poliepectomie |
Minimale (tekstuele) aanpassingen |
2026 |
|
Minuscule poliepen ≤ 5 mm en poliepen tussen 10 en 20 mm |
Minimale (tekstuele) aanpassingen |
2026 |
|
Poliepen 6 – 9 mm |
Gereviseerd |
2026 |
|
Sessiele en vlakke poliepen > 20 mm |
Gereviseerd |
2026 |
|
Herkenning van een potentieel maligne poliep |
Gereviseerd |
2026 |
|
Verwijdering van een potentieel maligne poliep |
Wordt behandeld in de CRC richtlijn |
- |
|
Behandeling en preventie van complicaties |
Minimale (tekstuele) aanpassingen |
2026 |
|
Preventief dichtclippen van wondvlak |
Nieuw ontwikkeld |
2026 |
|
Lokaal recidief na poliepectomie |
Gereviseerd |
2026 |
|
Behandeling van lokaal recidief |
Nieuw ontwikkeld |
2026 |
|
Pathologie: biopteren |
Nieuw ontwikkeld |
2026 |
|
Pathologie: weefselverwerking |
Minimale (tekstuele) aanpassingen |
2026 |
|
Prestatie indicatoren |
Minimale (tekstuele) aanpassingen |
2026 |
Belangrijkste wijzigingen ten opzichte van vorige versie
In de gereviseerde modules is de literatuur opnieuw systematisch gezocht en/of is de literatuursamenvatting aangepast. De strekking van de aanbevelingen is nagenoeg hetzelfde gebleven. Tevens zijn er drie nieuwe modules aan de richtlijn toegevoegd. De overige modules zijn opnieuw beoordeeld waarbij er minimale (tekstuele) aanpassingen gedaan. De module 'Verwijderen van een potentieel maligne poliep' is teruggetrokken. Dit onderwerp komt terug in de richtlijn Colorectaal carcinoom.
Algemene gegevens
De ontwikkeling en herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in het voorjaar van 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die direct betrokken zijn bij de zorg voor patiënten met poliepen in het rectum en colon.
Werkgroep
- Dr. L.M.G. (Leon) Moons (voorzitter), MDL-arts UMC Utrecht, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. T. (Tom) Seerden (vice-voorzitter), MDL-arts Amphia Breda, Nederlandse Vereniging van Maag-Darm-Leverartsen
- B.A.J. (Barbara) Bastiaansen, MDL-arts Amsterdam UMC, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. J.J. (Jurjen) Boonstra, MDL-arts, LUMC Leiden, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. A.D. (Arjun) Koch, MDL-arts, Erasmus MC Rotterdam, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. B.W.M. (Marcel) Spanier, MDL-arts, Rijnstate ziekenhuis, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. Y. (Yara) Backes, MDL-arts i.o., Meander Medisch Centrum Amersfoort, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. L. (Lindsey) Oudijk, patholoog Erasmus MC Rotterdam, Nederlandse Vereniging voor Pathologie
- Dr. M.M. (Miangela) Laclé, patholoog UMC Utrecht, Nederlandse Vereniging voor Pathologie
- C. (Christiaan) Hoff, chirurg Medisch Centrum Leeuwarden, Nederlandse Vereniging voor Heelkunde
- R. (Ruud) Blankenburgh, Internist-Oncoloog Saxenburgh Hardenberg, Nederlandse Internisten Vereniging
Klankbordgroep
- J.J. (Jan) Meeuse, NIV
- S. (Silvie) Dronkers, Stichting Darmkanker
- J. (Jannie) Verheij - van der Wiel, Stomavereniging
- J.H.M.A. (Ans) Dietvorst, Stichting Lynch Polyposis
Met ondersteuning van
- Dr. A.N. (Anh Nhi) Nguyen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. E.V. (Ekaterina) van Dorp-Baranova, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Restrictie (zie ook tekst onder de tabel) |
|
Moons (voorzitter) |
MDL-arts, interventie endoscopist, UMC Utrecht, Utrecht, Nederland |
Geen |
Consultant Boston Scientific |
Geen |
|
Seerden (vice-voorzitter) |
MDL arts, Medisch specialistisch bedrijf Amphia te Breda |
Geen |
Geen |
Geen |
|
Bastiaansen |
MDL-arts Amsterdam UMC |
Geen |
Geen |
Geen |
|
Boonstra |
MDL-arts, LUMC, Leiden |
Geen |
Consultant Boston Scientific |
Geen |
|
Koch |
MDL-arts, Erasmus MC, Universitair Medisch Centrum Rotterdam |
Geen |
Consultant Boston Scientific. Pentax Medical, ERBE Elektromedizin, DrFalk Pharma |
Geen |
|
Spanier |
Als vrijgevestigd MDL-arts in dienst bij Cooperatie Medisch Specialisten Rijnstate u.a. (CMSR) |
Bestuurslid CMSR, 4 dagdelen, betaald, vergoeding naar vakgroep MDL Rijnstate |
Geen |
Geen |
|
Backes |
aios MDL, Meander Medisch Centrum Amersfoort |
Geen |
Geen |
Geen |
|
Oudijk |
Patholoog, Erasmus MC Rotterdam |
PPM patholoog Palga: Motiveren gebruik PALGA protocollen, contactpersoon voor PALGA rapportage gebruik protocollen, mede-pathologen en MDO-leden, clinici. Onbetaald. Lid wetenschappelijke commissie Dutch Thyroid Cancer Group: onbetaald. Lid wetenschappelijke adviescommissie Stichting Bijniernetwerk Nederland: onbetaald |
Geen |
Geen |
|
Laclé |
Patholoog UMC Utrecht |
Geen |
Geen |
Geen |
|
Hoff |
Chirurg Medisch Centrum Leeuwarden (via Heelkunde Friesland Groep) (0,6) medisch cobestuurder MCL 0,4) |
Geen |
Geen |
Geen |
|
Blankenburgh |
Internist-Oncoloog, Saxenburgh te Hardenberg |
Geen |
Geen |
Geen |
Het Kennisinstituut in zijn rol als methodologisch ondersteuner, de NVMDL als initiërende vereniging en de richtlijnwerkgroep zijn zich bewust van de belangen die spelen binnen de richtlijnwerkgroep, maar het werd toch noodzakelijk geacht om de betreffende inhoudelijk experts op dit gebied bij de richtlijn te betrekken. Tijdens de commentaarfase werd de NVMDL verzocht om bij het aanleveren van commentaar kritisch te zijn op de gemelde belangen en geformuleerde aanbevelingen en onderbouwing en om experts, vrij van belangen, expliciet te verzoeken om de richtlijn te beoordelen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden vanuit patiëntenverenigingen in de klankbordgroep met de conceptrichtlijn mee te laten lezen. De commentaren zijn besproken in de werkgroep en verwerkt. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Stichting Darmkanker, Stomavereniging en Stichting Lynch Polyposis.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen. De werkgroep heeft ook interne kwaliteitsindicatoren ontwikkeld.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging van Maag-Darm-Leverartsen, 2019) op noodzaak tot revisie. Op basis van de geprioriteerde knelpunten zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, en bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
