Iatrogene vroeggeboorte: maternale hypertensieve ziekte en foetale groeirestrictie
Uitgangsvraag
Is het zinvol om actieve neonatale opvang aan te bieden vóór 26 weken als er sprake is van foetale groeirestrictie en/of maternale hypertensieve ziekte tijdens de zwangerschap, waardoor er reden is om de bevalling na te streven?
Aanbeveling
Neem een laag geschat foetaal gewicht (SGA) met of zonder foetale groeirestrictie (FGR) als één van de factoren mee in de risico inschatting voor de keuze tussen actieve opvang of op comfort gerichte zorg bij extreme vroeggeboorte op het moment dat de bevalling nagestreefd moet worden op foetale indicatie en/of in verband met een maternale hypertensieve aandoening.
(zie figuur 1.5 Risico inschatting)
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De kwaliteit van de literatuur over de kans op (gezonde) overleving van kinderen met foetale groeirestrictie (FGR) die bovendien extreem vroeg, na een zwangerschapsduur van 24 tot 26 weken, worden geboren is beperkt. De meeste geselecteerde studies onderzoeken de neonatale uitkomsten van kinderen met een laag geboortegewicht (SGA) en focussen niet op zwangerschappen waarbij antenataal placentainsufficiëntie aannemelijk was (afbuigende groei, AC of EFW <P3 cq <P10, afwijkend dopplerpatroon al dan niet in combinatie met PIH), terwijl juist deze zwangeren een keuze moeten maken tussen comfort care en actief beleid.
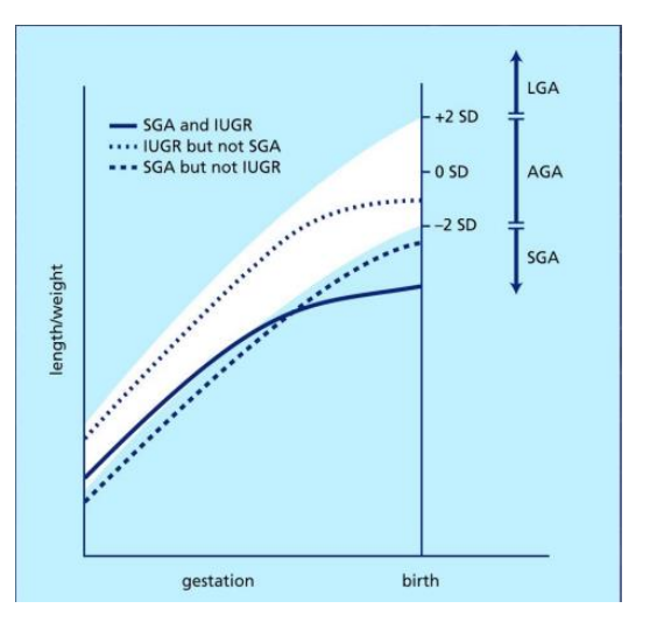
In de literatuur worden de termen small for gestational age (SGA) en intra-uteriene cq (nieuwere term) foetale groeirestrictie (IUGR/ FGR) niet consistent gebruikt. IUGR en FGR hebben betrekking op placenta insufficiëntie en duiden aan dat de foetus zijn groeipotentiaal niet bereikt. De intra-uteriene groeicurve is gekenmerkt door groeirestrictie c.q. afbuigende groei met of zonder afwijkende dopplermetingen. SGA geeft de relatie weer tussen foetaal of neonataal gewicht ten opzichte van normaalwaarden op het moment van de meting, bijv. (geschat) gewicht <P10 of <2SD. Bij het schrijven van deze module is ervoor gekozen om de nomenclatuur van het artikel over te nemen. De prognose van deze kinderen kan verschillend zijn waarbij het onderscheid tussen SGA en IUGR/FGR in individuele gevallen niet te maken is.
Figuur 1 Verschil IUGR en SGA (NVOG richtlijn FGR, 2017)
De bewijskracht van de literatuur wordt als zeer laag ingeschat. De reden hiervoor is dat er wel cohortstudies, maar geen RCT’s beschikbaar zijn. Dit heeft ermee te maken dat er geen interventie, maar de conditie FGR wordt onderzocht. De literatuur is dermate inhomogeen dat het nog niet mogelijk is om een meta-analyse te maken op de uitkomst mortaliteit.
Samenvattend hebben kinderen met een laag geboortegewicht (SGA) cq foetale groeirestrictie (FGR) die na een zwangerschapsduur van 24 tot 26 weken worden geboren mogelijk een verhoogd overlijdensrisico ten opzichte van kinderen met een normaal geboortegewicht voor deze termijn. Daarnaast lijkt de kans op sepsis, globale ontwikkelingsachterstand en beperkte sociale ontwikkeling verhoogd; voor BPD is dit risico onduidelijk. Uit de literatuur blijkt geen verhoogd risico op NEC en PVL, motorische en taalontwikkeling. Het risico op IVH zou zelfs lager kunnen zijn bij kinderen met FGR. Maternale hypertensie heeft geen negatief effect op de perinatale uitkomst. De gevonden informatie is klinisch relevant en toepasbaar.
Verdere overwegingen
Een prospectieve multicenter studie (Baschat 2007) presenteert wel specifiek de neonatale uitkomsten voor zwangerschappen met FGR (n=604, geboorte tussen 24 en 32+6). Deze studie werd niet geselecteerd omdat het geen vergelijkend onderzoek betreft (met een groep zonder FGR). Er worden prevalenties per zwangerschapsduur gepresenteerd. 37 kinderen werden geboren na een zwangerschapsduur tussen 24+0 en 25+6. Er overleefden 2 van 16 (12.5%) kinderen geboren tussen 24 en 25 wk weken en 9 van 21 (42,9%) kinderen geboren tussen 25 en 26 weken. De kans op gezonde overleving (geen major handicaps) was ongeveer 30% bij 25 weken. Er werd een significant verband aangetoond tussen zwangerschapsduur en overleving, vooral onder de 27 weken. De kans op gezonde overleving werd bepaald door zwangerschapsduur, geboortegewicht, 5’ Apgar score, nulflow of reversed flow in de arteria umbilicalis en forward of absent/reversed flow in de ductus venosus.
Een meta-analyse vergelijkt de cognitieve uitkomsten van te vroeg of extreem te vroeg geboren kinderen met á terme geborenen op vijfjarige leeftijd (Twilhaar 2018). Over de gehele groep hadden vroeggeboren kinderen een lagere intelligentie coëfficiënt vergeleken met à terme geborenen (IQ 0.86-SD lager (95% BI, -0.94 tot -0.78, p< 0.01). Ook in deze studie werd de invloed van SGA (en niet FGR) op de cognitieve functie onderzocht. SGA was niet significant geassocieerd met cognitieve beperkingen. De cruciale risicofactor voor de cognitieve uitkomst was bronchopulmonale dysplasie, een aandoening die bij kinderen met een laag geboortegewicht in combinatie met extreme vroeggeboorte juist vaker voorkomt (IQ 0.55-SD lager zonder BPD, IQ 1.55-SD lager met BPD). Ook deze studie werd niet geselecteerd omdat het geen vergelijkend onderzoek betreft tussen SGA/FGR en AGA. Specifieke literatuur over de neonatale uitkomsten in Nederland voor de FGR-groep is niet beschikbaar.
Counseling van de zwangere en haar partner
Concluderend lijken de neonatale uitkomsten van kinderen met FGR of SGA slechter dan voor kinderen met een normaal gewicht maar de bewijskracht is laag. Antenataal suspecte foetale groeirestrictie leidt mogelijk tot nog slechtere uitkomsten dan SGA maar bewijs hiervoor ontbreekt. Naast FGR hebben andere factoren, zoals corticosteroïden, geslacht, meerlingzwangerschap, etniciteit, sociaaleconomische status van de ouders en infectie en het postnataal beloop (o.a. BPD) invloed op de uitkomst. FGR is geassocieerd met een hoog risico voor een slechte perinatale uitkomst.
Er is voor gekozen om geen advies te geven ten aanzien van een absolute ondergrens voor het geschatte foetaal gewicht op het moment van counseling gezien de beperkingen van echoscopische gewichtsschatting. De betrouwbaarheid van de echodiagnostiek kan bij ernstige FGR negatief worden beïnvloed. Bij gewichtsschattingen onder de 500g is het aan neonatologisch team om in te schatten of er sprake is van een reële kans op levensvatbaarheid en in hoeverre neonatale zorg technisch mogelijk is. In geval van maternale morbiditeit zoals hypertensie is het aan het obstetrisch team om in te schatten of het verantwoord is om de zwangerschap te continueren.
Het is te overwegen om de te verwachten uitkomsten van een volgende zwangerschap mee te nemen in de counseling. Er is geen gestructureerde search gedaan naar de herhalingskans van placenta insufficiëntie (PIH, PE, FGR). Er is een herhalingskans in een volgende zwangerschap, waarbij de bevalling doorgaans bij een latere zwangerschapsduur plaatsvindt dan in de index zwangerschap waardoor de perinatale uitkomsten beter zijn (van Rijn 2006, Hernandez Diaz 2009).
Kosten (middelenbeslag)
Er is geen kosten-baten analyse voor deze uitgangsvraag beschikbaar. Actieve neonatale opvang in deze groep leidt tot meer levende kinderen, waarbij een deel van deze kinderen mogelijk meer kans heeft op een globale en sociale ontwikkelingsachterstand.
Bovenstaande gaat waarschijnlijk gepaard met hogere zorg- en maatschappelijke kosten. De (ethische) vraag of actieve neonatale opvang van FGR-kinderen deze (extra) middelen waard is kan niet beantwoord worden.
Aanvaardbaarheid voor de overige relevante stakeholders
De acceptatie van een op overleving gerichte behandeling van extreem vroeggeboren FGR-kinderen raakt ethische aspecten en zal worden beïnvloed door overtuigingen van zorgverleners, ouders en andere stakeholders. Dit was ook al het geval toen de grens voor actieve neonatale opvang in 2010 werd verlegd van 25 naar 24 weken. Het inzichtelijk maken van de perinatale uitkomsten, de zorgvraag van ouders en de veranderde inzichten van zorgverleners waren toen de aanleiding voor het aanpassen van het beleid. Ziektekostenverzekeraars zijn in deze ontwikkeling meegegaan. Indien er een vergelijkbare ontwikkeling plaatsvindt omtrent de acceptatie van actieve behandeling van de in deze uitgangsvraag beschreven hoog-risicogroep van FGR-kinderen, is te verwachten dat er bij de relevante stakeholders draagvlak ontstaat om deze keuze aan ouders voor te leggen.
Haalbaarheid en implementatie
Neonatale opvang voor kinderen met FGR tussen 24 en 26 weken is nu al standaard zorg. In de huidige situatie benutten we in Nederland vrijwel de maximale NICU-capaciteit. De opvang wordt met regelmaat belemmerd door plaatsgebrek op de regionale NICU’s. Dit leidt tot antenatale overplaatsingen tussen NICU-centra, hetgeen hogere zorgkosten met zich meebrengt, onveilige situaties oplevert en stress geeft bij ouders en zorgverleners. Het plaatsgebrek wordt veroorzaakt door een structureel tekort aan verpleegkundig personeel op NICU’s, waardoor niet alle NICUbedden benut worden. Hetzelfde geldt in mindere mate voor O&G-verpleegkundigen en de beschikbaarheid van OHC-bedden. Aan de andere kant is vroeggeboorte bij FGR-kinderen vaak iatrogeen, waardoor tijdige antenatale overplaatsing van een tweedelijnspraktijk naar een perinatologisch centrum beter planbaar is dan bij spontane vroeggeboorte.
De opvang van extreem premature pasgeborenen met FGR is technisch uitdagender dan van AGApasgeborenen van deze termijn. Ook moeten de technische benodigdheden hierop aangepast zijn en moet het personeel voldoende geschoold zijn. Daarnaast moet er acceptatie zijn bij alle betrokken zorgverleners om deze patiëntengroep actief (gericht op overleving) te behandelen. Deze acceptatie is nu niet vanzelfsprekend. Dit heeft er mee te maken dat extreem vroeggeboren FGR-kinderen langdurig zijn opgenomen op de NICU en de behandeling intensief en ingrijpend kan zijn. De acceptatie van deze behandeling kent ethische aspecten en zal worden beïnvloed door overtuigingen van zorgverleners en ouders.
Aanbeveling - rationale
De aanbevelingen uit de richtlijn extreme vroeggeboorte uit 2010 waren gebaseerd op de zwangerschapsduur. De prognose van te vroeg geboren kinderen is echter afhankelijk van multipele factoren. Een risicomodel, gebaseerd op deze multipele factoren, is daarom van meerwaarde en doet recht aan de complexe situatie waarin ouders en zorgverleners zich bevinden. De gevonden literatuur wijst erop dat foetale groeirestrictie de perinatale uitkomsten verslechtert. Maternale hypertensie daarentegen verslechtert de perinatale prognose niet.
De bewijskracht van de literatuur is zeer laag omdat de resultaten bij gebrek aan RCT’s afkomstig zijn van observationeel onderzoek. Aan de andere kant is voor deze onderzoeksvraag een RCT ook geen haalbare opzet. De gevonden resultaten wijzen in de dezelfde richting en komen ook overeen met de klinische inschatting van de prognose van deze patiëntengroep. Foetale groeirestrictie is daarmee een belangrijke factor die de prognose verslechtert.
Onderbouwing
Achtergrond
Veel voorkomende redenen voor iatrogene vroeggeboorte vóór 26 weken zijn maternale hypertensieve ziekte en foetale groeirestrictie, al dan niet gecombineerd. Volgens de ISSHP is preeclampsie gedefinieerd als de-novo-hypertensie na 20 weken zwangerschapsduur en/of acute nierschade, leverfunctiestoornissen, neurologische symptomen, hemolyse of trombocytopenie en/ of foetale groeirestrictie (Brown, 2018). Pre-eclampsie is een complex ziektebeeld dat acuut kan verslechteren. Er is geen causale behandeling behalve de patiente te laten bevallen. Indien patiente zeer ziek is kan er dus een maternale indicatie zijn om extreem prematuur te bevallen, met daarbij wel of niet actief beleid ten aanzien van de foetus/neonaat. Bij foetale groeirestrictie en daarbij verdenking op foetale nood, zal de baring worden nagestreefd in geval van actief beleid, ofwel het risico op foetale sterfte worden geaccepteerd in geval expectatief beleid.
Deze module gaat over maternale hypertensie en foetale groeirestrictie bij eenlingzwangerschappen. De richtlijn "Perinataal beleid bij extreme vroeggeboorte" uit 2010 ging expliciet over spontane vroeggeboorte en gaf geen aanbevelingen ten aanzien van het beleid bij iatrogene vroeggeboorte op maternale en/of foetale indicatie. Sinds de implementatie van deze richtlijn wordt er echter ook incidenteel actieve neonatale opvang aangeboden bij iatrogene vroeggeboorte zonder dat de prognose van kinderen uit deze subgroep bekend is.
Conclusies
Mortaliteit
|
Zeer laag GRADE |
SGA kinderen (met of zonder FGR) lijken een hoger risico op overlijden te hebben dan kinderen met een normaal gewicht maar de bewijskracht is zeer laag.
Bronnen: (Jensen, 2019; Boghossian, 2018; De Jesus, 2012; Gagliardi, 2019; McBride, 2015; McBride, 2018; Sameshima, 2009) |
Necrotiserende enterocolitis (NEC)
|
Zeer laag GRADE |
SGA kinderen (met of zonder FGR) lijken geen hoger risico te hebben op NEC dan kinderen met een normaal gewicht maar de bewijskracht is zeer laag.
Bronnen: (Bartels, 2007) |
Periventriculaire leukomalacie (PVL)
|
Zeer laag GRADE |
SGA kinderen (met of zonder FGR) lijken geen hoger risico te hebben op PVL dan kinderen met een normaal gewicht maar de bewijskracht is zeer laag.
Bronnen: (Gagliardi, 2013) |
Bronchopulmonaire dysplasie (BPD)
|
Zeer laag GRADE |
Het is onzeker of SGA kinderen (met of zonder FGR) een hoger risico hebben op BPD dan kinderen met een normaal gewicht.
Bronnen: (Jensen, 2019; Gagliardi, 2013, Boghossian, 2018) |
Sepsis
|
Zeer laag GRADE |
SGA-kinderen (met of zonder FGR) lijken een hoger risico te hebben op sepsis dan kinderen met een normaal gewicht maar de bewijskracht is zeer laag.
Bronnen: (Bartels, 2007; Boghossian, 2018) |
Intraventriculaire hemorragie (IVH)
|
Zeer laag GRADE |
Het is onzeker of SGA-kinderen (met of zonder FGR) een hoger risico hebben op IVH dan kinderen met een normaal gewicht.
Bronnen: (Jensen, 2019; Boghossian, 2018; Gagliardi, 2013) |
Premature retinopathie
|
Zeer laag GRADE |
Het is onzeker of kinderen met SGA (met of zonder FGR) een hoger risico hebben op prematuren retinopathie dan kinderen met een normaal gewicht.
Bronnen: (Jensen, 2019; Boghossian, 2018; Gagliardi, 2013) |
Cerebrale parese (CP)
|
Zeer laag GRADE |
Het is onzeker of SGA-kinderen (met of zonder FGR) een hoger risico hebben op CP dan kinderen met een normaal gewicht.
Bronnen: (De Jesus, 2012; El Ayoubi, 2016) |
Gecorrigeerde globale ontwikkelingsquotiënt
|
Zeer laag GRADE |
SGA-kinderen (met of zonder FGR) lijken een hoger risico op een globale ontwikkelingsachterstand te hebben dan kinderen met een normaal gewicht.
Bronnen: (El Ayoubi, 2016) |
Ontwikkeling van motorische vaardigheden (grof en fijn)
|
Zeer laag GRADE |
SGA-kinderen (met of zonder FGR) lijken geen hoger risico op een motorische ontwikkelingsachterstand te hebben dan kinderen met een normaal gewicht.
Bronnen: (El Ayoubi, 2016) |
Ontwikkeling van taalvaardigheden
|
Zeer laag GRADE |
SGA-kinderen (met of zonder FGR) lijken geen hoger risico op een verminderde taalvaardigheid te hebben dan kinderen met een normaal gewicht.
Bronnen: (El Ayoubi, 2016) |
Ontwikkeling van sociale vaardigheden
|
Zeer laag GRADE |
SGA-kinderen (met of zonder FGR) lijken een hoger risico op een verminderde sociale ontwikkeling hebben dan kinderen met een normaal gewicht.
Bronnen: (El Ayoubi, 2016) |
Samenvatting literatuur
Beschrijving studies
Gagliardi (2019) onderzocht de impact van maternale hypertensie en SGA (small for gestational age) bij extreem vroeggeboren kinderen (prospectieve cohort studie). De referentie was een groep kinderen van vergelijkbare zwangerschapsduur van moeders die geen maternale hypertensie hadden tijdens de zwangerschap. De studie includeerde 12.230 kinderen die werden geboren tussen een zwangerschapsduur van 23 tot 29 weken. Alleen data van kinderen met een zwangerschapsduur < 26 weken werden beschreven. De studie beschreef uitkomsten voor subgroepen van kinderen geboren tussen 24 en 25 weken. Patiëntkarakteristieken werden niet per subgroep beschreven. De impact van SGA werd onderzocht op de uitkomstmaat: mortaliteit.
Jensen (2019) onderzocht de associatie tussen SGA (small for gestational age) en het risico op mortaliteit, intra ventriculaire hemorragie, bronchopulmonaire dysplasie en premature retinopathie in vergelijking met kinderen zonder SGA bij extreem vroeggeboren kinderen. Deze review includeerde 6708 kinderen die werden geboren na een zwangerschapsduur van minder dan 32 weken. Van de 6708 kinderen werden 743 kinderen gedefinieerd als extreem vroeggeboren kinderen. SGA werd gedefinieerd als een geboortegewicht onder de 10e percentiel. Het gemiddelde geboortegewicht van de SGA-groep was 767 gram. Het gemiddelde geboortegewicht van de groep zonder SGA was 1241 gram. De studie beschreef uitkomsten voor subgroepen van 23 tot 25 weken. Patiënt karakteristieken per subgroep werden niet beschreven. De impact van SGA werd onderzocht op de volgende uitkomsten: mortaliteit, intra ventriculaire hemorragie, bronchopulmonaire dysplasie en premature retinopathie.
Boghossian (2018) onderzocht het relatieve risico op mortaliteit en morbiditeit bij kinderen met SGA in vergelijking met kinderen zonder SGA. De prospectieve cohortstudie includeerde 156.587 kinderen die werden geboren na een zwangerschapsduur van 22 tot 29 weken. Van de 156.587 kinderen werden 15.581 kinderen gedefinieerd als extreem vroeggeboren kinderen (< 26 weken). SGA werd gedefinieerd als een geboortegewicht minder dan het 10e percentiel en geslacht volgens de intrauteriene referentiecurves. Het gemiddelde geboortegewicht was < 500 gram. Van de 15.581 kinderen werden 242 kinderen geboren na een zwangerschapsduur van 22 weken, 866 kinderen na een zwangerschapsduur van 23 weken, 1760 kinderen na een zwangerschapsduur van 24 weken en 2022 kinderen na een zwangerschapsduur van 25 weken. De impact van SGA werd onderzocht op de volgende uitkomstmaten: mortaliteit, vroeg- en laattijdige sepsis, intra-ventriculaire hemorragie, premature retinopathie en bronchopulmonale dysplasie.
McBride (2018) onderzocht in een retrospectief cohortonderzoek het risico op mortaliteit bij extreem vroeggeboren kinderen waarvan de moeder hypertensie had in vergelijking met kinderen waarvan de moeder geen hypertensie had. De studie includeerde data van 6897 kinderen die werden geboren na een zwangerschapsduur van 22 tot 29 weken; 4317 moeders hadden maternale hypertensie en 2580 moeders hadden geen maternale hypertensie. De studie beschreef ook subgroepen bij een zwangerschapsduur 22 tot 23 en 24 tot 25 weken. Patiëntkarakteristieken werden niet per subgroep beschreven. De impact van SGA werd onderzocht op de volgende uitkomstmaat: mortaliteit.
El Ayoubi (2016) onderzocht in een prospectief cohortonderzoek de lange-termijn-uitkomsten van SGA bij extreem vroeggeboren kinderen op een leeftijd van twee jaar. De studie includeerde data van kinderen die werden geboren na een zwangerschapsduur van minder dan 27 weken. SGA werd gedefinieerd als een geboortegewicht minder dan het 10e percentiel voor zwangerschapsduur en geslacht volgens de intra-uteriene referentiecurves. Van de 322 extreem vroeggeboren kinderen, werden 49 kinderen met een laag geboortegewicht (<p10) op twee jaar onderzocht. De gemiddelde zwangerschapsduur van deze groep was 25.7±0.53 weken en het gemiddelde geboortegewicht was 660.6±72.3 gram. De impact van SGA werd onderzocht op de volgende voor de werkgroep relevante uitkomsten: cerebrale parese op twee jaar, globale ontwikkeling (CDQ), grof motorische ontwikkeling, fijn motorische ontwikkeling, taalontwikkeling en sociale ontwikkeling.
McBride (2015) onderzocht in een retrospectief cohortonderzoek het risico op mortaliteit bij kinderen waarvan de moeder maternale hypertensie had versus kinderen waarvan de moeder geen maternale hypertensie had. De studie includeerde 88.275 kinderen die werden geboren na een zwangerschapsduur van 22 tot 30 weken. Bij 21.896 kinderen was er sprake van maternale hypertensie en bij 66.379 kinderen was er geen sprake van maternale hypertensie. De studie rapporteerde uitkomsten voor subgroepen van kinderen geboren na 22 tot 23 weken en 24 tot 25 weken. Patiëntkarakteristieken werden niet per subgroep beschreven. De impact van SGA werd onderzocht op de volgende uitkomstmaat: mortaliteit.
Gagliardi (2013) onderzocht in een prospectief cohort de impact van FGR (IUGR, gebaseerd op antenatale echoscopische bevindigen) en maternale zwangerschapshypertensie bij extreem vroeggeboren kinderen versus kinderen met een vergelijkbare zwangerschapsduur zonder FGR en waarvan de moeder geen zwangerschapshypertensie had. De studie includeerde data van 2085 kinderen die werden geboren met een zwangerschapsduur tussen de 23 en 31 weken. De studie beschreef uitkomsten voor de subgroep 24 tot 25 weken. Patiëntkarakteristieken werden niet per subgroep beschreven. De impact van FGR en zwangerschapshypertensie werd onderzocht op de volgende uitkomstmaten: mortaliteit, intra-ventriculaire hemorragie, peri ventriculaire leukomalacie, bronchopulmonale dysplasie en premature retinopathie.
De Jesus (2013) onderzocht in een retrospectieve cohortstudie het risico op mortaliteit, morbiditeit, groei en neurologische problemen bij extreem vroeggeboren kinderen welke al dan niet SGA waren. De studie includeerde data van 2971 kinderen die werden geboren na een zwangerschapsduur van minder dan 27 weken. SGA was gedefinieerd als een geboortegewicht van minder dan een 10e percentiel en geslacht volgens de geslacht specifieke Olson groeicurven. Van de 2971 extreem vroeggeboren kinderen, werden 385 kinderen met SGA en 2586 kinderen zonder SGA onderzocht. Het gemiddelde geboortegewicht van de SGA-groep was 524±76 gram en het gemiddelde geboortegewicht van de groep zonder SGA was 761.6±149 gram. De impact van SGA werd onderzocht op de volgende voor de werkgroep relevante uitkomstmaten: mortaliteit en cerebrale parese.
Sameshima (2009) vergelijkt retrospectief de uitkomsten (mortaliteit en cerebrale parese en mentale retardatie op leeftijd van 2 jaar) van 45 kinderen met een geboortegewicht <P10 met 203 kinderen met een geboortegewicht >P10. Er werden ook antenatale data verzameld zoals HC en dopplerprofielen. 17 van de 45 kinderen met een laag geboortegewicht hadden afwijkende dopplerbevindingen. De studie rapporteerde uitkomsten voor subgroepen van kinderen geboren na 23, 24, 25 en 26 weken. Van de 45 kinderen werden 0 kinderen geboren na een zwangerschapsduur van 22 weken, 2 kinderen na een zwangerschapsduur van 23 weken, 3 kinderen na een zwangerschapsduur van 24 weken, 3 kinderen na een zwangerschapsduur van 25 weken en 6 kinderen na een zwangerschapsduur van 26 weken. De impact van SGA (waarvan een deel FGR) werd onderzocht op de uitkomstmaat mortaliteit.
Bartels (2007) onderzocht in een ‘population-based’ cohortstudie het risico op sepsis (nosocomiale infecties) en necrotiserende enterocolitis bij extreem vroeggeboren kinderen met SGA versus kinderen zonder FGR. De studie includeerde data van 2918 kinderen die werden geboren na een zwangerschapsduur van 24 tot 28 weken. Van de 2918 kinderen hadden 392 kinderen SGA en 2526 kinderen AGA. De studie rapporteerde uitkomsten voor subgroepen van kinderen na 24, 25 en 26 weken. Patiënt karakteristieken per subgroep werden niet beschreven. De impact van SGA werd onderzocht op de volgende uitkomstmaten: sepsis en necrotiserende enterocolitis.
Resultaten
Mortaliteit
Mortaliteit werd gerapporteerd in acht studies (Boghossian, 2018; De Jesus, 2013; Gagliardi, 2013; Gagliardi, 2019; Jensen, 2019; McBride, 2015; McBride, 2018; Sameshima, 2009). Vanwege de heterogeniteit in statistische analysemethoden worden de resultaten per studie afzonderlijk beschreven.
Boghossian (2018) rapporteerde de impact van SGA op de mortaliteit bij kinderen met een extreme vroeggeboorte. Het relatieve risico (RR) van SGA op de mortaliteit was op een zwangerschapsduur van 24 weken RR= 1.13 (95%BI 1.36 tot 4.23) bij kinderen die geen antenatale corticosteroïden kregen, en RR= 1.10 (95%BI 1.02 tot 1.19, 23 weken) bij kinderen die wel antenale corticosteroïden kregen. Het overlijdensrisico was hoger bij kinderen met FGR.
De Jesus (2013) rapporteerde de impact van SGA op de mortaliteit middels een gecorrigeerde Oddsratio (OR) bij kinderen met een zwangerschapsduur van 22 tot 27 weken. De OR werd gecorrigeerd voor mannelijk geslacht, zwangerschapsduur, gebruik van antenatale corticosteroïden, multipariteit, maternaal opleidingsniveau en zwangerschapshypertensie. De gecorrigeerde OR= 3.91 (95% BI= 2.91 tot 5.25). Het overlijdensrisico was hoger bij kinderen met SGA.
Gagliardi (2013) rapporteerde de impact van hypertensie en FGR op de mortaliteit middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 23 tot 25 weken. De referentiegroep was spontane vroeggeboorte. De OR werd gecorrigeerd voor 2e of 3e-lijns zorg en de zwangerschapsduur. De gecorrigeerde was OR= 1.47 (95% BI= 0.63 tot 3.41). Het verschil tussen de groepen was niet significant.
Gagliardi (2019) heeft de mortaliteit onderzocht van kinderen geboren tussen 24 en 25 weken van moeders met hypertensie (MH). Het relatieve risico (RR) op de mortaliteit bij maternale hypertensie in de gehele groep was RR= 1.31 (p<0.05) in vergelijking met vrouwen zonder MH. Als werd gecorrigeerd voor geboortegewicht, was het relatieve risico (RR) op de neonatale mortaliteit nietsignificant verschillend tussen vrouwen met en zonder MH. Het overlijdensrisico van SGA-kinderen wordt dus niet hoger door MH.
Jensen (2019) rapporteerde de impact van SGA op de mortaliteit middels een gecorrigeerd risicoverschil (RV) bij kinderen met een zwangerschapsduur van 23 tot 25 weken. Het RV werd gecorrigeerd voor geslacht van het kind, verzekeringsstatus, keizersnede, multipariteit, prenatale zorg, pre-eclampsie, zwangerschapsdiabetes, zwangerschapshypertensie, behandeling met prenatale corticosteroïden en breken van de vliezen meer of gelijk aan 18 uur voor de bevalling. De sterfte in de SGA-groep van 38% versus 20% in de non-SGA-groep. Het risicoverschil (RV) op mortaliteit tussen kinderen met en zonder SGA bij een zwangerschapsduur van 23 tot 25 weken was RD= 0.23 (95% BI= 0.14 tot 0.31). Het overlijdensrisico is hoger bij kinderen met SGA.
McBride (2015) rapporteerde de impact van maternale hypertensie op de mortaliteit middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 22 tot 23 en 24 tot 25 weken. De ongecorrigeerde OR voor zwangerschapsduur 22 tot 23 weken en 24 tot 25 weken was 0.83 (95%BI 0.70-0.96) en 1.26 (95%BI 1.17 tot 1.36). Voor de gehele groep is het overlijdensrisico bij maternale hypertensie lager in de 22 tot 23 weken groep en hoger in de 24 tot 25 weken groep.
De OR werd gecorrigeerd voor geboortegewicht. De gecorrigeerde OR was 0.55 (95% BI= 0.46 tot 0.65) voor kinderen met een zwangerschapsduur van 22 tot 23 weken. De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 24 tot 25 weken was OR= 0.73 (95% BI= 0.67 tot 0.79). Het overlijdensrisico voor kinderen van moeders met maternale hypertensie en een normaal geboortegewicht was lager in zowel de 22-23 weken groep als de 24-25 weken groep vergeleken met kinderen van moeders zonder hypertensie en een normaal geboortegewicht.
Dit impliceert dat SGA een belangrijker negatief effect heeft op de mortaliteit dan maternale hypertensie. Maternale hypertensie alleen verslechtert de uitkomst niet.
McBride (2018) rapporteerde de impact van maternale hypertensie bij de moeder op mortaliteit middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 22 tot 23 en 24 tot 25 weken. De OR werd gecorrigeerd voor geboortegewicht, geslacht van het kind, etniciteit van de moeder, geboortestatus, blootstelling aan antenatale corticosteroïden, prenatale zorg en zwangerschapsduur. De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 22+0-23+6 weken was OR= 0.23 (95% BI= 0.12 tot 0.45). De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 24+0 tot 25+6 weken was OR= 0.68 (95% BI= 0.53 tot 0.87). Het overlijdensrisico van SGA-kinderen was lager bij moeders met hypertensie dan bij moeders zonder hypertensie.
Sameshima (2010) rapporteerde de impact van SGA (incl. een groep FGR) op de mortaliteit middels een incidentie van mortaliteit bij kinderen met een zwangerschapsduur van 22, 23, 24, 25 en 26 weken vergeleken met kinderen met appropriate-for-gestational-age (AGA). Er waren geen kinderen geboren met SGA/FGR tussen 22 en 23 weken. De incidentie van mortaliteit was 7/15 (47%) voor kinderen met AGA tussen 22 en 23 weken. De incidentie van mortaliteit bij kinderen met SGA/FGR was 1/2 (50%) versus 6/25 (24%) voor kinderen met AGA na 23 weken. De incidentie van mortaliteit bij kinderen met SGA/FGR was 0/3 (0%) versus 3/27 (11%) voor kinderen met AGA na 24 weken. De incidentie van mortaliteit bij kinderen met SGA/FGR was 0/3 (0%) versus 1/25 (4%) voor kinderen met AGA na 25 weken. De incidentie van mortaliteit was 2/6 (33%) versus 0/22 (0%) voor kinderen met AGA na 26 weken.
Necrotiserende enterocolitis
Necrotiserende enterocolitis (NEC) werd gerapporteerd in twee studies (Bartels, 2007; Boghossian, 2018). Bartels (2007) rapporteerde de impact van SGA op NEC middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 24, 25 en 26 weken. De OR werd gecorrigeerd voor wijze van bevalling, centraal en perifeer veneuze katheter, endotracheale tube, het perinatale centrum, grootte van de neonatale intensive care en opnameduur. De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 24 weken was OR= 1.55 (95%BI= 0.59 tot 4.06). De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 25 weken was OR= 1.02 (95%BI= 0.48 tot 2.19). De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 26 weken was OR= 1.04 (95%BI= 0.51 tot 2.13). De OR verschilde niet significant tussen kinderen met en zonder SGA. Boghossian (2018) rapporteerde geen significant verschil in de kans op NEC in de SGA-groep < 26 weken.
Periventriculaire leukomalacie
Periventriculaire leukomalacie (PVL) werd gerapporteerd in één studie (Gagliardi, 2013). Gagliardi (2013) rapporteerde de impact van FGR op PVL middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 23 tot 25 weken. De OR werd gecorrigeerd voor geboortecentrum en was OR= 1.08 (95% BI= 0.23 tot 5.05). De OR voor PVL verschilde niet significant tussen kinderen met en zonder IUGR.
Bronchopulmonale dysplasie
Bronchopulmonale dysplasie (BPD) werd gerapporteerd in drie studies (Jensen, 2019; Gagliardi, 2013, Boghossian, 2018). Jensen (2019) rapporteerde de impact van SGA op de BPD middels een gecorrigeerd risicoverschil (RD) bij kinderen met een zwangerschapsduur van 23 tot 25 weken. Het RD werd gecorrigeerd voor geslacht van het kind, verzekeringsstatus, modus partus, meervoudige zwangerschap, prenatale zorg, pre-eclampsie, zwangerschapsdiabetes, zwangerschapshypertensie, behandeling met prenatale corticosteroïden en breuk van de vruchtwatermembranen meer of gelijk aan 18 uur voor de bevalling. De kans op BPD was 83% in de SGA-groep en 69% in de non-SGA-groep. Het risicoverschil (RV) op BPD tussen kinderen met en zonder SGA bij een zwangerschapsduur van 23 tot 25 weken was RD= 0.14 (95% BI= 0.05 tot 0.23). Het risico op BPD was hoger bij kinderen met SGA. Gagliardi (2013) rapporteerde de impact van FGR op BPD middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 23 tot 25 weken. De OR werd gecorrigeerd voor 2e of 3elijns zorg en was OR= 1.83 (95% BI= 0.60 tot 5.54). Er was geen verschil tussen de kinderen met en zonder FGR. Boghossian (2018) rapporteerde een RR van 1.84 (95% 1.30-2.60) op BPD in de SGAgroep. De kans op BPD was hoger in de SGA-groep van 23 tot 27 weken.
Sepsis
Sepsis werd gerapporteerd in twee studies (Bartels, 2007; Boghossian, 2018). Vanwege de heterogeniteit in de statistische analysemethoden worden de resultaten per studie beschreven. Bartels (2007) rapporteerde de impact van SGA op sepsis middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 24, 25 en 26 weken. De OR werd gecorrigeerd voor wijze van bevalling, centraal en perifeer veneuze katheter, endotracheale tube, het perinatale centrum, grootte van de neonatale intensive care en opnameduur. De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 24 weken was OR= 1.85 (95% BI= 1.45 tot 2.35). De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 25 weken was OR= 2.01 (95% BI= 1.46 tot 2.77). De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 26 weken was OR= 1.83 (95% BI= 1.44 tot 2.31). Het risico op sepsis was hoger bij kinderen met SGA. Boghossian (2018) rapporteerde de impact van IUGR op late-onset sepsis bij kinderen met SGA versus kinderen zonder SGA. Het relatieve risico (RR) van SGA op laattijdige sepsis was RR= 1.32 (95%BI 1.05 tot 1.66, 26 weken). Het risico op laattijdige sepsis was hoger bij kinderen met SGA.
Intraventriculaire hemorragie
Intraventriculaire hemorragie (IVH) werd gerapporteerd in drie studies (Jensen, 2019; Boghossian, 2018; Gagliardi, 2013). Vanwege de heterogeniteit in de statistische analysemethoden worden de resultaten per studie beschreven. Jensen (2019) rapporteerde de impact van SGA op de IVH middels een gecorrigeerd risicoverschil (bij kinderen met een zwangerschapsduur van 23 tot 25 weken. Het RV werd gecorrigeerd voor geslacht van het kind, verzekeringsstatus, keizersnede, multipariteit, prenatale zorg, pre-eclampsie, zwangerschapsdiabetes, zwangerschapshypertensie, behandeling met prenatale corticosteroïden en breken van de vliezen meer of gelijk aan 18 uur voor de bevalling. De kans op IVH was 15% in de SGA-groep en 15,6% in de non-SGA-groep. Het risicoverschil (RV) op IVH was niet significant. Het risico op IVH was niet verhoogd bij kinderen met SGA. Boghossian (2018) rapporteerde de impact van SGA op IVH bij kinderen met een zwangerschapsduur 24 tot 25 weken. Het relatieve risico (RR) van SGA op IVH was RR= 0.63-0.72 (95%BI 0.41 tot 0.99, 24 tot 25 weken). Het risico op IVH was lager bij kinderen met SGA. Gagliardi (2013) rapporteerde de impact van FGR op IVH middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 23 tot 25 weken.
De OR werd gecorrigeerd voor 2e of 3e-lijns zorg. De gecorrigeerde OR was 0.22 (95% BI= 0.05 tot 0.98). De kans op IVH was lager bij kinderen met FGR vergeleken met kinderen met spontane vroeggeboorte op basis van inflammatie/infectie.
Prematuren retinopathie
Prematuren retinopathie (ROP) werd gerapporteerd in drie studies (Jensen, 2019; Boghossian, 2018; Gagliardi, 2013). Vanwege de heterogeniteit in de statistische analysemethoden worden de resultaten per studie beschreven. Jensen (2019) rapporteerde de impact van SGA op de ROP middels een gecorrigeerd risicoverschil bij kinderen met een zwangerschapsduur van 23 tot 25 weken. Het RV werd gecorrigeerd voor geslacht van het kind, verzekeringsstatus, keizersneden, multipariteit, prenatale zorg, pre-eclampsie, zwangerschapsdiabetes, zwangerschapshypertensie, behandeling met prenatale corticosteroïden en breuk van de vruchtwatermembranen meer of gelijk aan 18 uur voor de bevalling. De kans op ROP was 28% in de SGA-groep en 17% in de non-SGA-groep. Het risicoverschil (RD) op ROP tussen kinderen met en zonder SGA bij een zwangerschapsduur van 23 tot 25 weken was RD= 0.13 (95% BI= 0.03 tot 0.13). Het risico op ROP is hoger bij kinderen met SGA. Boghossian (2018) rapporteerde de impact van SGA op ROP bij kinderen met SGA versus kinderen zonder SGA. Het relatieve risico (RR) van SGA op ROP was RR= 1.53 (95%BI 1.21 tot 1.95, 24 weken). Het risico op ROP is hoger bij kinderen met SGA. Gagliardi (2013) rapporteerde de impact van FGR op ROP (graad 3 tot 4) middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 23 tot 25 weken. De OR werd gecorrigeerd voor 2e of 3e lijns zorg. De gecorrigeerde OR= 0.81 (95% BI= 0.22 tot 2.97). Het risico op ROP verschilde niet tussen de groepen.
Cerebrale parese
Cerebrale parese (CP) werd gerapporteerd in twee studies (De Jesus, 2013; El Ayoubi, 2016). Vanwege de heterogeniteit in de statistische analysemethoden worden de resultaten per studie beschreven.
De Jesus (2013) rapporteerde de impact van SGA op CP middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 22 tot 27 weken. De OR werd gecorrigeerd voor mannelijk geslacht, zwangerschapsduur, gebruik van antenatale corticosteroïden, multipariteit, maternaal opleidingsniveau en zwangerschapshypertensie. De gecorrigeerde OR= 2.55 (95% BI= 1.69 tot 3.86). Het risico op CP was hoger bij kinderen met SGA.
El Ayoubi (2016) rapporteerde de impact van SGA op CP middels een gecorrigeerde OR bij kinderen met een zwangerschapsduur van 24 en 25 weken. De OR werd gecorrigeerd voor perinatale factoren, sociale factoren, geboortejaar en neonatale morbiditeit (BPD en IVH-PVL). De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 24 weken was OR= 1.6 (95% BI= 0.3 tot 7.3). De gecorrigeerde OR voor kinderen met een zwangerschapsduur van 25 weken was OR= 0.1 (95% BI= 0.01 tot 1.2). De OR’s voor CP verschilde niet tussen kinderen met en zonder SGA.
Gecorrigeerde globale ontwikkelingsquotiënt
Het gecorrigeerde globale ontwikkelingsquotiënt (GCDQ) werd gerapporteerd in één studie (El Ayoubi, 2016). El Ayoubi (2016) rapporteerde de impact van SGA op GCDQ middels een gecorrigeerde Beta-coëfficiënt (β) bij kinderen met een zwangerschapsduur van 24 tot 26 weken. De β-coëfficiënt werd gecorrigeerd voor perinatale factoren, sociale factoren, geboortejaar en neonatale morbiditeit. De gecorrigeerde β-coëfficiënt voor kinderen met een geboortegewicht <p10 was β= 4.2 (p=0.017). Er werd een lagere GCDQ gevonden in de SGA-groep.
Ontwikkeling van motorische vaardigheden (grof en fijn)
Ontwikkeling van motorische vaardigheden werd gerapporteerd in één studie (El Ayoubi, 2016). Motorische ontwikkeling werd opgedeeld in grof motorische ontwikkeling en fijne motorische ontwikkeling (op tweejarige leeftijd).
Grof motorische ontwikkeling
El Ayoubi (2016) rapporteerde de impact van SGA op de ontwikkeling van grof motorische vaardigheden middels een gecorrigeerde Beta-coëfficiënt (β) bij kinderen met een zwangerschapsduur van 24 tot 26 weken. De β-coëfficiënt werd gecorrigeerd voor perinatale factoren, sociale factoren, geboortejaar en neonatale morbiditeit. De gecorrigeerde β-coëfficiënt voor kinderen met een geboortegewicht <p10 was β= -4.3 (p= n.s.). Het risico op een verminderde ontwikkeling van grof motorische vaardigheden verschilde niet tussen kinderen met en zonder SGA.
Fijn motorische ontwikkeling
El Ayoubi (2016) rapporteerde de impact van SGA op de ontwikkeling van fijn motorische vaardigheden middels een gecorrigeerde Beta-coëfficiënt (β) bij kinderen met een zwangerschapsduur van 24 tot 26 weken. De β-coëfficiënt werd gecorrigeerd voor perinatale factoren, sociale factoren, geboortejaar en neonatale morbiditeit. De gecorrigeerde β-coëfficiënt voor kinderen met een geboortegewicht <p10 was β= -4.1 (p=n.s.). Het risico op een verminderde ontwikkeling van fijn motorische vaardigheden verschilde niet tussen kinderen met en zonder SGA.
Ontwikkeling van taalvaardigheden
Ontwikkeling van taalvaardigheden werd gerapporteerd in één studie (El Ayoubi, 2016). El Ayoubi (2016) rapporteerde de impact van SGA op de ontwikkeling van taalvaardigheden middels een gecorrigeerde Beta-coëfficiënt (β) bij kinderen met een zwangerschapsduur van 24 en 26 weken. De β-coëfficiënt werd gecorrigeerd voor perinatale factoren, sociale factoren, geboortejaar en neonatale morbiditeit. De gecorrigeerde β-coëfficiënt voor kinderen met een geboortegewicht <p10 was β= 3.8 (p=n.s.). Het risico op een verminderde ontwikkeling van de taalvaardigheid verschilde niet tussen kinderen met en zonder SGA.
Ontwikkeling van sociale vaardigheden
Ontwikkeling van sociale vaardigheden werd gerapporteerd in één studie (El Ayoubi, 2016). El Ayoubi (2016) rapporteerde de impact van SGA op de ontwikkeling van sociale vaardigheden middels een gecorrigeerde Beta-coëfficiënt (β) bij kinderen met een zwangerschapsduur van 24 en
26 weken. De β-coëfficiënt werd gecorrigeerd voor perinatale factoren, sociale factoren, geboortejaar en neonatale morbiditeit. De gecorrigeerde β-coëfficiënt voor kinderen met een geboortegewicht <p10 was β= -6.3 (p= <0.01). Het risico op een verminderde ontwikkeling van de sociale vaardigheden was groter voor kinderen met SGA.
Bewijskracht van de literatuur
- De bewijskracht voor de uitkomstmaat mortaliteit is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat necrotiserende enterocolitis is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat ventriculaire leukomalacie is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat bronchopulmonale dysplasie is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat sepsis is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat intra ventriculaire hemorragie is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat prematuren retinopathie is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat cerebrale parese is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat gecorrigeerde globale ontwikkelingsquotiënt is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat motorische vaardigheden (grof en fijn) is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat ontwikkeling van taalvaardigheden is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
- De bewijskracht voor de uitkomstmaat ontwikkeling van
- Sociale vaardigheden is afkomstig van observationeel onderzoek en start daarom op laag. De bewijskracht is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door confounding) en imprecisie (brede betrouwbaarheidsinterval). De bewijskracht is ‘zeer laag’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
‘Wat is de prognose van kinderen van moeders met pre-eclampsie indien de baring om maternale of foetale redenen geïndiceerd was vóór 26 weken zwangerschapsduur?’
|
PICO |
|
|
P: |
Kinderen geboren bij een zwangerschapsduur van 22+0 tot 26+0 weken; |
|
I: |
Foetus met FGR (percentielscore < 2.3 of geschat gewicht < 500 gram) en/of foetus van een zwangere vrouw met pre-eclampsie; |
|
C: |
Foetus met normaal estimated fetal weight (EFW) (> P10) of estimated fetal weight > 500 gram; |
|
O: |
Neonatale mortaliteit, necrotiserende enterocolitis (NEC), peri ventriculaire leukomalacie (PVL), bronchopulmonaire dysplasie (BPD), Sepsis, intraventriculaire hemorragie (IVH), premature retinopathie (ROP); Lange termijn: cerebrale parese (CP), ontwikkeling: neurologisch, motorisch, taal, sociaal, cognitie, globaal. |
Definitie foetale groeirestrictie: De term foetale groeirestrictie (FGR) verwijst naar foetussen die hun groeipotentiaal intra-uterien niet bereiken. De definitie is gebaseerd op expert consensus (Gordijn, 2016). Vroege FGR (<32 wk) is gedefinieerd als abdominal circumference (AC) <P3 en/of EFW <P3 (Headlock-3) en/of 0-flow in de arteria umbilicalis.
De diagnose wordt gesteld als één van deze parameters afwijkend is (solitary parameters). Daarnaast werden vier andere parameters gedefinieerd die gecombineerd moeten optreden om de diagnose vroege FGR te stellen: AC of EFW < P10 in combinatie met een pulsatility index >P95 in de arteria umbilicalis of uterina.
Deze definitie uit 2016 wordt echter (nog) niet breed gebruikt. Daarom werden veelal de definities uit de gevonden artikelen aangehouden.
Relevante uitkomstmaten
De werkgroep achtte neonatale mortaliteit een voor de besluitvorming cruciale uitkomstmaat; en korte en lange termijn uitkomsten voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases (Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley)) is op 29-07-2019 met relevante zoektermen gezocht naar maternale hypertensieve ziekte en foetale groeirestrictie bij extreme vroeggeboorte. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1420 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: extreem vroeggeboren kinderen met een zwangerschapsduur < 26 weken, vergelijkend onderzoek waarin kinderen met foetale groeirestrictie (FGR) worden vergeleken met kinderen zonder FGR en vergelijkend onderzoek waarin kinderen waarvan de moeder zwangerschapshypertensie had (of pre-eclampsie) worden vergeleken met kinderen waarvan de moeder geen zwangerschapshypertensie had. Er werd maar één studie gevonden waarin expliciet gekeken werd naar foetale groeirestrictie (Gagliardi 2013). De overige studies vergeleken kinderen met een voor de zwangerschapsduur laag geboortegewicht (SGA) met kinderen met een normaal geboortegewicht voor de zwangerschapsduur (AGA). Small for gestational age (SGA) kan zowel kinderen met foetale groeirestrictie op basis van placenta insufficiëntie omvatten
(gedocumenteerde foetale groeirestrictie al dan niet met dopplerafwijkingen) als kinderen geboren na zwangerschappen zonder placenta insufficiëntie. Op basis van titel en abstract werden in eerste instantie 105 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 95 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 10 studies definitief geselecteerd.
Resultaten
Tien studies zijn opgenomen in de literatuuranalyse Gagliardi, 2019; Jensen, 2019; Boghossian, 2018;
McBride, 2018; El Ayoubi, 2016; McBride, 2015; De Jesus, 2013; Gagliardi, 2013; Sameshima, 2010; Bartels 2007. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Bartels DB, Wenzlaff P, Poets CF. Obstetrical volume and early neonatal mortality in preterm infants. Eur J Epidemiol. 2007;22(11):791-8. doi: 10.1007/s10654-007-9182-6. Epub 2007 Sep 28. PMID: 17902029.
- Boghossian NS, Geraci M, Edwards EM, Horbar JD. Morbidity and Mortality in Small for Gestational Age Infants at 22 to 29 Weeks' Gestation. Pediatrics. 2018 Feb;141(2):e20172533. doi: 10.1542/peds.2017-2533. Epub 2018 Jan 18. PMID: 29348195.Brown MA, Magee LA, Kenny LC, Karumanchi SA, McCarthy FP, Saito S, Hall DR, Warren CE, Adoyi G, Ishaku S; International Society for the Study of Hypertension in Pregnancy (ISSHP). Hypertensive Disorders of Pregnancy: ISSHP Classification, Diagnosis, and Management Recommendations for International Practice. Hypertension. 2018 Jul;72(1):24-43. doi: 10.1161/HYPERTENSIONAHA.117.10803. PMID: 29899139.
- El Ayoubi M, Patkai J, Bordarier C, Desfrere L, Moriette G, Jarreau PH, Zeitlin J. Impact of fetal growth restriction on neurodevelopmental outcome at 2 years for extremely preterm infants: a single institution study. Dev Med Child Neurol. 2016 Dec;58(12):1249-1256. doi: 10.1111/dmcn.13218. Epub 2016 Aug 13. PMID: 27520849.
- Gagliardi L, Corchia C, Bellù R, Coscia A, Zangrandi A, Zanini R; SONAR study investigators. What we talk about when we talk about NICUs: infants' acuity and nurse staffing. J Matern Fetal Neonatal Med. 2016 Sep;29(18):2934-9. doi: 10.3109/14767058.2015.1109618. Epub 2015 Dec 2. PMID: 26479084.
- Gagliardi L, Basso O. Maternal hypertension and survival in singletons and twins born at 23-29 weeks: not just one answer…. Pediatr Res. 2019 Apr;85(5):697-702. doi: 10.1038/s41390-019-0337-4. Epub 2019 Feb 14. PMID: 30763949.
- Gordijn et al. Consensus definition of fetal growth restriction: a Delphi procedure. USOG 2016, vol. 28, p.333-339
- Jensen EA. Prevention of Bronchopulmonary Dysplasia: A Summary of Evidence-Based Strategies. Neoreviews. 2019 Apr;20(4):e189-e201. doi: 10.1542/neo.20-4-e189. PMID: 31261060.
- McBride CA, Bernstein IM, Badger GJ, Horbar JD, Soll RF. The effect of maternal hypertension on mortality in infants 22, 29weeks gestation. Pregnancy Hypertens. 2015 Oct;5(4):362-6. doi: 10.1016/j.preghy.2015.10.002. Epub 2015 Oct 27. PMID: 26597755.
- McBride CA, Bernstein IM, Badger GJ, Soll RF. Maternal Hypertension and Mortality in Small for Gestational Age 22- to 29-Week Infants. Reprod Sci. 2018 Feb;25(2):276-280. doi: 10.1177/1933719117711260. Epub 2017 Jun 5. PMID: 28578635.
- De Jesus LC, Pappas A, Shankaran S, Li L, Das A, Bell EF, Stoll BJ, Laptook AR, Walsh MC, Hale EC, Newman NS, Bara R, Higgins RD; Eunice Kennedy Shriver National Institute of Health and Human Development Neonatal Research Network. Outcomes of small for gestational age infants born at <27 weeks' gestation. J Pediatr. 2013 Jul;163(1):55-60.e1-3. doi: 10.1016/j.jpeds.2012.12.097. Epub 2013 Feb 14. PMID: 23415614; PMCID: PMC3947828.
- Sameshima H, Kodama Y, Kaneko M, Ikenoue T. Clinical factors that enhance morbidity and mortality in intrauterine growth restricted foetuses delivered between 23 and 30 weeks of gestation. J Matern Fetal Neonatal Med. 2010 Oct;23(10):1218-24. doi: 10.3109/14767050903580367. PMID: 20143957. Bartels 2007
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Outcome measures and effect size 4 |
Comments |
|
Gagliardi, 2019 |
Type of study:
Retrospective study
Setting and country:
89 Italian hospitals participating in the Italian Neonatal Network (INN, www.neonatalnet.org), a voluntary collaboration of neonatal units across Italy
Funding and conflicts of interest:
None declared. |
Inclusion criteria:
All infants born <30 weeks of gestation; babies born at later gestational weeks are included only if they have a birth weight <1501 g
Exclusion criteria:
infants born before 161 days (23 weeks), because MH is rare at these early weeks and live birth is inconsistently registered. To avoid systematically including small but more mature infants, we considered only births up to 29 weeks of gestation. As this analysis focuses on singletons and twins, we further excluded triplets and higher order multiples, as well as babies with recorded congenital anomalies. From the 17,510 eligible infants, we further excluded 809 (4.6%) because of missing or implausible values in key variables.
N total at baseline: 12.230 Intervention: 2754 Control: 9566
Important prognostic factors2:
Birthweight (median; IQR) I: 830 (349) C: 945 (444)
Sex: I: 47.8% M C: 53.9% M
Gestational age (weeks)
23-25 I: 14.6 C: 29.9 |
Describe intervention (treatment/procedure/test):
1. Singletons with mothers who had maternal hypertension
2. Singletons with mothers who had maternal hypertension + SGA + adjusted for covariates
3. Singletons with mothers who had maternal hypertension + continuous BW + adjusted for covariates
|
Describe control (treatment/procedure/test):
Singletons with mothers who did not have maternal hypertension. |
Mortality (Relative risk; RR)
23-25 weeks of gestational age 1. RR= 1.31 2. RR= 1.12 3. RR= 0.95 |
|
|
Boghossian, 2018 |
Type of study:
Prospective cohort study
Setting and country:
a) Department of Epidemiology and Biostatistics, Arnold School of Public Health, University of South Carolina, Columbia, South Carolina; b) Vermont Oxford Network, Burlington, Vermont; and c) Department of Pediatrics, Robert Larner College of Medicine, and d) Department of Mathematics and Statistics, University of Vermont, Burlington, Vermont
Funding and conflicts of interest:
None declared.
|
Inclusion criteria:
Infants had a GA between 22 weeks, 0 days and 29 weeks, 6 days. We restricted our study sample to inborn singleton infants without congenital malformations.
Exclusion criteria:
Not reported.
N total at baseline: 156.587 Intervention: 15.581 Control: 141.006
Important prognostic factors2:
Birthweight (gram) I: 155 C: 274
Sex: I: 52.8% M C: 52.9% M
|
Describe intervention (treatment/procedure/test):
Infants who are small for gestational age (SGA) (<10th centile for gestational age)
|
Describe control (treatment/procedure/test):
Infants who are not small for gestational age (non-SGA) (>10th centile for gestational age) |
Mortality (RR; 95% CI) (SGA infants were divided in infants who received antenatal corticosteroids vs not receiving antenatal corticosteroids)
23 weeks of gestational age: SGA + antenatal corticosteroids: RR= 1.10 (95% CI= 1.02 to 1.19).
24 weeks of gestational age: SGA + no antenatal corticosteroids: RR= 1.13 (95% CI= 1.02 to 1.25).
Early-onset sepsis
No RR reported.
Late-onset sepsis
26 weeks of gestational age: RR= 1.32 (95% CI= 1.05 to 1.66).
Intraventricular hemorrhage
24 weeks of gestational age: RR= 0.63-0.72 (95% CI= 0.41 to 0.99).
Retinopathy of prematurity
24 weeks of gestational age: RR= 1.53 (95% CI= 1.21 to 1.95).
Chronic lung disease
23 weeks of gestational age: RR= 1.83 (95% CI= 1.30 to 2.60).
|
|
|
McBride, 2018 |
Type of study:
Retrospective study.
Setting and country:
Department of Obstetrics. Gynecology and Reproductive Sciences. Larner College of Medicine. University of Vermont, Burlington, VT, USA.
Funding and conflicts of interest:
None declared.
|
Inclusion criteria: Infants must have been born either between 401 and 1500 gram or between 22 + 0 and 29 + 6 weeks gestational age.
Exclusion criteria:
Infants with chromosomal abnormalities and birth defects associated with high rates of mortality.
N total at baseline: 6897 Birthweight (gram)
Sex:
|
Describe intervention (treatment/procedure/test):
Infants with SGA and mothers with hypertension |
Describe control (treatment/procedure/test):
Infants with SGA and mothers without hypertension |
Mortality (odds ratio hypertension vs no hypertension)
22-23 weeks of gestational age:
Unadjusted OR: 0.33 (95% CI= 0.19 to 0.55). Adjusted OR for BW: 0.18 (95% CI= 0.10 to 0.33). Adjusted OR for covariates: 0.23 (95% CI= 0.12 to 0.45).
|
|
|
El Ayoubi, 2016 |
Type of study:
Retrospective cohort study.
Setting and country:
Impact of fetal growth restriction on neurodevelopmental outcome at 2 years for extremely preterm infants: a single institution study
Funding and conflicts of interest:
None declared. |
Inclusion criteria:
All singletons and twins born before 27 weeks gestational age who were admitted to the NICU and survived to discharge.
Exclusion criteria:
Impact of fetal growth restriction on neurodevelopmental outcome at 2 years for extremely preterm infants: a single institution study.
N total at baseline: 268
|
Describe intervention (treatment/procedure/test):
Infants born before 27 weeks of gestational age with SGA |
Describe control (treatment/procedure/test):
Infants born before 27 weeks of gestational age without SGA
|
Cerebral palsy (OR; 95% CI). OR adjusted for perinatal factors, social factors, year of birth, and neonatal morbidities (BPD and IVH-PVL).
23 weeks of gestational age: Adjusted OR= not shown.
24 weeks of gestational age: Adjusted OR= 1.6 (95% CI= 0.3 to 7.3).
25 weeks of gestational age: Adjusted OR= 0.1 (95% CI= 0.01 to 1.2).
26 weeks of gestational age: Reference.
Mean global CDQ
23 weeks of gestational age: Adjusted β= not shown.
24 weeks of gestational age: Adjusted β= -4.3; p=0.056
25 weeks of gestational age: Adjusted β= -0.5; p=0.715
26 weeks of gestational age: Reference.
Global motor skills
23 weeks of gestational age: Adjusted β= not shown.
24 weeks of gestational age: Adjusted β= -3.6
25 weeks of gestational age: Adjusted β= 3.2
26 weeks of gestational age: Reference.
Fine motor skills
23 weeks of gestational age: Adjusted β= not shown.
24 weeks of gestational age: Adjusted β= -7.0
25 weeks of gestational age: Adjusted β= -1.7
26 weeks of gestational age: Reference.
Language skills
23 weeks of gestational age: Adjusted β= not shown.
24 weeks of gestational age: Adjusted β= -3.3
25 weeks of gestational age: Adjusted β= -1.8
26 weeks of gestational age: Reference.
Social skills
23 weeks of gestational age: Adjusted β= not shown.
24 weeks of gestational age: Adjusted β= -1.7
25 weeks of gestational age: Adjusted β= -1.0
26 weeks of gestational age: Reference.
|
|
|
McBride, 2015 |
Type of study:
Setting and country:
Funding and conflicts of interest:
None declared. |
Inclusion criteria:
infants born in the 667 North American centers. Exclusion criteria:
associated high rates of mortality were excluded
N total at baseline: 88.275 Hypertension: 48% M |
Describe intervention (treatment/procedure/test):
Infants born between 22+0 to 29+6 weeks with hypertensive mothers |
Describe control (treatment/procedure/test):
Infants born between 22+0 to 29+6 weeks without hypertensive mothers |
Mortality (odds ratio hypertension vs no hypertension)
22-23 weeks of gestational age: Unadjusted OR= 0.83 (95% CI= 0.70 to 0.96). Adjusted for BW OR= 0.55 (95% CI= 0.46 to 0.65). Adjusted 4 all cov. OR= 0.65 (95% CI= 0.55 to 0.77).
24-25 weeks of gestational age: Unadjusted OR= 1.26 (95% CI= 1.17 to 1.36). Adjusted for BW OR= 0.73 (95% CI= 0.67 to 0.79). Adjusted 4 all cov. OR= 0.77 (95% CI= 0.71 to 0.84).
|
|
|
Gagliardi, 2013 |
Type of study:
Setting and country: Funding and conflicts of interest:
None declared. |
Inclusion criteria:
Liveborn infants. Exclusion criteria:
N total at baseline: 2085 Hypertension: 46.4% M |
Describe intervention (treatment/procedure/test):
Infants with hypertensive mother or IUGR. |
Describe control (treatment/procedure/test):
Infants without hypertensive mothers or IUGR |
Mortality (odds ratio hypertension/IUGR vs no hypertension/IUGR). OR adjusted for birth center
23-25 weeks of gestational age: Adjusted OR= 1.47 (95% CI= 0.63 to 3.41). IVH GRADE III_IV
23-25 weeks of gestational age: 0.22 (95% CI= 0.05 to 0.98).
PVL
23-25 weeks of gestational age: 1.08 (95% CI= 0.23 to 5.05).
BPD
23-25 weeks of gestational age: 1.83 (95% CI= 0.60 to 5.54).
ROP stage III-IV
23-25 weeks of gestational age: 0.81 (95% CI= 0.22 to 2.97).
|
|
|
De Jesus 2012 |
Type of study:
Setting and country:
National Institute of Child Health and Human Development Neonatal Research Network’s Generic Database Funding and conflicts of interest:
None declared. |
Inclusion criteria:
Liveborn infants. Exclusion criteria:
N total at baseline: 2971 Birthweight mean (SD) |
Describe intervention (treatment/procedure/test):
SGA infants born before <27 weeks of gestational age
|
Describe control (treatment/procedure/test):
Non-SGA infants born before <27 weeks of gestational age. |
Mortality (odds ratio SGA vs Non-SGA). OR adjusted for sex, GA, antenatal corticosteroid use, multiple birth, maternal education, and pregnancy-induced hypertension.
Adjusted OR= 3.91 (95% CI= 2.91 to 5.25).
Cerebral palsy
Adjusted OR= 2.55 (95% CI= 1.69 to 3.86).
|
|
|
Sameshima, 2009 |
Type of study:
Setting and country:
University of Miyazaki Hospital, a tertiary perinatal center Funding and conflicts of interest:
None declared. |
Inclusion criteria:
Liveborn infants. Exclusion criteria:
karyotype and metabolic abnormalities, or intrauterine viral infections such as cytomegalovirus and rubella.
N total at baseline: 248
|
Describe intervention (treatment/procedure/test):
Infants with IUGR |
Describe control (treatment/procedure/test):
Infants with appropriate gestational age (AGA) |
Mortaliy (incidence rate)
22 weeks of gestational age: IUGR: N = 0 (0%) AGA: N = 7 (47%)
23 weeks of gestational age: 24 weeks of gestational age: IUGR: N = 0 (0%) 25 weeks of gestational age: 26 weeks of gestational age:
|
|
|
Bartels, 2007 |
Type of study:
Setting and country:
Epidemiology, Public Medicine and Healthcare Systems Research, Hannover Medical School, CarlNeuberg-Str. 1, OE 5410, 30625 Hannover, Germany
Funding and conflicts of interest:
None declared. |
Inclusion criteria:
admitted to the NICU.
Exclusion criteria:
birth weight, sex or multiplicity.
N total at baseline:2918 |
Describe intervention (treatment/procedure/test):
Infants with SGA |
Describe control (treatment/procedure/test):
Infants with AGA. |
Sepsis (OR SGA vs AGA)
24 weeks of gestational age:
25 weeks of gestational age: OR= 2.01 (95% CI= 1.46 to 2.77)
26 weeks of gestational age: OR= 1.83 (95% CI= 1.44 to 2.31)
NEC
24 weeks of gestational age:
25 weeks of gestational age: OR= 1.02 (95% CI= 0.48 to 2.19)
26 weeks of gestational age: OR= 1.04 (95% CI= 0.51 to 2.13) |
|
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Stanges, 2018 |
Komt niet overeen met PICO: Geen subgroepanalyse P= <32 weken |
|
Nagiub, 2017 |
Komt niet overeen met PICO: Geen subgroepanalyse |
|
Hirvonen, 2017 |
Komt niet overeen met PICO: Geen subgroepanalyse P<32 weeks |
|
Rechia, 2016 |
Komt niet overeen met PICO |
|
Huang, 2015 |
Komt niet overeen met PICO: Geen subgroepanalyse P=29.04; P=31.54 weeks |
|
Eriksson, 2014 |
Komt niet overeen met PICO: Subgroepanalyse. 22-27/6 |
|
Edwwards, 2011 |
Komt niet overeen met PICO: Geen subgroepanalyse. P<32 weeks |
|
Murphy, 1995 |
Komt niet overeen met PICO: Geen subgroep analyse. P<32 weeks |
|
Wilmink, 2019 |
Komt niet overeen met PICO: Geen subgroep analyse. P=24+0 - 31 +6 weeks |
|
Pels, 2019 |
Komt niet overeen met PICO: Geen subgroepanalyse |
|
Caravale, 2019 |
Komt niet overeen met PICO: Geen subgroepanalyse. P=29-30 |
|
Yusuf, 2018 |
Komt niet overeen met PICO: Geen subgroepanalyse. P=23-27 weeks |
|
Thunqvist, 2018 |
Komt niet overeen met PICO: Geen subgroepanalyse. P=22-28 weeks |
|
Rocha, 2018 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Nagara, 2018 |
Komt niet overeen met PICO: Geen subgroep analyse. |
|
Morsing, 2018 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
McBride, 2018 |
Komt niet overeen met PICO: Geen subgroepanalyse. P=24-28 weeks |
|
Varga, 2017 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Sabino, 2017 |
Komt niet overeen met PICO: Geen subgroepanalyse |
|
Joseph, 2017 |
Komt niet overeen met PICO: Geen subgroepanalyse 22-26 weeks |
|
Yamakawa, 2017 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Ronkainen, 2016 |
Komt niet overeen met PICO: Geen subgroepanalyse. P=29-30 |
|
Lawin-Obrien, 2016 |
Komt niet overeen met PICO: Geen subgroepanalyse. P=23-27 weeks |
|
Grace, 2016 |
Komt niet overeen met PICO: Geen subgroepanalyse. P=22-28 weeks |
|
Gemell, 2016 |
Komt niet overeen met PICO: Geen subgroepanalyse |
|
El Ayoubi, 2016 |
Komt niet overeen met PICO: Geen subgroep analyse. |
|
Delorme, 2016 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Baer, 2016 |
Komt niet overeen met PICO: Geen subgroepanalyse. P=24-28 weeks |
|
Yau, 2015 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Regev, 2015 |
Geen fulltekst beschikbaar: opgevraagd |
|
Kovo, 2015 |
Komt niet overeen met PICO: Included. Subgroepen 23-26 weeks <28 weeks |
|
Hei, 2015 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Griffin, 2015 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Eyrigit, 2015 |
Komt niet overeen met PICO: De studie kijkt wel naar redenen voor geboorte < 24 weken, maar ik weet niet of dit interessant is voor de werkgroep. |
|
Van Eerden, 2014 |
Komt niet overeen met PICO: Geen subgroepanalyse |
|
Natarajan, 2014 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Morsign, 2014 |
Komt niet overeen met PICO: Geen subgroepanalyses. Studie noemt wel alle kinderen afzonderlijk, maar volgens mij is het niet bruikbaar voor de module. |
|
Keir, 2014 |
Komt niet overeen met PICO: Geen subgroepanalyse. |
|
Peacock, 2013 |
Komt niet overeen met PICO: Wel subgroep analyse, maar 29-32 en 33-36 weken |
|
Liu, 2013 |
Komt niet overeen met PICO: Geen subgroepanalyse |
|
Lees, 2013 |
Komt niet overeen met PICO: Geen fulltekst beschikbaar: opgevraagd |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 07-02-2024
Laatst geautoriseerd : 07-02-2024
Geplande herbeoordeling : 01-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in (2017) een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom extreme vroeggeboorte.
Werkgroep
- Dr. M. (Monique) Rijken (voorzitter vanaf januari 2020), kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. A.F.J. (Arno) van Heijst (voorzitter tot december 2019), kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. M. (Marjon) de Boer, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dhr. S.P. (Bas) Bol, Verpleegkundig Specialist, Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Dr. J.J. (Hans) Duvekot, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. A. (Annemiek) Evers, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. M. (Marije) Hogeveen, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. J.J. (Joepe) Kaandorp, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. M.J.K. (Martin) de Kleine, Kinderarts n.p., Care4Neo
- Drs. K.E. (Karianne) Kraft, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. G.T.R. (Wendy) Manten, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Mw. F. (Farideh) Mostafai Alai, Physician Assistant / Klinisch Verloskundige, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV)
- Drs. M.E. (Mayke) van der Putten, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. M.M. (Martina) Porath, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
Klankbordgroep
- Dr. P. (Peter) Andriessen, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. A. (Annemieke) Bolte, gynaecoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. A.B.C. (Audrey) Coumans, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Drs. M. (Maureen) Franssen, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. F. (Floris) Groenendaal, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Mw. Marie-Josée de Haan – Gremmé MSc, klinisch Verloskundige, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV)
- Mw. Bianca Hekkink, ICN verpleegkundige, Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Dr. R. (Rene) Kornelisse, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. E.M. (Margo) Lutke Holzik (Graatsma), gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Drs. S. (Susanne) Mulder-de Tollenaer, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Mw. Janine Pingen MSc, Stichting Kind en Ziekenhuis (SKZ)
- Drs. J.J. (Jeanine) Sol, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. W.G. (Minke) van Tuijl, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
Externe experts (betrokken in diverse fasen van de ontwikkeling van de richtlijn)
- Dr. R. (Rosa) Geurtzen, kinderarts, fellow neonatologie Radboud UMC – later toegevoegd aan de werkgroep
- Mw. I. (Ilona) Jochems, Care4Neo
- Mw. B. (Brenda) van Osch, journalist, schrijver ('Het onvoltooide kind')
- prof. dr. A.A.E. (Eduard) Verhagen, kinderarts, afdelingshoofd, UMCG
- Dr. A.E. (Anna) Westra, kinderarts, medisch ethicus namens de werkgroep ethiek in richtlijnen, Flevoziekenhuis
Met ondersteuning van
- Dr. J. (Janke) de Groot, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2019)
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2019)
- Mw. A.L.J. (Andrea) Kortlever - van der Spek MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. (Marjolein) de Weerd, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot augustus 2019)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mostafai Alai |
PA Klinisch verloskundige Werkgever: Admiraal De Ruyter ziekenhuis Goes" |
"lid van patiënten veiligheidscommissie. Bespreking en beoordeling van de calamiteiten in het ziekenhuis. Werkgever: Admiraal De Ruyter ziekenhuis Goes - lid van de commissie Veilig incident melden (VIM). Bespreking en beoordeling van de incidenten op de kraam/zwangere afdeling. werkgever: Admiraal De Ruyter Goes. - Lid van de commissie perinatale audit. Maken van de chronologische verslagen van de intrauteriene vrucht dood en andere calamiteiten, bespreking en beoordeling van de casussen. Werkgever: Admiraal De Ruyter ziekenhuis Goes." |
Geen |
Geen actie |
|
Bol |
Verpleegkundig Specialist. Neonatologie Erasmus MC -sophia, Rotterdam |
Bestuurslid VenVN VS - onbetaald |
Geen |
Geen actie |
|
Kraft |
Kinderartsneonatoloog UMCG |
Geen |
Geen |
Geen actie |
|
Manten |
Gynaecoloogperinatoloog, Afdeling gyneaecologie en obstetrie, Isala klinieken, Zwolle |
Geen |
Geen |
Geen actie |
|
Rijken |
Kinderarts neonatoloog Leids Universitair Medisch Centrum |
Voorzitter werkgroep Landelijke Neonatale Follow-up (multidisciplinaire werkgroep), bestaande uit hoofdzakelijk kinderartsen, kinderfysiotherapeuten en kinderpsychologen, die goede en gestructureerde nazorg van NICU patienten in Nederland als doel heeft)
-Vice-voorzitter lokale en regionale Perinatale Audit-team Leiden - Lid Verloskundig SamenwerkingsVerband (VSV) Leiden (buitengewoon bestuurslid) - Lid Nederlands- Vlaamse Werkgroep Neonatale Neurologie - Lid Projectgroep JGZrichtlijn Motorische Ontwikkeling (meelezen en beoordelen geleverde stukken) - Lid adviescommissie ontwikkelingsonderzoek Nederlands Centrum Jeugdgezondheidszorg (op persoonlijke titel; 3x per jaar vergadering - beoordeling vergaderstukken en meebeslissen hierover) |
Betrokken bij promotietraject EPI-DAF studie (Extremely Preterm Infants - Dutch Analysis on Follow-up). Recent gestarte studie vanuit MMC te Veldhoven, in samenwerking met de NICU's, LNF, N3 en Perined |
Geen actie |
|
Hogeveen |
Kinderartsneonatoloog |
Voorzitter WLAN/ N3 Aanbevelingen - Bestuurslid N3 -principal lecturer -associate professor
|
PreCo studie: framework keuzehulp; PreCo study = Prenatal counseling in extreme prematurity |
Geen actie |
|
Kleine de |
Kinderarts, gepensioneerd |
Bestuurslid Vereniging van Ouders van Couveusekinderen, onbetaald als bestuurslid Care4Neo een One time vendor agreement met Philips Design, betaald aan de Care4Neo. Medisch adviseur VEDUMA" |
De Care4Neo participeert in onderzoek. De vertegenwoordigers van Care4Neo participeren niet op persoonlijk basis of voor eigen rekening in onderzoek. |
Geen actie |
|
Duvekot |
GynaecoloogPerinatoloog |
Directeur Medisch Advies en Expertise Bureau Duvekot (betaald) kwaliteitsdocumenten (betaald) Voorzitter Adviescommissie Richtlijnen FMS (betaald) |
Geen |
Geen actie |
|
Boer |
GynaecoloogPerinatoloog, Amsterdam UMC, locatie VUMC |
Geen |
ZON-MW gesubsidieerd onderzoek naar vroeggeboorte. |
Geen actie |
|
Heijst van |
Kinderarts- Neonatoloog, Radboudumc, Nijmegen |
Geen |
Geen |
Geen actie |
|
Putten van der |
Kinderartsneonatoloog te MUMC |
NLS-instructeur (SSHK), onbetaald |
Geen |
Geen actie |
|
Porath |
Gynaecoloogperinatoloog Máxima Medisch Centrum te Eindhoven/Veldhoven |
"Lid NVOG werkgroep Otterlo, onbetaald Lid NVOG werkgroep Foetale Echoscopie, onbetaald Lid NVOG werkgroep Foeto-Maternale ziekte, onbetaald" |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door de afgevaardigde van de patiëntenvereniging in de werkgroep en door participatie van ouders van patiënten in de Invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deelnemers van de Invitational conference en de betrokken patiëntenvereniging. De aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntvertegenwoordigers van Care4Neo en Kind en Ziekenhuis hebben deelgenomen aan de knelpuntenanalyse, er heeft een vertegenwoordiger in de werkgroep gezeten die betrokken is geweest bij de module over samen beslissen. Beide organisaties waren onderdeel van de klankbord groep en hebben in die rol de richtlijn van commentaar voorzien en Care4Neo had een actieve rol in het ouderperspectief tijdens een extra ingelaste IC over ethische overwegingen bij deze richtlijn.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg rondom extreme vroeggeboorte. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en stakeholders via een Invitational conference. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review (SR) per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de
GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-todecision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; AlonsoCoello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADEmethodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur).
Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast. De wijzigingen werden voorgelegd aan de klankbordgroep. Vanwege het feit dat er buitengewoon veel wijzigingen zijn doorgevoerd werd een tweede commentaarronde uitgezet. De definitieve tekst werd na de tweede commentaarronde vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënten)organisaties voorgelegd voor autorisatie. Ook in deze vorm kon de richtlijn niet geaccordeerd worden door NVK en NVOG gezien de te verwachten capaciteits- en juridische problemen bij een ondergrens voor actieve opvang van 23 weken, nader besproken in het hoofdstuk ‘Organisatie van Zorg’ en de juridische paragraaf. Derhalve vond op 29 november 2022 een consultatie plaats van de richtlijnwerkgroep met de besturen van NVK en NVOG. In gezamenlijk overleg werd uiteindelijk besloten in deze richtlijn de ondergrens voor actieve opvang in Nederlandse ziekenhuizen te handhaven op 24 weken en dit ook als zodanig in deze richtlijn op te nemen.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
