Corticosteroïden bij extreme vroeggeboorte
Uitgangsvraag
Vanaf welke zwangerschapsduur is het geven van corticosteroïden aan zwangeren met een dreigende extreme vroeggeboorte geïndiceerd?
Aanbeveling
Geef een zwangere corticosteroïden bij dreigende extreme vroeggeboorte, indien na overleg tussen perinatoloog, neonatoloog en ouders gekozen is voor actieve opvang, waarbij de timing van de eerste gift bepaald wordt door het perinatologisch centrum.
Overwegingen
Er werden geen RCT’s gevonden die voldeden aan de selectiecriteria. De observationele studies tonen een significant gunstig effect van antenatale corticosteroïden op de mortaliteit bij zwangerschapsduur < 25 weken. Kinderen blootgesteld aan corticosteroïden hadden een 24% lagere kans op overlijden dan kinderen die niet antenataal waren blootgesteld aan corticosteroïden. De werkgroep beschouwt dit als een klinisch relevant effect.
Er werd in de observationele studies een significant effect gevonden van antenatale steroïden op de incidentie van IVH/PVL voor de subgroep geboren tussen 24+0 en 24+6 weken zwangerschapsduur. Kinderen blootgesteld aan corticosteroïden bij een zwangerschapsduur van 24 weken hadden een 28% lagere kans op IVH en/of PVL. Er waren geen RCT’s beschikbaar. Ondanks dat er een zeer lage bewijskracht is, beschouwt de werkgroep dit als een klinisch significant effect.
Er werd geen effect gevonden van antenatale corticosteroïden op NEC en BPD bij een zwangerschapsduur < 25 weken. Er waren geen RCT’s beschikbaar. De systematische review van Deshmukh 2017 bestond uit observationele studies. De bewijskracht van alle hierboven beschreven uitkomstmaten wordt als laag (mortaliteit) tot zeer laag beschouwd. De redenen hiervoor zijn de inclusie van observationele studies, de geringe patiënten aantallen, en de beperkingen in onderzoeksopzet.
Het is wenselijk de besluitvorming omtrent het toedienen van corticosteroïden te laten plaatsvinden in (of in uitzonderingsgevallen in overleg met) een perinatologisch centrum. De werkgroep vindt het belangrijk hier op te merken dat uit de studie van Travers (Travers, 2018) dat ook onvolledig ingewerkte corticosteroïden (< 24uur) een significant gunstig effect hebben op mortaliteit, vergeleken met geen corticosteroïden (mortaliteit 26.0% versus 41.5%; adjusted relative risk, 0.77; 95% B.I. 0.70-0.85; P < .0001). Uiteraard is de mortaliteit het hoogst bij het ontbreken van toegediende corticosteroïden, er is een afname van de mortaliteit bij onvolledig ingewerkte corticosteroïden en het gunstigste effect wordt gezien bij een volledig ingewekte kuur corticosteroïden.
Waarden en voorkeuren van ouders
Het belangrijkste doel van het antenataal toedienen van corticosteroïden bij dreigende vroeggeboorte is het bevorderen van de foetale longrijping maar vooral het verbeteren van de neonatale uitkomsten. Doordat de kans op overlijden mogelijk afneemt, zullen potentieel meer jongere kinderen overleven, die een grotere kans hebben op het ontwikkelen van (grote) handicaps. Echter, antenatale corticosteroïden verkleinen mogelijk ook de kans op (ernstige) neonatale morbiditeit. De waarde die - in dit geval - ouders van patiënten toekennen aan de kans op handicaps en de ernst van deze handicaps is individueel bepaald.
Kosten (middelenbeslag)
De prijs van deze corticosteroïden is laag, de prijs voor opname van de zwangere en voor overplaatsing van tweede naar derde lijn is dat niet.
Haalbaarheid en implementatie
De huidige interventie wordt al toegepast in de praktijk bij zwangeren vanaf een zwangerschapsduur van 24 weken. Voor het puur uitvoeren van de interventie (i.m. injectie) zien wij geen belemmeringen.
Aanbevelingen – rationale
Er is geen evidence uit RCT’s dat het geven van antenatale corticosteroïden zinvol is beneden een zwangerschapsduur van 25 weken, maar ook geen evidence dat het niet zinvol is. Studies naar antenatale corticosteroïden toegediend aan een zwangere met een dreigende vroeggeboorte bij een zwangerschapsduur tussen 22+0 en 24+0 weken tonen wel een positief effect op de mortaliteit en in de subgroep van 24+0 tot en met 24+6 weken op ernstige IVH/PVL. Er is echter sprake van een (zeer) lage bewijskracht. Er is geen gunstig maar ook geen nadelig effect op BPD en NEC.
Onderbouwing
Achtergrond
In Nederland worden sinds 2010 corticosteroïden overwogen bij dreigende vroeggeboorte vanaf een zwangerschapsduur van 23+5 weken, ter bevordering van de foetale longrijping en verbetering van de overleving en morbiditeit van extreem vroeggeboren kinderen. Internationaal wordt ook bij kortere zwangerschapsduur aanbevolen corticosteroïden toe te dienen aan zwangeren met een dreigende vroeggeboorte. Op het moment dat de richtlijn in 2010 werd opgesteld, was in de tot dan toe beschikbare literatuur geen bewijs gevonden dat het geven van corticosteroïden beneden de 26 weken gunstig is, noch was er voldoende argumentatie om een gunstig effect voor deze termijn te verwerpen. Er werd vervolgens geadviseerd om corticosteroïden toe te dienen aan zwangeren met een dreigende vroeggeboorte vanaf 23+5 weken, wanneer voor een actief beleid werd gekozen, vanwege duidelijk positieve effecten van corticosteroïden beneden de 26 weken in grote cohortstudies. In de 10 jaar die zijn verstreken sinds het opstellen van de richtlijn, zijn naar verwachting nieuwe studies verricht naar het geven van corticosteroïden aan zwangeren met een dreigende vroeggeboorte rond de grens van levensvatbaarheid. Daarom werd in deze huidige richtlijn een systematische literatuuranalyse verricht naar de (on)gunstige effecten van het toedienen van corticosteroïden, vergeleken met geen corticosteroïden, bij een dreigende vroeggeboorte, vanaf 22 tot en met 24 weken.
Conclusies
Mortaliteit
|
Laag GRADE |
Antenatale corticosteroïden toegediend aan een zwangere met een dreigende vroeggeboorte bij een zwangerschapsduur van 22+0 tot en met 24+6 weken leiden mogelijk tot een lager risico op neonatale mortaliteit, ten opzichte van geen antenatale corticosteroïden bij deze zwangerschapsduur.
Bronnen: (Bader, 2010; Barjwa, 2011; Carlo, 2011; Guinsburg, 2006; Hayes, 2008; Manktelow, 2009; Mori, 2011; Travers, 2017; Ehret 2018; Travers;2018) |
Ernstige intraventriculaire bloeding of periventriculaire leukomalacie
|
Zeer laag GRADE |
Antenatale corticosteroïden, toegediend aan een zwangere met een dreigende vroeggeboorte bij een zwangerschapsduur van 22+0 tot en met 24+6 weken, leiden mogelijk tot een lager risico op ernstige intraventriculaire bloeding of periventriculaire leukomalacie. Dit geldt alleen voor een zwangerschapsduur van 24+0 tot en met 24+6 weken. Echter, de evidentie is onzeker.
Bronnen: (Barjwa, 2011; Carlo, 2011; Guinsburg, 2006; Hayes, 2008; Mori, 2011; Travers, 2017) |
Necrotiserende enterocolitis, bronchopulmonale dysplasie
|
Zeer laag GRADE |
Op basis van de beschikbare evidentie is het onduidelijk wat het effect is van antenatale corticosteroïden toegediend aan een zwangere met een dreigende vroeggeboorte bij een zwangerschapsduur van 22+0 tot en met 24+6weken op:
Bronnen: (Barjwa, 2011; Carlo, 2011; Guinsburg, 2006; Hayes, 2008; Mori, 2011; Travers, 2017) |
Samenvatting literatuur
Beschrijving studies
Systematische review
De systematische review van Deshmukh (2017) werd als uitgangspunt genomen. De studie verrichtte onderzoek naar de effectiviteit van antenatale corticosteroïden bij kinderen geboren tussen 22 en 25 weken (22 tot en met 24+6) zwangerschapsduur. RCT’s, quasi-RCT’ s en non-RCT’s met betrekking tot de effectiviteit van antenatale corticosteroïden (alle typen, aantal doses en duur) ten opzichte van een controle/placebo bij kinderen geboren tussen 22 en 24+6 weken zwangerschapsduur werden geïncludeerd. Kinderen met grote chromosomale en congenitale afwijkingen werden geëxcludeerd. Reviews en commentaren werden geëxcludeerd, maar beoordeeld om potentiële studies te identificeren. Er werd gezocht in Medline (vanaf 1946), Embase (vanaf 1974), CINAHL en in CENTRAL tot November 2016. Er werden 20 studies geselecteerd die voldeden aan de inclusiecriteria. Vanwege beperkingen (data niet beschikbaar) konden 12 studies niet worden geïncludeerd in de meta-analyse. Uiteindelijk werden acht observationele studies geïncludeerd in de meta-analyse (Carlo, 2011 (cohort); Hayes, 2008 (cohort); Manktelow, 2009 (cohort); Mori, 2011 (cohort); Guinsburg, 2016 (cohort); Bajwa, 2011 (cohort); Guthrie, 2003 (database studie); Bader, 2010 (database studie).
De volgende uitkomstmaten werden beschreven: mortaliteit, overlijden voor ontslag van de neonatale unit tijdens de eerste opname na de geboorte, ernstige intraventriculaire bloeding (IVH) ≥ graad III of periventriculaire leukomalacia (PVL), necrotiserende enterocolitis (NEC) ≥ graad II, bronchopulmonale dysplasie (BPD): zuurstofbehoefte bij 36 weken.
Er werden 10109 kinderen (corticosteroïden: 6369; geen corticosteroïden: 3740) geïncludeerd voor de uitkomstmaat mortaliteit, 5084 kinderen (corticosteroïden: 3257; geen corticosteroïden: 1827) voor IVH or PVL, 4649 kinderen voor bronchopulmonale dysplasie (corticosteroïden: 3157; geen corticosteroïden: 1452) en 5403 kinderen voor NEC (corticosteroïden: 3435; geen corticosteroïden: 1986). De follow-up duur werd niet beschreven.
Observationele studies
Het prospectieve cohortonderzoek van Travers (2017) bestudeerde de effectiviteit van antenatale corticosteroïden (een of meer doses betamethason of dexamethason gegeven aan de zwangere) ten opzichte van geen antenatale corticosteroïden bij kinderen geboren tussen bij 23 en 35 weken (23+0 tot en met 34+6)zwangerschapsduur. Kinderen die niet werden geboren in één van de betrokken ziekenhuizen, kinderen met ernstige aangeboren afwijkingen en kinderen die werden overgeplaatst naar andere ziekenhuizen werden geëxcludeerd. Er werden 117.941 kinderen geïncludeerd (antenatale corticosteroïden: 81.832; geen antenatale corticosteroïden: 36.109). Data werden geëxtraheerd uit de patiëntendossiers. Hiervoor werden gestandaardiseerde definities gebruikt. De gegevens werden verzameld tot aan overlijden of ontslag.
De volgende uitkomstmaten werden beschreven: IVH (graad 3 en 4, gradiëring volgens Papile), NEC (stadium ≥ 2, stadiëring volgens Bell), ernstige retinopathie van de prematuriteit (ROP) (stadium ≥ 3 of behandeld door middel van laser of anti vasculaire endotheliale groeifactor), gebruik makend van de Internationale Classificatie van Retinopathie van de Prematuriteit, BPD (het nodig hebben van extra zuurstof of elke vorm van ademhalingsondersteuning op de gecorrigeerde leeftijd van 36 weken).
Observationele studie
Het multicenter prospectieve cohortonderzoek van Ehret (2018) bestudeerde de effectiviteit van antenatale corticosteroïden (een of meer doseringen betametason, dexamethason, of hydrocortison gegeven aan zwangeren met een dreigende vroeggeboorte), ten opzichte van geen antenatale corticosteroïden, op de overleving van kinderen geboren tussen de 22 en 26 weken (22 tot en met 25+6) zwangerschapsduur die postnatale levensondersteuning hebben ontvangen. Kinderen die niet werden geboren in één van de betrokken ziekenhuizen, met bekende syndromen, met ernstige aangeboren afwijkingen, met ontbrekende data of met een geboortegewicht > 4SD boven het gemiddelde voor zwangerschapsduur en geslacht werden geëxcludeerd. Er werden 29.932 kinderen geïncludeerd (antenatale corticosteroïden: 26.090; geen antenatale corticosteroïden: 3.842). Data werden geëxtraheerd uit patiëntendossiers, uit interviews met moeder of uit de geboorte certificaten. Hiervoor werden gestandaardiseerde definities gebruikt en de kwaliteit en compleetheid van de data werden automatisch gecontroleerd op het moment van inclusie. De gegevens werden verzameld tot aan overlijden, ontslag of overplaatsing naar een ander ziekenhuis. Indien een kind werd overgeplaatst naar een ander ziekenhuis werd de overlevingsstatus opgevraagd in het desbetreffende ziekenhuis.
De volgende uitkomstmaten werden beschreven:
- Overleving tot ontslag uit het ziekenhuis.
- Overleving zonder de hieronder genoemde comorbiditeiten.
- Overleving zonder BPD.
- Overleving zonder ernstige IVH.
- Overleving zonder PVL.
- Overleving zonder NEC.
- Overleving zonder ernstige ROP.
- Overleving zonder een infectie (bewezen op basis van een kweek).
Overleving tot ontslag uit het ziekenhuis werd voor deze richtlijn omgezet naar overlijden tot ontslag (mortaliteit = 1 - overleving). De overige uitkomstmaten beschreven in dit artikel werden niet meegenomen in deze richtlijn, omdat overleving zonder morbiditeit een andere morbiditeit niet per definitie uitsluit.
Observationele studie
Het prospectieve cohortonderzoek van Travers (2018) bestudeerde de effectiviteit van antenatale corticosteroïden (volledige of een gedeelte van de dosering (zie evidence tabel) van betamethason of dexamethason gegeven aan zwangeren met een dreigende vroeggeboorte), ten opzichte van geen antenatale corticosteroïden, bij kinderen geboren tussen 22 en 29 weken (22 en 28+6) met een geboortegewicht van ten minste 401 gram. Kinderen die waren overleden binnen 12 uur na de geboorte, zonder reanimatie in de verloskamer te hebben gehad, werden geëxcludeerd. In totaal werden 11022 kinderen geïncludeerd (antenatale corticosteroïden: 9715; geen antenatale corticosteroïden: 1307). Data werden geëxtraheerd uit patiëntendossiers door ervaren onderzoekers op basis van gestandaardiseerde definities (zie Travers, 2018).
De volgende uitkomstmaten werden beschreven:
- Mortaliteit: overlijden voor ontslag en overlijden voor de postconceptionele leeftijd van 36 weken.
- BPD (het nodig hebben van ademhalingsondersteuning op postconceptionele leeftijd van 36 weken op basis van een zuurstof reductie test).
- Extra zuurstofbehoefte bij ontslag.
- De gecombineerde uitkomstmaat van BPD en overlijden voor 36 weken postconceptionele leeftijd
Alleen de uitkomstmaten mortaliteit en BPD werden meegenomen in deze richtlijnmodule.
Resultaten
Mortaliteit
Tien studies rapporteerden de cruciale uitkomstmaat mortaliteit (< 25 weken: corticosteroïden 26774; geen corticosteroïden 7841). Neonatale mortaliteit (zwangerschapsduur < 25 weken) was significant lager bij gebruik van antenatale corticosteroïden ten opzichte van de controle/placebo groep (RR: 0,76; 95% BI: 0,71 tot 0,80).
Kinderen blootgesteld aan corticosteroïden hadden een 24% lagere kans op overlijden. Neonatale mortaliteit was ook significant lager bij het gebruik van antenatale corticosteroïden ten opzichte van geen corticosteroïden in alle subgroepen:
- 22 weken: RR: 0,80 (95% BI: 0,73 tot 0,88);
- 23 weken: RR: 0,80 (95% BI: 0,74 tot 0,87);
- 24 weken: RR: 0,69 (95%BI: 0,62 tot 0,77).
Figuur 1 Uitkomstmaat mortaliteit vergelijking corticosteroïden versus geen corticosteroïden uitgesplitst naar week zwangerschapsduur (ruwe data)
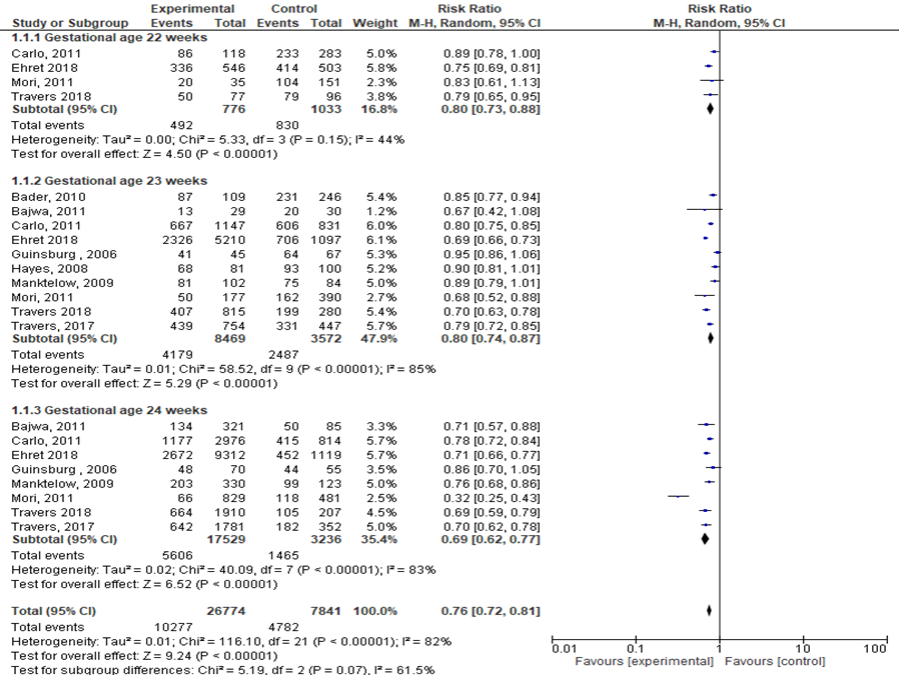
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Ernstige intraventriculaire bloeding en/of periventriculaire leukomalacie
Zes studies rapporteerden de uitkomstmaat ernstige IVH en/of PVL (< 25 weken: corticosteroïden
5729; geen corticosteroïden 2626). De incidentie van ernstige IVH en/of PVL (zwangerschapsduur < 25 weken) was significant lager bij gebruik van antenatale corticosteroïden ten opzichte van de controle/placebo groep (RR: 0,80; 95% BI: 0,70 tot 0,91). Binnen de verschillende subgroepen was de incidentie van ernstige IVH en/of PVL alleen significant lager bij het gebruik van antenatale corticosteroïden bij een zwangerschapsduur van 24 weken (RR: 0,72; 95%BI: 0,65 tot 0,80). Kinderen blootgesteld aan corticosteroïden bij een zwangerschapsduur van 24 weken hadden een 28% lagere kans op IVH en/of PVL.
Er was geen significant verschil in ernstige IVH en/of PVL bij het gebruik van antenatale corticosteroïden ten opzichte van geen antenatale corticosteroïden bij een zwangerschapsduur van 22 (RR: 1,01; 95% BI: 0,68 tot 1,50) en 23 weken (RR: 0,90 (95% BI: 0,69 tot 1,17).
Figuur 2 Uitkomstmaat severe IVH of PVL vergelijking corticosteroïden versus geen corticosteroïden uitgesplitst naar week zwangerschapsduur (ruwe data)
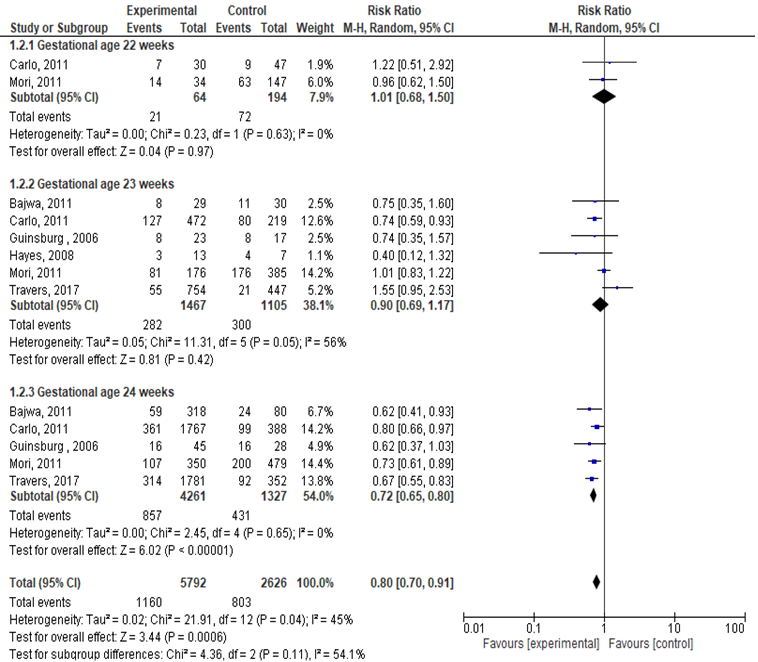
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Necrotiserende enterocolitis
Zes studies rapporteerden de uitkomstmaat NEC (< 25 weken: corticosteroïden 5970; geen corticosteroïden 2767). Er werd geen significant verschil gevonden in incidentie van NEC (zwangerschapsduur < 25 weken) tussen beide groepen (RR: 1,01; 95% BI: 0,85 tot 1,19). Tevens werd er geen significant verschil waargenomen binnen de verschillende subgroepen:
- 22 weken: RR: 0,61 (95% BI: 0,03 tot 11,10);
- 23 weken: RR: 1,12 (95% BI: 0,80 tot 1,57);
- 24 weken: RR: 0,96 (95%BI: 0,76 tot 1,20).
Figuur 3 Uitkomstmaat NEC vergelijking corticosteroïden versus geen corticosteroïden uitgesplitst naar week zwangerschapsduur (ruwe data)
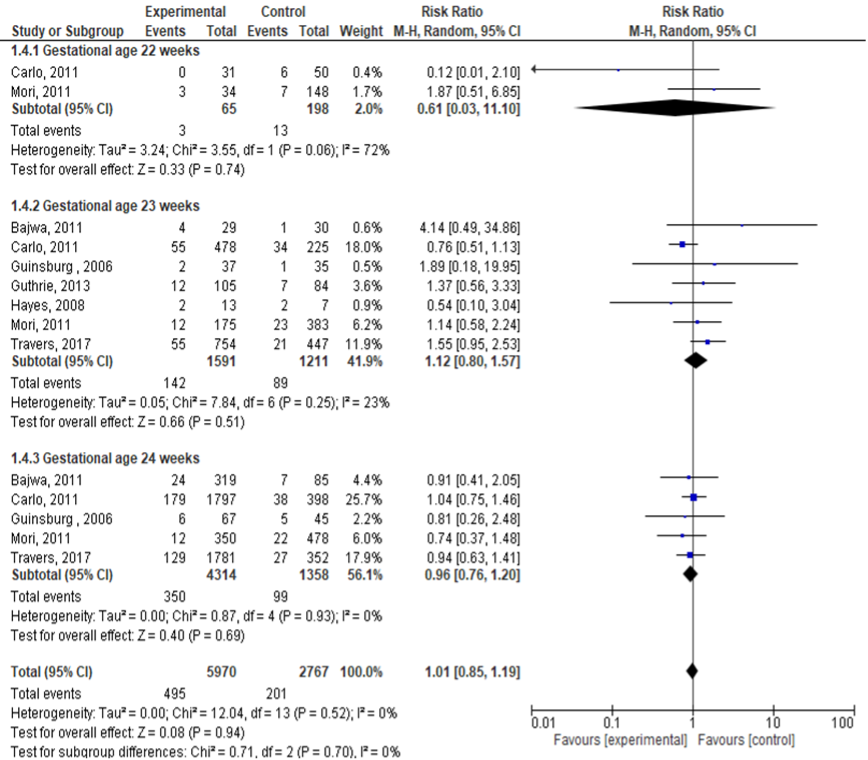
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bronchopulmonale dysplasie
Zeven studies rapporteerden de uitkomstmaat bronchopulmonale dysplasie (< 25 weken: corticosteroïden 7384; geen corticosteroïden 2449). Er werd geen significant verschil gevonden in incidentie van bronchopulmonale dysplasie (zwangerschapsduur < 25 weken) tussen beide groepen (RR: 1,04; 95% BI: 0,96 tot 1,13). Tevens werd er geen significant verschil gevonden binnen de subgroepen:
• 22 weken: RR: 0,96 (95% BI: 0,84 tot 1,10);
• 23 weken: RR: 0,98 (95% BI: 0,92 tot 1,05);
• 24 weken: RR: 1,15 (95%BI: 0,97 tot 1,35).
Figuur 4 Uitkomstmaat Bronchopulmonale dysplasie vergelijking corticosteroïden versus geen corticosteroïden uitgesplitst naar week zwangerschapsduur (ruwe data)
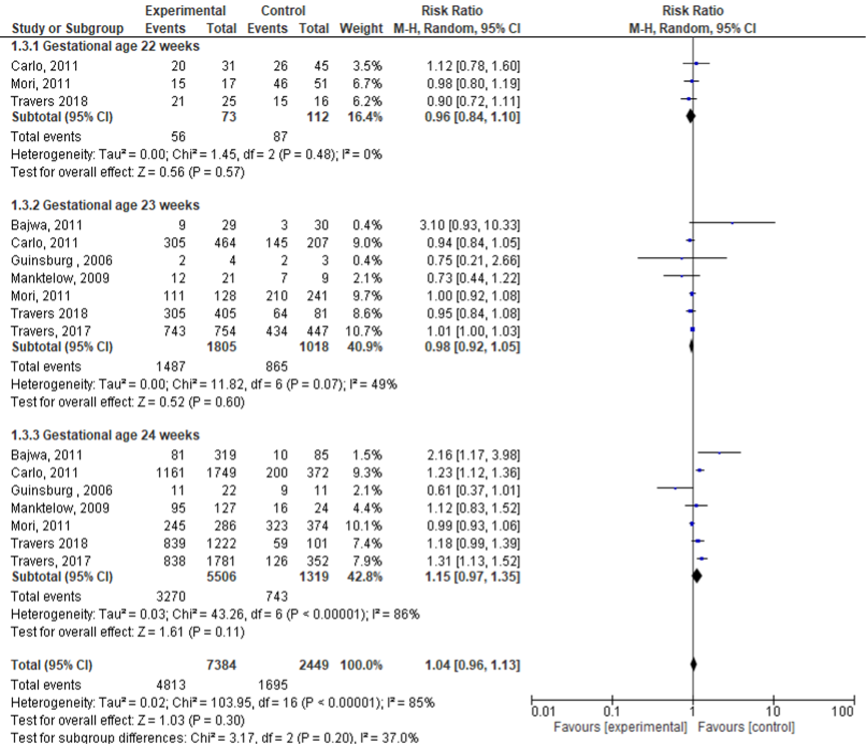
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
- De bewijskracht voor de uitkomstmaat mortaliteit (22 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht voor de uitkomstmaat is niet verlaagd, omdat er geen sprake was van indirectheid, imprecisie en publicatiebias. Er is niet afgetrokken voor risk of bias, ondanks de residuele confounding in een deel van de geïncludeerde studies. Ook niet voor heterogeniteit omdat, ondanks de hoge I² de betrouwbaarheidsintervallen van de individuele studies het overkoepelende betrouwbaarheidsinterval overlappen. In Ehret (2018) werd er gecorrigeerd voor de belangrijkste confounders. Ehret (2018) toonde aan dat er nauwelijks verschil was tussen de gecorrigeerde en ongecorrigeerde effectmaat. Omdat de resultaten van de geïncludeerde studies voor de uitkomstmaat vergelijkbaar zijn met de studie van Ehret (2018) werd er niet afgetrokken voor risk of bias. Derhalve komt de bewijskracht voor de uitkomstmaat uit op laag.
- De bewijskracht voor de uitkomstmaat mortaliteit (23 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht voor de uitkomstmaat is niet verlaagd, omdat er geen sprake was van indirectheid, imprecisie en publicatiebias. Er is niet afgetrokken voor risk of bias, ondanks de residuele confounding in een deel van de geïncludeerde studies. In Ehret (2018) werd er gecorrigeerd voor de belangrijkste confounders. Ehret (2018) toonde aan dat er nauwelijks verschil was tussen de gecorrigeerde en ongecorrigeerde effectmaat. Omdat de resultaten van de geïncludeerde studies voor de uitkomstmaat vergelijkbaar zijn met de studie van Ehret (2018) werd er niet afgetrokken voor risk of bias. Derhalve komt de bewijskracht voor de uitkomstmaat uit op laag.
- De bewijskracht voor de uitkomstmaat mortaliteit (24 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht voor de uitkomstmaat is niet verlaagd, omdat er geen sprake was van indirectheid, imprecisie en publicatiebias. Er is niet afgetrokken voor risk of bias, ondanks de residuele confounding in een deel van de geïncludeerde studies. In Ehret (2018) werd er gecorrigeerd voor de belangrijkste confounders. Ehret (2018) toonde aan dat er nauwelijks verschil was tussen de gecorrigeerde en ongecorrigeerde effectmaat. Omdat de resultaten van de geïncludeerde studies voor de uitkomstmaat vergelijkbaar zijn met de studie van Ehret (2018) werd er niet afgetrokken voor risk of bias. Derhalve komt de bewijskracht voor de uitkomstmaat uit op laag.
- De bewijskracht voor de uitkomstmaat ernstige intraventriculaire bloeding of periventriculaire leukomalacie (22 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht voor de uitkomstmaat is verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben meer kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden), het geringe aantal patiënten, events, en het 95% BI van het overall effect dat de waarde van geen effect en klinisch relevant effect (imprecisie) en vanwege de heterogeniteit in de definitie van de uitkomstmaat (inconsistentie). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
- De bewijskracht voor de uitkomstmaat ernstige intraventriculaire bloeding of periventriculaire leukomalacie (23 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht voor de uitkomstmaat is verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben meer kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden) en het 95% BI van het overall effect omvat de waarde van geen effect en waarde klinisch relevant effect (imprecisie) en vanwege de heterogeniteit in de definitie van de uitkomstmaat (inconsistentie). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
- De bewijskracht voor de uitkomstmaat ernstige intraventriculaire bloeding of periventriculaire leukomalacie (24 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht voor de uitkomstmaat is verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben minder kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden) en het 95% BI van het overall effect overschrijdt de grenzen van klinische besluitvorming (imprecisie) en vanwege de heterogeniteit in de definitie van de uitkomstmaat (inconsistentie) Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
- De bewijskracht voor de uitkomstmaat necrotiserende enterocolitis (22 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht voor de uitkomstmaat is verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben meer kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden) en vanwege het geringe aantal patiënten, het geringe aantal events en het 95%BI van het overall effect dat de grenzen voor klinische besluitvorming overschrijdt (imprecisie). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
- De bewijskracht voor de uitkomstmaat necrotiserende enterocolitis (23 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht is verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben meer kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden), het geringe aantal events en het 95%BI van het overall effect dat de grens voor klinische besluitvorming overschrijdt (imprecisie). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
- De bewijskracht voor de uitkomstmaat necrotiserende enterocolitis (24 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht is verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben meer kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
- De bewijskracht voor de uitkomstmaat bronchopulmonale dysplasie (22 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht is verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben meer kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden) en het geringe aantal patiënten (imprecisie). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
- De bewijskracht voor de uitkomstmaat bronchopulmonale dysplasie (23 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht is verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben meer kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
- De bewijskracht voor de uitkomstmaat bronchopulmonale dysplasie (24 weken) startte laag vanwege de inclusie van observationele studies. De bewijskracht is verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias; kinderen die werden behandeld met corticosteroïden hebben meer kans om de ziekte te ontwikkelen, dan kinderen die niet werden behandeld met corticosteroïden) en het 95%BI van het overall effect dat de grens voor klinische besluitvorming overschrijdt (imprecisie). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
‘Wat zijn de ongunstige neonatale effecten van het toedienen van corticosteroïden, vergeleken met geen corticosteroïden, aan zwangeren met een dreigende vroeggeboorte bij 22, 23 en 24 weken?’
PICO 1
P: zwangeren met een dreigende vroeggeboorte bij een zwangerschapsduur van 22 weken;
I: corticosteroïden;
C: geen corticosteroïden;
O: mortaliteit, ernstige intraventriculaire bloeding, periventriculaire leukomalacie, necrotiserende enterocolitis, bronchopulmonale dysplasie.
PICO 2
P: zwangeren met een dreigende vroeggeboorte bij een zwangerschapsduur van 23 weken;
I: corticosteroïden;
C: geen corticosteroïden;
O: mortaliteit, ernstige intraventriculaire bloeding, periventriculaire leukomalacie, necrotiserende enterocolitis, bronchopulmonale dysplasie.
PICO 3
P: zwangeren met een dreigende vroeggeboorte bij een zwangerschapsduur van 24 weken;
I: corticosteroïden;
C: geen corticosteroïden;
O: mortaliteit, ernstige intraventriculaire bloeding, peri ventriculaire leukomalacie, necrotiserende enterocolitis, bronchopulmonale dysplasie.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit, ernstige intraventriculaire bloeding, periventriculaire leukomalacie, necrotiserende enterocolitis en bronchopulmonale dysplasie voor de besluitvorming cruciale uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Als grens voor klinisch relevante verschillen werden door de werkgroep voor dichotome uitkomstmaten de default-grenzen van GRADE gehanteerd (een verschil van 25% in het relatief risico (RR=0,75 en RR=1,25; Schünemann, 2013)). Voor mortaliteit definieerde de werkgroep ieder statistisch significant verschil als klinisch relevant.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is gezocht naar artikelen over de effectiviteit van corticosteroïden bij extreme vroeggeboorte in de periode van 1995 tot februari 2019. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 783 resultaten op. In eerste instantie werden systematische reviews gericht op de effecten van corticosteroïden ten opzichte van geen corticosteroïden bij zwangeren met een dreigende extreme vroeggeboorte (AD 22 tot 24 6/7e week) geïncludeerd. Studies die geen data rapporteerden per week zwangerschapsduur werden geëxcludeerd. Op basis van titel en abstract werden in eerste instantie 24 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 23 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 1 systematische review definitief geselecteerd (Deshmukh, 2017).
Hierna werden studies geselecteerd die voldeden aan de selectiecriteria van de systematische review en na de zoekdatum van Deshmukh (2017) werden gepubliceerd. Een nieuwe meta-anaulyse werd uitgevoerd om data uit recent gepubliceerde studies toe te voegen aan de meta-analyse van Deskmukh (2017). Op basis van titel en abstract werden in eerste instantie 12 studies
voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 9 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 3 studies geïncludeerd (Ehret 2018; Travers, 2017; Travers 2018). In totaal werden 4 studies definitief geselecteerd (Deshmukh, 2017; Travers, 2017; Travers 2018; Ehret 2018).
Resultaten
Vier onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Bader, D., Kugelman, A., Boyko, V., Levitzki, O., Lerner-Geva, L., Riskin, A., ... & Israel Neonatal Network. (2010). Risk factors and estimation tool for death among extremely premature infants: a national study. Pediatrics, 125(4), 696-703.
- Barjwa, N. M., Berner, M., Worley, S., & Pfister, R. E. (2011). Population based age stratified morbidities of premature infants in Switzerland. Swiss medical weekly, 141(2526).
- Carlo, W. A., McDonald, S. A., Fanaroff, A. A., Vohr, B. R., Stoll, B. J., Ehrenkranz, R. A., ... & Walsh, M. C. (2011). Association of antenatal corticosteroids with mortality and neurodevelopmental outcomes among infants born at 22 to 25 weeks' gestation. Jama, 306(21), 2348-2358.
- Deshmukh, M., & Patole, S. (2017). Antenatal corticosteroids for neonates born before 25 weeks—a systematic review and meta-analysis. PloS one, 12(5), e0176090.
- Ehret, D. E., Edwards, E. M., Greenberg, L. T., Bernstein, I. M., Buzas, J. S., Soll, R. F., & Horbar, J. D. (2018). Association of antenatal steroid exposure with survival among infants receiving postnatal life support at 22 to 25 weeks’ gestation. JAMA network open, 1(6), e183235-e183235.
- Geurtzen R, van Heijst AFJ, Draaisma JMT, Kuijpers LJMK, Woiski M, Scheepers HCJ, van Kaam AH, Oudijk MA, Lafeber HN, Bax CJ, Koper JF, Duin LK, van der Hoeven MA, Kornelisse RF, Duvekot JJ, Andriessen P, van Runnard Heimel PJ, van der Heide-Jalving M, Bekker MN, Mulder-de Tollenaer SM, van Eyck J, Eshuis-Peters E, Graatsma M, Hermens RPMG, Hogeveen M. Development of Nationwide Recommendations to Support Prenatal Counseling in Extreme Prematurity. Pediatrics 2019 Jun;143(6).
- Guinsburg, R., de Almeida, M. F. B., de Castro, J. S., Silveira, R. C., Caldas, J. P. D. S., Fiori, H. H., ... & Moreira, M. E. (2016). Death or survival with major morbidity in VLBW infants born at Brazilian neonatal research network centers. The Journal of Maternal-Fetal & Neonatal Medicine, 29(6), 1005-1009.
- Guthrie, S. O., Gordon, P. V., Thomas, V., Thorp, J. A., Peabody, J., & Clark, R. H. (2003). Necrotizing enterocolitis among neonates in the United States. Journal of perinatology, 23(4), 278.
- Hayes, E. J., Paul, D. A., Stahl, G. E., Seibel-Seamon, J., Dysart, K., Leiby, B. E., ... & Berghella, V. (2008). Effect of antenatal corticosteroids on survival for neonates born at 23 weeks of gestation. Obstetrics & Gynecology, 111(4), 921-926.
- Manktelow, B. N., Lal, M. K., Field, D. J., & Sinha, S. K. (2010). Antenatal corticosteroids and neonatal outcomes according to gestational age: a cohort study. Archives of Disease in Childhood-Fetal and Neonatal Edition, 95(2), F95-F98.
- Mori, R., Kusuda, S., & Fujimura, M. (2011). Antenatal corticosteroids promote survival of extremely preterm infants born at 22 to 23 weeks of gestation. The Journal of pediatrics, 159(1), 110-114.
- Travers, C. P., Clark, R. H., Spitzer, A. R., Das, A., Garite, T. J., & Carlo, W. A. (2017). Exposure to any antenatal corticosteroids and outcomes in preterm infants by gestational age: prospective cohort study. bmj, 356, j1039.
- Travers, C. P., Carlo, W. A., McDonald, S. A., Das, A., Bell, E. F., Ambalavanan, N., ... & Shankaran, S. (2018). Mortality and pulmonary outcomes of extremely preterm infants exposed to antenatal corticosteroids. American journal of obstetrics and gynecology, 218(1).
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Travers (2017) |
Type of study: Prospective cohort study
Setting and country: Hospital-based, United States
Funding and conflicts of interest: One of the authors is supported by the Agency for Healthcare Research and Quality grant number 5T32HS013852-14, the Perinatal Health and Human Development Research Program of the University of Alabama at Birmingham, and the Children’s of Alabama Centennial Scholar Fund. These funders had no role in: the study design; the collection, analysis, or interpretation of data; the writing of the report; or in the decision to submit the article for publication. The content is solely the responsibility of the authors and does not necessarily represent the official views of the Agency for Healthcare Research and Quality.
One of the authors is on the board of MEDNAX, Inc. No other relationships or activities that could appear to have influenced the submitted work. |
Inclusion criteria: We included infants from 23 0/7 to 34 6/7 weeks’ gestation born between 1 January 2009 and 31 December 2013.
Exclusion criteria: We excluded infants who were not delivered at one of the study hospitals, infants with major anomalies, and those who were transferred to another hospital, to ensure that all outcome data for infants in this study were complete.
N total at baseline: Intervention: 81832 Control: 36109
Important prognostic factors2:
N, mean age: Not reported in the study of Travers (2018)
Sex(infant:
Groups comparable at baseline?
Its is stated in the study of Travers (2017) that all parameters differed significantly between groups (P<0.05)
|
Describe intervention (treatment/procedure/test):
|
Describe control (treatment/procedure/test): No antenatal corticosteroids. |
Length of follow-up: We abstracted all outcomes prospectively from medical records by using standardized definitions. Data were collected until death or discharge, whichever occurred first.
Loss-to-follow-up: Not reported in de study of Travers (2017)
Incomplete outcome data: Not reported in de study of Travers (2017)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Death before discharge 23 weeks ANS 439/754 (58.2) No ANS 331/447 (74.0) AOR (95% CI) 0.47 (0.36 to 0.62) Severe intracranial haemorrhage (Severe intracranial hemorrhage (grade 3 -4) by using Papile’s grading system.) 23 weeks Necrotizing enterocolitis (Surgical necrotizing enterocolitis (stage ≥2) by using the modified Bell’s criteria. Infants diagnosed as having suspected necrotizing enterocolitis (stage 1) were not included.)
Bronchopulmonary dysplasia (Bronchopulmonary dysplasia by using the traditional definition of treatment with supplemental oxygen or respiratory support at 36 weeks’ postmenstrual age.)
|
|
|
Ehret (2018) |
Type of study: Observational cohort study
Setting and country: Hospital-based, United States
Funding and conflicts of interest: Dr Ehret of the authors is director of the global health for the Vermont Oxford Network and received program support for global health initiatives. Dr Edwards reported receiving grants from the Vermont Oxford Netword during the conduct of the study. Ms Greenberg is a salaried employee of the Vermont Oxford Network. Dr Bernstein is an unpaid member of the board of directors of the Vermont Oxford Network. Dr Soll reported receiving personal fees from the Vermond Oxford Network during the conduct of the study, receives a salary from the Vermont Oxford Network, and is an unpaid member of the board of directors of the Vermont Oxford Network. Dr Horbar receives a salary as the chief executive and scientific officer of the Vermont Oxford Network outside the submitted work; and is an unpaid member of the board of directors of the Vermont Oxford Network. No other disclosures were reported.
|
Inclusion criteria: We studied 33 472 infants born between January 1, 2012, and December 31, 2016, at 431 US VON member hospitals with level III and IV neonatal intensive care units (NICUs) that perform surgery on neonates. This analysis includes standardized data collected for liveborn infants born at 22 0/7 weeks’ to 25 6/7 weeks’ gestation, including those who died in the delivery room, and without a minimum birth weight.
Exclusion criteria: We excluded 1329 infants with recognized syndromes or major congenital malformations, 121 infants with missing data, and 55 infants with implausible birth weights, defined as greater than 4 SD above the mean by week and sex.
N total at baseline: Intervention: 26090 Control: 3842 Total: 29932 infants
Important prognostic factors2:
N, mean age: Not reported in the study of Ehret (2018)
Sex (infant, male): 22 weeks 23 weeks Intervention: 2661 (50.5)
Control: 573 (51.9) 24 weeks Intervention: 4883 (52.1)
Groups comparable at baseline? Mothers treated with ANS were more likely to identify with the white racial group, to have received prenatal care, and to have hypertension at all weeks of gestation. Mothers identifying as non-Hispanic and diagnosed with chorioamnionitis were more likely to receive ANS at 23, 24, and 25 weeks. Infants with ANS exposure were more likely to have had caesarean delivery and to be small for gestational age at birth, and less likely to be singleton births or have a 1-minute Apgar score of 3 or less.
|
Describe intervention (treatment/procedure/test): hydrocortisone was administered intramuscularly or intravenously to the mother during pregnancy at any time prior to delivery.
Infants were considered to have received postnatal life support if they received any of the following interventions: respiratory support (including face mask ventilation, nasal continuous positive airway pressure, endotracheal intubation, surfactant therapy, or mechanical ventilation), chest compressions, or epinephrine.
|
Describe control (treatment/procedure/test): Infants who received postnatal life support, but without antenatal steroids.
|
Length of follow-up: Until death, discharge home, or transfer to other hospitals (=hospital discharge).
Loss-to-follow-up: Not reported in the study of Ehret (2018), but patients with missing data were excluded on beforehand.
Incomplete outcome data: Missing data of 121 infants. These infants were excluded from the analyses.
|
Outcome measures and effect size (include 95%CI and p-value if available): 1981/3820 (51.9%) infants who received postnatal life support without ANS exposure survived to hospital discharge. (=1839 died). 18717/25892 (72.3%) infants who received postnatal life support with ANS exposure survived to hospital discharge. (=7175 died) RR survival 1.37 (95%CI 1.32-1.42). At each week of gestation, infants who received both ANS and postnatal life support were more likely to survive than infants who received postnatal life support alone:
Survival until discharge 22 weeks 38.5% vs. 17.7% aRR 2.11 (1.68-2.65)
23 weeks 55.4% vs. 35.6% aRR 1.54 (1.40-1.70) aRR 1.18 (1.12-1.25)
Death until discharge 22 weeks ANS: 61.5% van 546 = 336 NO ANS: 82.3% van 503 = 414 RR 2.17 (1.75-2.70) aRR 2.11 (1.68-2.65)
23 weeks ANS: 44.6% van 5210 = 2326 NO ANS: 64.4% van 1097 = 706 RR 1.55 (1.43-1.69) aRR 1.54 (1.40-1.70)
24 weeks ANS: 28.7% van 9312 = 2672 NO ANS: 40.4% van 1119 = 452 RR 1.20 (1.14-1.26) aRR 1.18 (1.12-1.25)
Adjusted for prenatal care, maternal hypertension, chorioamnionitis, maternal race and ethnicity, multiple births, sex, small for gestational age status, mode of delivery, and hospital-level clustering.
|
|
|
Travers (2018) |
Type of study Prospective cohort study
Setting and Country Hypothesis-driven study using data collected prospectively for the Neonatal Research Network Generic Database and follow-up studies. Funding and conflicts of interest: Dr. Carlo is on the board of MEDNAX Inc; there are no other relationships or activities that could appear to have influenced the submitted work. |
Inclusion criteria: Infants 22 0/7 to 28 6/7 weeks’ gestation with a birth weight of ≥401 g. born from Jan 1, 2006 through Dec 31, 2014, at any of the Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network centers.
Infants with congenital anomalies were included if they were resuscitated as these infants were less likely to have lethal anomalies.
Exclusion criteria: Infants who died in the first 12 hours after birth without delivery room resuscitation were excluded from the primary analysis.
N total at baseline 11022 infants met the inclusion criteria of whom 9715 were exposed to ANS and 1307 were not exposed to ANS.
Important prognostic factors:
Sex (infant, male): Only for the total group, not per week:
ANS: 48.7% male NO ANS: 51.1% male
Groups comparable at baseline? Mothers of infants exposed to antenatal corticosteroids were more likely to be white, delivered by caesarean delivery, and with private health insurance. Infants exposed to ANS had higher birthweight, had longer gestational age, and were more likely to be small for gestational age and the product of multiple births.
|
Describe intervention (treatment/procedure/test): Infants were considered exposed to antenatal corticosteroids if their mother had received ≥1 doses of either betamethasone or dexamethasone.
Complete course if they received at least 2 doses and 24 hours had passed from the time the first dose of antenatal corticosteroids was given. |
Describe control (treatment/procedure/test): Infants not exposed to ANS. |
Length of follow-up: Data were collected using standardized definitions until death or discharge. Follow-up data were collected using standardized definitions on eligible surviving infants at 18-22 months corrected gestational age.
Loss-to-follow-up: 0.5% missing data for the primary outcome. 9.7% missing data for the follow-up outcomes at 18-22 months corrected gestational age.
Incomplete outcome data: Multiple imputation analyses were conducted for outcomes with >1% missing data, or when there was an imbalance of missing data of >0.3% between groups to ensure that results were not affected by missing data. |
Outcome measures and effect size (include 95%CI and p-value if available): Mortality before discharge 22 weeks Complete: 32/48 (66.7) Partial: 19/29 (65.5) No: 79/96 (82.3) aRR complete: 0.83 (0.64-1.07) aRR partial: 0.83 (0.63-1.10)
ANS: 51/77 NO ANS: 79/96 (82.3)
23 weeks Complete: 243/505 (48.1) Partial: 164/310 (52.9) No: 199/280 (71.1) aRR complete: 0.72 (0.63-0.82) aRR partial: 0.80 (0.70-0.91)
ANS: 407/815 NO ANS: 199/280 (71.1)
24 weeks Complete: 480/1406 (34.1) Partial: 184/504 (36.5) No: 105/207 (50.7) aRR complete: 0.57 (0.48-0.67) aRR partial: 0.75 (0.61-0.91)
ANS: 664/1910 NO ANS: 105/207 (50.7)
BPD (physiologic definition) 22 weeks Complete: 13/16 (81.3) Partial: 8/9 (88.9) No: 15/16 (93.8) aRR complete: 0.64 (0.35-1.16) aRR partial: 0.96 (0.82-1.11)
ANS: 21/25 NO ANS: 15/16 (93.8)
23 weeks Complete: 191/261 (73.2) Partial: 114/144 (79.2) No: 64/81 (79.0) aRR complete: 0.80 (0.68-0.94) aRR partial: 0.97 (0.83-1.12)
ANS: 305/405 NO ANS: 64/81 (79.0)
24 weeks Complete: 619/907 (68.2) Partial: 220/315 (69.8) No: 59/101 (58.4) aRR complete: 1.09 (0.92-1.30) aRR partial: 1.18 (0.98-1.41)
ANS: 839/1222 NO ANS: 59/101 (58.4)
The confounders for which the analyses were adjusted are included in the risk of bias table. |
Physiologic definition for bronchopulmonary dysplasia uses an oxygen reduction challenge test among eligible infants. The physiologic definition has been shown to be more reliable and precise than the clinical definition of BPD (supplemental oxygen at 36 weeks’ post-menstrual age). |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Deshmukh, 2017
[individual study characteristics deduced from Deshmukh, 2017 PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of non-RCTs
Literature search up to February 2017
A: Carlo, 2011 B: Hayes, 2008 C: Manktelow, 2009 D: Mori, 2011 E: Guinsburg, 2016 F: Bajwa, 2011 G: Guthrie, 2003 H: Bader, 2010
Study design (non-RCTs): A: prospective F: prospective G: retrospective H: prospective
Setting and Country (results extracted from individual studies): E: Hospital-based, Brazil G: Hospital-based, United States H: Hospital-based, Israel
Source of funding and conflicts of interest (results extracted from individual studies): [commercial / non-commercial / industrial co-authorship] A: Authors have completed and submitted the ICMJE Form for Disclosure of Potential Conflicts of Interest. Dr Carlo reported that he is a board member of Mednax. Dr Sa´ nchez reported that he received study funding from F. Hoffman- LaRoche Ltd and Astellas for his work on the Collaborative Antiviral Study Group. Dr van Meurs reported that she received consulting fees, honorarium, and equipment support from Ikaria; travel, accommodations, and meeting expenses paid for by Actelion and Ikaria; and payment from legal firms for expert testimony for various lawsuits. Dr Faix reported that he serves on a data and safety monitoring board and receives funding from Ikaria Biosynexus. No other authors reported disclosures. The National Institutes of Health and the Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD) Labor, and Welfare, Japan. The authors declare no conflicts of interest. E: The authors declare no conflicts of interest. The source of funding was is not reported. support and no other potential conflict of interest relevant to this article were reported. G: Source of funding and conflicts of interests were not reported H: The authors have indicated they have no financial relationships relevant to this article to disclose. Conflicts of interests were not reported.
|
Inclusion criteria SR: - Intervention/comparison: Antenatal glucocorticosteroids of any type (e.g. Betamethasone, Dexamethasone), dose (single/multiple), duration vs. placebo/control.
Exclusion criteria SR:
A total of 20 non-RCTs were eligible for inclusion in the systematic review. Data from 12 of these 20 studies was not available for meta-analysis despite contacting the authors. Finally, 8 non-RCTs were included in the review.
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age: Not reported in the systematic review of Deshmukh, 2017 (A-H)
Sex:
Groups comparable at baseline? |
Describe intervention (steroid type):
A: Betamethasone, Dexamethasone B: Betamethasone, Dexamethasone C: Betamethasone, Dexamethasone D: Betamethasone, Dexamethasone E: Not reported in the systematic review of Deshmukh, 2017. Also not mentioned in the individual studies. F: Not reported in the systematic review of Deshmukh, 2017. Also not mentioned in the individual studies. G: Hydrocortisone, Dexamethasone H: Not reported in the systematic review of Deshmukh, 2017. Also not mentioned in the individual studies. |
Describe control:
Placebo/control (A-H). Not reported in the systematic review of Deshmukh, 2017.
|
End-point of follow-up: Not reported in the systematic review of Deshmukh, 2017 (A-H)
For how many participants were no complete outcome data available? (intervention/control) Not reported in the systematic review of Deshmukh, 2017 (A-H)
|
Outcome measure 1 - neonatal mortality Defined as death before discharge from the neonatal unit during the first admission after birth. Effect measure: OR [95% CI]: Gestational age 22 weeks A: 0,58 (0,35,0,96) D: 0,60 (028, 1,28) Pooled effect (random effects model): 0.58 [95% CI 0.38 to 0.89] favoring the use of corticosteroids. Heterogeneity (I2): 0%
A: 0.52 (0.43, 0.63) 0.50 [95% CI 0.42 to 0.58] favoring the use of corticosteroids. Heterogeneity (I2): 0%
Gestational age 24 weeks A: 0.63 (0.54, 0.74) 0.44 [95% CI 0.29 to 0.67] favoring the use of corticosteroids. Heterogeneity (I2): 83%
0.47 [95% CI 0.39 to 0.56] favoring the use of corticosteroids. Heterogeneity (I2): 54%
Outcome measure 2 - Severe intraventricular haemorrhage (IVH) or periventricular leukomalacia (PVL): Gestational age 22 weeks A: 1.29 (0.42, 3.92) D: 0.93 (0.44, 1.99) Pooled effect (random effects model): 1.03 [95% CI 0.55 to 1.93] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 0% 0.75 [95% CI 0.55 to 1.03] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 21% A: 0.75 (0.58, 0.97) 0.66 [95% CI 0.55 to 0.79] favoring the use of corticosteroids Heterogeneity (I2): 0% 0.71 [95% CI 0.61 to 0.82] favoring the use of corticosteroids Heterogeneity (I2): 5%
Outcome measure 3 - Chronic lung disease (CLD): A: 1.33 (0.52, 3.42) D: 0.82 (0.14, 4.65)
Pooled effect (random effects model): 1.19 [95% CI 0.52 to 2.73] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 72% A: 0.82 (0.58, 1.17) D: 0.96 (0.51, 1.82)
Pooled effect (random effects model): 0.94 [95% CI 0.59 to 1.51] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 28%
A: 1.70 (1.35, 2.13) F: 2.55 (1.26, 5.17)
Pooled effect (random effects model): 1.36 [95% CI 0.86 to 2.17] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 67%
Overall pooled effect (random effects model): 1.19 [95% CI 0.85 to 1.65] neither corticosteroids or control/placebo Heterogeneity (I2): 59%
Gestational age 22 weeks A: 0.11 (0.01, 2.00) D: 1.95 (0.48, 7.96) Pooled effect (random effects model): 0.59 [95% CI 0.03 to 12.03] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 72%
Gestational age 23 weeks E: 1.94 (0.17, 22.43)
0.93 [95% CI 0.66 to 1.32] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 0% Gestational age 24 weeks A: 1.05 (0.73, 1.51) Pooled effect (random effects model): 0.95 [95% CI 0.71 to 1.29] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 0%
0.95 [95% CI 0.76 to 1.19] favoring neither corticosteroids or control/placebo Heterogeneity (I2): 0% |
|
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Park, 2016 |
Gezocht tot maart 2016 |
|
Roberts, 2017 |
Gaat over een andere vergelijking (≤ 35 weken t.o.v. ≥ 34 weken) |
|
Medlock, 2011 |
Beschrijft predictiemodellen voor mortaliteit bij extreme vroeggeboorte |
|
Megann, 2017 |
Geen systematische review (de effectiviteit van corticosteroïden is niet beschreven per week) |
|
Linsell, 2016 |
Gaat over een ander onderwerp (prognostische factoren voor CP en motorische beperking; patiëntengroep ≤32 weken) |
|
Salihu, 2013 |
Gaat over een ander onderwerp (de overleving van kinderen die geboren zijn bij < 24 weken) |
|
Skoll, 2018 |
Richtlijn |
|
Deshmukh, 2018 |
Update van Deshmukh (2018), maar niet systematisch gezocht |
|
Ladhani, 2017 |
Richtlijn |
|
Mallooy, 2012 |
Geen systematische review (de effectiviteit van corticosteroïden is niet uitgesplitst per week) |
|
Onland, 2011 |
Proefschrift |
|
Crowley, 2000 |
Artikel bestaat niet meer vanwege een update |
|
Howell, 2010 |
Geen systematische review (de effectiviteit van corticosteroïden is niet uitgesplitst per week) |
|
Leeman, 1996 |
Case report |
|
Yu, 2007 |
Beschrijvend artikel |
|
Sentilhes, 2016 |
Franstalig |
|
Ronkainen, 2015 |
Gaat over een ander onderwerp (de voorspellende waarde van extreme vroeggeboorte en (de ernst van BPD) voor longfunctie) |
|
Quinn, 2010 |
Beschrijvende review |
|
Twilhaar, 2018 |
Gaat over een ander onderwerp (beoordelen van risicofactoren voor cognitieve vaardigheden bij te vroeg geboren kinderen) |
|
Brownfoot, 2013 |
Gaat over een andere vergelijking (de effectiviteit van verschillende typen corticosteroïden wordt met elkaar vergeleken) |
|
Halliday, 2006 |
Gaat over een andere vergelijking (de effectiviteit van verschillende typen corticosteroïden wordt met elkaar vergeleken) |
|
Wen, 2004 |
Beschrijvende review |
|
Allen, 2001 |
Gaat over een ander onderwerp (de behandeling van monoamniotische tweelingen) |
|
Kim, 2018 |
Deze studie stratificeert niet voor het aantal zwangerschapsweken, dus geeft geen antwoord op de PICO. Aangezien dit ook een exclusie criteria was voor de review, is deze studie uitgesloten. |
|
Simjak, 2018 |
Gaat over een ander onderwerp (identificatie van factoren die de korte termijn uitkomsten van extreem te vroeg geboren beïnvloeden) |
|
Norberg, 2017 |
Gaat over een andere vergelijking (de timing van corticosteroïden) |
|
Diguisto, 2018 |
Evaluatie van de associatie tussen actieve opvang en neonatale uitkomsten bij extreem te vroeg geboren kinderen |
|
Fuller, 2017 |
Gaat over een andere vergelijking (de timing van corticosteroïden) |
|
Diguisto, 2017 |
Gaat over een ander onderwerp (de identificatie van factoren die geassocieerd zijn aan actieve opvang) |
|
Gyamfi-Bannerman, 2017 |
Commentaar |
|
Smith, 2017 |
Gaat over een ander onderwerp (de internationale variaties in de behandeling en overleving van extreem te vroeg geboren kinderen) |
|
Travers, 2017 |
Ander onderwerp, gaat over de timing van corticosteroïden |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 07-02-2024
Laatst geautoriseerd : 07-02-2024
Geplande herbeoordeling : 01-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in (2017) een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom extreme vroeggeboorte.
Werkgroep
- Dr. M. (Monique) Rijken (voorzitter vanaf januari 2020), kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. A.F.J. (Arno) van Heijst (voorzitter tot december 2019), kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. M. (Marjon) de Boer, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dhr. S.P. (Bas) Bol, Verpleegkundig Specialist, Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Dr. J.J. (Hans) Duvekot, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. A. (Annemiek) Evers, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. M. (Marije) Hogeveen, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. J.J. (Joepe) Kaandorp, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. M.J.K. (Martin) de Kleine, Kinderarts n.p., Care4Neo
- Drs. K.E. (Karianne) Kraft, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. G.T.R. (Wendy) Manten, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Mw. F. (Farideh) Mostafai Alai, Physician Assistant / Klinisch Verloskundige, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV)
- Drs. M.E. (Mayke) van der Putten, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. M.M. (Martina) Porath, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
Klankbordgroep
- Dr. P. (Peter) Andriessen, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. A. (Annemieke) Bolte, gynaecoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. A.B.C. (Audrey) Coumans, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Drs. M. (Maureen) Franssen, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. F. (Floris) Groenendaal, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Mw. Marie-Josée de Haan – Gremmé MSc, klinisch Verloskundige, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV)
- Mw. Bianca Hekkink, ICN verpleegkundige, Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Dr. R. (Rene) Kornelisse, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. E.M. (Margo) Lutke Holzik (Graatsma), gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Drs. S. (Susanne) Mulder-de Tollenaer, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Mw. Janine Pingen MSc, Stichting Kind en Ziekenhuis (SKZ)
- Drs. J.J. (Jeanine) Sol, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. W.G. (Minke) van Tuijl, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
Externe experts (betrokken in diverse fasen van de ontwikkeling van de richtlijn)
- Dr. R. (Rosa) Geurtzen, kinderarts, fellow neonatologie Radboud UMC – later toegevoegd aan de werkgroep
- Mw. I. (Ilona) Jochems, Care4Neo
- Mw. B. (Brenda) van Osch, journalist, schrijver ('Het onvoltooide kind')
- prof. dr. A.A.E. (Eduard) Verhagen, kinderarts, afdelingshoofd, UMCG
- Dr. A.E. (Anna) Westra, kinderarts, medisch ethicus namens de werkgroep ethiek in richtlijnen, Flevoziekenhuis
Met ondersteuning van
- Dr. J. (Janke) de Groot, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2019)
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2019)
- Mw. A.L.J. (Andrea) Kortlever - van der Spek MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. (Marjolein) de Weerd, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot augustus 2019)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mostafai Alai |
PA Klinisch verloskundige Werkgever: Admiraal De Ruyter ziekenhuis Goes" |
"lid van patiënten veiligheidscommissie. Bespreking en beoordeling van de calamiteiten in het ziekenhuis. Werkgever: Admiraal De Ruyter ziekenhuis Goes - lid van de commissie Veilig incident melden (VIM). Bespreking en beoordeling van de incidenten op de kraam/zwangere afdeling. werkgever: Admiraal De Ruyter Goes. - Lid van de commissie perinatale audit. Maken van de chronologische verslagen van de intrauteriene vrucht dood en andere calamiteiten, bespreking en beoordeling van de casussen. Werkgever: Admiraal De Ruyter ziekenhuis Goes." |
Geen |
Geen actie |
|
Bol |
Verpleegkundig Specialist. Neonatologie Erasmus MC -sophia, Rotterdam |
Bestuurslid VenVN VS - onbetaald |
Geen |
Geen actie |
|
Kraft |
Kinderartsneonatoloog UMCG |
Geen |
Geen |
Geen actie |
|
Manten |
Gynaecoloogperinatoloog, Afdeling gyneaecologie en obstetrie, Isala klinieken, Zwolle |
Geen |
Geen |
Geen actie |
|
Rijken |
Kinderarts neonatoloog Leids Universitair Medisch Centrum |
Voorzitter werkgroep Landelijke Neonatale Follow-up (multidisciplinaire werkgroep), bestaande uit hoofdzakelijk kinderartsen, kinderfysiotherapeuten en kinderpsychologen, die goede en gestructureerde nazorg van NICU patienten in Nederland als doel heeft)
-Vice-voorzitter lokale en regionale Perinatale Audit-team Leiden - Lid Verloskundig SamenwerkingsVerband (VSV) Leiden (buitengewoon bestuurslid) - Lid Nederlands- Vlaamse Werkgroep Neonatale Neurologie - Lid Projectgroep JGZrichtlijn Motorische Ontwikkeling (meelezen en beoordelen geleverde stukken) - Lid adviescommissie ontwikkelingsonderzoek Nederlands Centrum Jeugdgezondheidszorg (op persoonlijke titel; 3x per jaar vergadering - beoordeling vergaderstukken en meebeslissen hierover) |
Betrokken bij promotietraject EPI-DAF studie (Extremely Preterm Infants - Dutch Analysis on Follow-up). Recent gestarte studie vanuit MMC te Veldhoven, in samenwerking met de NICU's, LNF, N3 en Perined |
Geen actie |
|
Hogeveen |
Kinderartsneonatoloog |
Voorzitter WLAN/ N3 Aanbevelingen - Bestuurslid N3 -principal lecturer -associate professor
|
PreCo studie: framework keuzehulp; PreCo study = Prenatal counseling in extreme prematurity |
Geen actie |
|
Kleine de |
Kinderarts, gepensioneerd |
Bestuurslid Vereniging van Ouders van Couveusekinderen, onbetaald als bestuurslid Care4Neo een One time vendor agreement met Philips Design, betaald aan de Care4Neo. Medisch adviseur VEDUMA" |
De Care4Neo participeert in onderzoek. De vertegenwoordigers van Care4Neo participeren niet op persoonlijk basis of voor eigen rekening in onderzoek. |
Geen actie |
|
Duvekot |
GynaecoloogPerinatoloog |
Directeur Medisch Advies en Expertise Bureau Duvekot (betaald) kwaliteitsdocumenten (betaald) Voorzitter Adviescommissie Richtlijnen FMS (betaald) |
Geen |
Geen actie |
|
Boer |
GynaecoloogPerinatoloog, Amsterdam UMC, locatie VUMC |
Geen |
ZON-MW gesubsidieerd onderzoek naar vroeggeboorte. |
Geen actie |
|
Heijst van |
Kinderarts- Neonatoloog, Radboudumc, Nijmegen |
Geen |
Geen |
Geen actie |
|
Putten van der |
Kinderartsneonatoloog te MUMC |
NLS-instructeur (SSHK), onbetaald |
Geen |
Geen actie |
|
Porath |
Gynaecoloogperinatoloog Máxima Medisch Centrum te Eindhoven/Veldhoven |
"Lid NVOG werkgroep Otterlo, onbetaald Lid NVOG werkgroep Foetale Echoscopie, onbetaald Lid NVOG werkgroep Foeto-Maternale ziekte, onbetaald" |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door de afgevaardigde van de patiëntenvereniging in de werkgroep en door participatie van ouders van patiënten in de Invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deelnemers van de Invitational conference en de betrokken patiëntenvereniging. De aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntvertegenwoordigers van Care4Neo en Kind en Ziekenhuis hebben deelgenomen aan de knelpuntenanalyse, er heeft een vertegenwoordiger in de werkgroep gezeten die betrokken is geweest bij de module over samen beslissen. Beide organisaties waren onderdeel van de klankbord groep en hebben in die rol de richtlijn van commentaar voorzien en Care4Neo had een actieve rol in het ouderperspectief tijdens een extra ingelaste IC over ethische overwegingen bij deze richtlijn.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg rondom extreme vroeggeboorte. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en stakeholders via een Invitational conference. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review (SR) per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de
GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-todecision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; AlonsoCoello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADEmethodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur).
Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast. De wijzigingen werden voorgelegd aan de klankbordgroep. Vanwege het feit dat er buitengewoon veel wijzigingen zijn doorgevoerd werd een tweede commentaarronde uitgezet. De definitieve tekst werd na de tweede commentaarronde vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënten)organisaties voorgelegd voor autorisatie. Ook in deze vorm kon de richtlijn niet geaccordeerd worden door NVK en NVOG gezien de te verwachten capaciteits- en juridische problemen bij een ondergrens voor actieve opvang van 23 weken, nader besproken in het hoofdstuk ‘Organisatie van Zorg’ en de juridische paragraaf. Derhalve vond op 29 november 2022 een consultatie plaats van de richtlijnwerkgroep met de besturen van NVK en NVOG. In gezamenlijk overleg werd uiteindelijk besloten in deze richtlijn de ondergrens voor actieve opvang in Nederlandse ziekenhuizen te handhaven op 24 weken en dit ook als zodanig in deze richtlijn op te nemen.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
