Beleid bij dreigende extreme vroeggeboorte
Uitgangsvraag
Wanneer wordt in Nederland actieve neonatologische opvang aanbevolen?
Aanbeveling
Bied bij dreigende vroeggeboorte (spontaan of iatrogeen) de mogelijkheid aan van actieve opvang vanaf een geschatte zwangerschapsduur van 24+0 weken
Maak ten behoeve van het counselingsgesprek een inschatting van het risico op een slechte uitkomst op basis van zwangerschapsduur en individuele factoren met behulp van figuur 1.5
Bespreek het voorgestelde beleid met de ouders:
- In de hoog risico- en matig-hoog risico groep dienen zowel op comfort gerichte zorg als actieve opvang, beide als even respectvolle, hoewel medisch en emotioneel onvergelijkbare, opties te worden besproken. Maak duidelijk dat de voorkeur en waardering van de ouders belangrijk is en dat zij een rol spelen in de besluitvorming. De zwangere is formeel degene die met de arts de keuze maakt.
- Als het perinatologisch team het risico als ‘extreem hoog’ inschat wordt op comfort gerichte zorg aanbevolen en wordt geen actieve opvang aangeboden, ook al heeft actieve opvang de voorkeur van de zwangere of van de ouders
- Leg het uiteindelijke besluit schriftelijk vast
Overwegingen
Afweging van de keuze voor actieve opvang en op comfort gerichte zorg en de kwaliteit van het bewijs
Op dit moment wordt in Nederland zowel actieve opvang als op comfort gerichte zorg aangeboden aan extreem vroeggeboren kinderen tussen een zwangerschapsduur van 24+0 weken tot 26+0 weken. Op basis van huidige beschikbare cijfers, de ethische discussie tijdens de invitational conference én het geleverde commentaar op de conceptrichtlijn is besloten de zone van extreme vroeggeboorte te definiëren van 23+0 tot 26+0 weken. Binnen deze zone wordt het risico op ongunstige uitkomsten (overlijden of overleven met ernstige handicaps) ingeschat op basis van de zwangerschapsduur en individuele factoren. Op basis van deze risico inschatting wordt of op comfort gerichte zorg aanbevolen (risico inschatting: extreem hoog risico), of worden beide opties als even respectvol met behulp van gedeelde besluitvorming met ouders besproken (risico inschatting: matig-hoog-risico of hoog risico).
Internationale data
Uit de internationale literatuur blijkt dat de overleving van levend geboren kinderen toeneemt van 7% bij 22 weken tot 84% bij 26 weken. Echter, het is niet mogelijk om in de verschillende studies onderscheid te maken tussen overlijden van het kind door het niet starten van actieve behandeling of overlijden ondanks het starten van actieve behandeling. Idealiter zou je de percentages mortaliteit willen evalueren in studies van centra die alleen actieve opvang hebben aangeboden bij bv. 22, 23 en 24 weken zwangerschapsduur; echter in veel studies ontbreken deze gegevens. Overleving van kinderen opgenomen op een NICU neemt toe van 24% bij 22 weken naar 84% bij 26 weken (Myrhaug 2019) .
Minstens zo belangrijk als overleving op zich, is overleving zonder ernstige handicaps. De studie van Ding (2019) laat zien dat als men op de leeftijd van 4 tot 10 jaar kijkt, er van de 100 overlevende kinderen geboren bij 23 weken 42 een matige of ernstige handicap hebben, dit zijn er 33 bij geboorte bij 24 weken en 23 bij geboorte bij 25 weken.
Dit betekent dat van de 100 op de NICU opgenomen kinderen geboren bij 23 weken er ongeveer 38 blijven leven en ongeveer 62 overlijden. Van de 38 kinderen die overleven hebben er ongeveer 22 geen of milde beperkingen; 9 matige beperkingen; en 7 ernstige beperkingen. Anders uitgedrukt: van de 100 overlevende kinderen hebben er ongeveer 58 geen of milde beperkingen; 23 matige beperkingen; en 19 ernstige beperkingen.
Bij 24 weken overleven er ongeveer 60 en overlijden er ongeveer 40 kinderen. Van de 60 kinderen die overleven hebben er ongeveer 40 geen of milde beperkingen; 10 matige beperkingen; en 10 ernstige beperkingen. Anders uitgedrukt: van de 100 overlevende kinderen hebben er ongeveer 67 geen of milde beperkingen; 16 matige beperkingen; en 17 ernstige beperkingen.
Bij 25 weken overleven er ongeveer 76 en overlijden er ongeveer 24 kinderen. Van de 76 kinderen die overleven hebben er ongeveer 59 geen of milde beperkingen; 9 matige beperkingen; en 8 ernstige beperkingen. Anders uitgedrukt: van de 100 overlevende kinderen hebben er ongeveer 77 geen of milde beperkingen; 12 matige beperkingen; en 11 ernstige beperkingen
Als, samen met ouders, niet gekozen is voor actieve opvang, zal het kind komen te overlijden waarbij op comfort gerichte zorg plaatsvindt. Wanneer gekozen wordt voor actieve opvang, is bij een jongere zwangerschapsduur de kans dus relatief groot dat het kind alsnog komt te overlijden op de NICU ondanks een intensieve en ingrijpende behandeling. Dit dient meegenomen te worden in de gedeelde besluitvorming met ouders.
Hoewel de geïncludeerde studies heterogeen zijn, wijst het merendeel van de studies in dezelfde richting; namelijk dat individuele factoren zoals geboortegewicht, geslacht en éénlingzwangerschap de overlevingskans beïnvloeden bij extreme vroeggeboorte. De systematische literatuuranalyse laat zien dat een hoger geboortegewicht, een vrouwelijk geslacht en een éénling zwangerschap leiden tot een hogere overlevingskans. Etniciteit lijkt geen voorspellende factor te zijn. Wanneer naast zwangerschapsduur andere factoren worden meegenomen dan wordt het advies meer geïndividualiseerd in plaats van het hanteren van een harde grens op basis van zwangerschapsduur. De uitkomsten van studies naar individuele factoren zijn heterogeen ten aanzien van de lange termijn uitkomsten en berusten op een zeer lage bewijskracht.
Studies die niet-extreem vroeggeboren maar vroeggeboren kinderen of kinderen met een laag geboortegewicht volgen laten ook zien dat geboortegewicht, geslacht en éénlingzwangerschap van invloed zijn op de overleving (Aarnoudse Moens, 2009; Brydes, 2018; Linsell, 2016; Twilhaar, 2018; van Beek, 2021). Op grond van bovenstaande kunnen we concluderen dat, met in achtneming van de beperkingen van het cohortonderzoek, individuele factoren invloed hebben op de prognose van extreem vroeggeboren kinderen.
In landen om ons heen worden individuele factoren al langer meegenomen in de afweging rondom wel of geen actieve opvang bij extreme vroeggeboorte. Eind 2019 is de richtlijn ‘Extremes of prematurity Guideline’ van de British Association of Perinatal Medicine (BAPM) verschenen. In deze richtlijn is een ondersteunende figuur opgenomen waarin naast potentiële beïnvloedbare factoren, ook verschillende individuele factoren zijn opgenomen om het risico op slechte uitkomsten te duiden. In lijn met de bevindingen in deze richtlijn zijn naast zwangerschapsduur ook geboortegewicht, geslacht en meerlingzwangerschap opgenomen als additionele beïnvloedende factoren voor uitkomsten bij extreme vroeggeboorte. Voor deze Nederlandse richtlijn introduceert de werkgroep ook een figuur, gebaseerd op de Engelse maar aangepast aan de NL situatie, waarin individuele factoren zijn verwerkt en meegenomen kunnen worden in de counseling met ouders (Figuur 1.5). Daarnaast zijn ook de externe factoren ‘antenatale steroïden (zie module antenatale steroïden) en de locatie van geboorte meegenomen in het risico-figuur. Let wel, de relatieve impact van de ernst per factor op de uitkomst kon niet worden geduid.
Figuur 1.5 Risico inschatting bij extreme vroeggeboorte. Let wel, de relatieve impact van de ernst per factor op de uitkomst kon niet worden geduid.
Het meenemen van individuele factoren maakt dat daarmee de richtlijn dichter bij een op individuele prognose gebaseerd beleid komt hetgeen de voorkeur van de meerderheid van zorgprofessionals is.
Hoewel zwangerschapsduur een belangrijke voorspeller is, moet men rekening houden met de mogelijke foutmarge van de zwangerschapsduur. De foutmarge voor een zwangerschapsduur kan variëren van 3 tot 4 dagen wanneer de zwangerschapstermijn is vastgesteld in het eerste trimester van een spontane zwangerschap, tot 1 tot 2 weken wanneer deze op een later moment is vastgesteld. Daarmee kan het gebruik van zwangerschapsduur alleen een beperkt, vertekend beeld geven (bij IVF is de zwangerschapsduur vaak wel duidelijk). Echter, de gegevens waar wij ons op baseren ook voortkomen uit onderzoeken waarin foutmarges kunnen zitten in de zwangerschapsduur en daarmee een vergelijkbare onzekerheid kennen. Daarnaast kan het hanteren van alleen de zwangerschapsduur arbitrair zijn, in theorie zou het één dag en soms maar één uur kunnen schelen, dit maakt de keuze tussen wel of geen actieve opvang aanbieden soms erg lastig. Er is een toename in de kans op overleven bij het toenemen van de zwangerschapsduur binnen dezelfde zwangerschapsweek. In het artikel van Wilkinson (2016) wordt gesuggereerd dat dit verschil 3% per dag is tussen 22 en 25 weken GA. Het artikel van Thomas (2020) toont een evident verschil in kans op overleving tussen kinderen geboren in de eerste helft van de zwangerschapsweek en kinderen geboren in de tweede helft van de zwangerschapsweek voor zowel 24, 25 als 26 weken maar niet voor 23 weken. Ook de studie van Schindler (2016) toont dit voor 24 en 25 weken aan.
Ook lijkt het erop dat de grens voor wel of niet aanbieden van resuscitatie voor premature kinderen anders ligt dan voor oudere kinderen en volwassenen. Het lijkt onwaarschijnlijk dat er een andere patiëntengroep is met 50% kans op overleven en 50% kans op een normale uitkomst bij overleven waarbij men vindt dat dit “te slecht” is om IC behandeling aan te bieden. De potentiële last is een relatief lange ziekenhuisopname met de daarbij behorende handelingen voor premature pasgeborenen met onzekerheid over de toekomst en risico op lange termijn gevolgen (handicaps). Aan de andere kant is de potentiële winst ook vele jaren langer. Tevens bestaan er verschillen in weging tussen professionals en (ouders van) patiënten. Professionals beoordelen ernstige handicaps vaak als een slechtere uitkomst dan dood (Saigal, 2009). Daarnaast weten we dat de meeste ouders van premature kinderen de kwaliteit van leven als goed beoordelen, zelfs in geval van handicaps (Saigal, 2000).
Nationale data.
Er is behoefte aan betrouwbare Nederlandse data over overleving en vooral over overleving zonder ernstige beperkingen. Er zijn al wat data voorhanden over de mortaliteit en de korte termijn. Sinds de invoering van de vorige richtlijn (2010) waarbij de ondergrens om actieve opvang aan ouders aan te bieden van 25 naar 24 weken is verschoven, zien we een toename van kinderen geboren bij 24 weken die op de NICU opgenomen worden, namelijk van 27% (jaren 2007/2009) naar 69% (jaren 2011/2017). De overleving van op de NICU opgenomen kinderen bij 24 weken veranderde niet (van 50% naar 46%), maar de overleving van de levend geboren kinderen steeg van 13% (2007/2009) naar 34% (2011/2017). De overleving van kinderen geboren bij 25 weken opgenomen op de NICU steeg van 63% naar 68%, de overleving van kinderen levend geboren bij 25 weken steeg van 55% naar 59%. De overleving van kinderen geboren bij 26 weken opgenomen op de NICU steeg van 77% naar 82%, de overleving van kinderen levend geboren bij 26 weken steeg van 69% naar 75%. (Van Beek, 2021) In de huidige landelijke registratie is op dit moment niet goed terug te vinden of kinderen geboren bij 24 en 25 weken zijn overleden vanwege de keuze van ouders voor op comfort gerichte zorg, of dat de kinderen ondanks een actief beleid zijn overleden.
In het eerste jaarcohort extreem vroeggeboren kinderen, geboren na de invoering van de vorige richtlijn (oktober 2010 tot oktober 2011) was de overleving 43% van de levendgeborenen na 24 weken en 61% bij geboorte na 25 weken. De overleving indien opgenomen op de NICU was 46% bij de 24-wekers en 65% bij de 25-wekers. (de Kluiver, 2013) Hetzelfde cohort werd onderzocht op de leeftijd van 2 jaar: van de kinderen geboren na 24 weken had 20% milde en 20% matig/ernstige beperkingen. Van de kinderen geboren na 25 weken had 17% milde en 12% matig/ernstige beperkingen. Gerekend over álle kinderen geboren bij 24 weken, bereikte 25% de leeftijd van 2 jaar zonder beperkingen. (Aarnoudse-Moens, 2017[1]) Van 100 kinderen in Nederland geboren bij 24 weken en opgenomen op de NICU: 54 overleden en 46 overleefden; hiervan hadden er 28 geen beperkingen, 9 milde en 9 matig tot ernstige beperkingen op leeftijd van 2 jaar. Van 100 kinderen in Nederland geboren bij 25 weken en opgenomen op de NICU: 32 overleden, 68 overleefden; hiervan hadden er 48 geen beperkingen; 12 milde en 8 matig tot ernstige beperkingen op leeftijd van 2 jaar.
[1] De algehele uitkomst van het follow-uponderzoek op de gecorrigeerde leeftijd van 2 jaar werd gedefinieerd als ‘ernstige beperking’ bij abnormaal neurologisch functioneren (GMFCS-graad IV en V), blindheid of doofheid, of een cognitieve score < 55 (< -3,0 SD). ‘Matige beperking’ was gedefinieerd als abnormaal neurologisch functioneren (GMFCS-graad II en III), een auditieve of visuele handicap ondanks het gebruik van hulpmiddelen, of een cognitieve score van 55-69 (< -2,0 SD). De uitkomst ‘milde beperking’ gold voor suspect of abnormaal neurologisch functioneren zonder functionele gevolgen (GMFCS graad I) of een cognitieve score van 70-84 (< -1,0 SD)
De werkgroep heeft besloten om de inmiddels verkregen Nederlandse data over mortaliteit en de lange termijn follow-up mee te nemen bij de overwegingen van deze module gezien het belang ervan. Deze studies konden nog niet meegenomen worden in de literatuurstudie voor deze richtlijn omdat ze toen nog niet verschenen waren. Het betreft resultaten van de EPI-DAF studie (Extremely Preterm Infants - Dutch Analysis on Follow-up); een studie die data heeft verzameld over álle in Nederland geboren kinderen met een zwangerschapsduur < 27 weken, die in de jaren 2018, 2019 en 2020 voor follow-up op 2- en 5-jarige leeftijd op de polikliniek zijn geweest. Het proefschrift van Van Beek verscheen in mei 2022. Op de leeftijd van 2 jaar waren 651 van 991 levend geboren kinderen nog in leven (66%), hiervan was in 85% (554 kinderen) de uitkomst beschikbaar. Overleving zonder ernstige handicap (gedefinieerd als BSID-III-NL cognitieve score <70, CP (GMFCS 2-5) of ernstige visusstoornis of gehoorproblematiek), was 38%, 62% en 72% in kinderen die op de NICU opgenomen waren geweest bij 24, 25 en 26 weken resp. Resultaten op de leeftijd van 5 jaar volgen binnenkort. (van Beek, 2022) Tevens verscheen in samenwerking met de EPI-DAF studie groep recent een validatie studie van een predictie-model voor te vroeggeboren kinderen. (van Beek, 2021) Hierin werd gekeken naar overleving van kinderen geboren tussen 24+0 en 32+0 weken. De conclusie hiervan was dat 25% verschil in overleving verklaard kon worden door geslacht, geboortegewicht en zwangerschapsduur in dagen. Zo was de voorspelde gemiddelde overleving voor jongens geboren bij 24+0 weken 42% en voor meisjes geboren bij 24+0 weken 50%.
De vraag is wat men acceptabele percentages vindt qua overleving en qua overleving zonder handicaps. De literatuur geeft hierin wat handvatten waarin een grote spreiding blijkt: actieve opvang is geen optie als de overlevingskans <5% ligt en wordt afgeraden bij een overlevingskans van 5-10%. Actieve opvang zou moeten worden aanbevolen als kans op overleving zonder ernstige NDI (neuro-developmental impairment) >70-90% is, en actieve opvang zou standaard moeten zijn indien kans op overleving zonder NDI >90% is (Williams, 2020). Elders beschrijft men dat je altijd actieve opvang zou moeten adviseren indien het risico op overlijden kleiner dan 25% is OF als de kans op ernstige of potentieel ernstige NDI kleiner dan 25% is; wanneer het risico op overlijden of op ernstige NDI tussen 25 en 89% ligt, zouden ouders moeten kunnen kiezen tussen intensive care of op comfort gerichte zorg (Lemyre, 2016). De British Association of Perinatal Medicin beschouwt een risico op overlijden of ernstig beperkingen> 90% als grens om op comfort care gerichte zorg aan te bevelen; een risico op overlijden of ernstig beperkingen < 50% om actieve opvang aan te bevelen. In het gebied waarin de kans op sterfte of ernstige NDI tussen 50% en 90% ligt, zijn beide opties in hun ogen even respectvol. In Nederland was eerder 10% van de neonatologen en 26% van de gynaecologen bereid om vanaf 23+0 weken actief op te vangen en vond 90% dat ouders tot 26+0 weken mogen beslissen om voor op comfort gerichte zorg te kiezen (Geurtzen, 2019). Bij een recente landelijke inventarisatie onder Nederlandse zorgverleners bleek ongeveer een derde bereid te zijn om kinderen geboren bij een zwangerschapsduur van 23+0 weken actief op te vangen (Verweij, 2021).
Belangrijk is dat, ook al heeft een kind op 3 of 10 jaar geen “beperking”, gedefinieerd als CP, laag IQ, visus of gehoorprobleem, er toch zodanige problemen kunnen zijn bij een extreem vroeggeboren kinderen zoals gedragsproblemen, angststoornissen etc. die niet onder de definitie “beperking” vallen maar zeker als het kind ouder wordt voor steeds meer problemen kunnen gaan zorgen. We vinden het belangrijk dat dit met ouders wordt besproken (zie module 3). Buiten deze uitgangsvraag maar zeker relevant: steeds meer studies laten zien dat bij follow-up op lange termijn, tot in de volwassenleeftijd, er zorgen zijn over onder andere hogere bloeddruk, toename diabetes en kleinere longinhoud bij deze groep (Dance, 2020; Doyle, 2017; Haikerwal, 2019).
Gezien de hoge mortaliteit bij de kinderen geboren bij 23 weken in combinatie met het aantal kinderen dat zich zonder ernstige handicaps ontwikkelt bij deze zwangerschapsduur, en mede op basis van de eerste commentaarronde, werd uiteindelijk in een eerdere versie van deze richtlijn door de commissie besloten om aan ouders niet standaard vanaf 23+0 weken actieve opvang aan te bieden.
De zone van extreme vroeggeboorte werd gedefinieerd als een zwangerschapsduur vanaf 23+0 tot 26+0 weken. Binnen deze zone wordt het risico op slechte uitkomsten (overlijden of overleven met ernstige handicaps) ingeschat op basis van de zwangerschapsduur en de individuele factoren. Op basis van deze risico inschatting wordt of op comfort gerichte zorg aanbevolen, of worden beide opties (op comfort gerichte zorg en actieve opvang) als even respectvol beschouwd en volgt gedeelde besluitvorming met ouders.
Waarden en voorkeuren van ouders
De vraag is wat voor ouders acceptabele percentages t.a.v. overleving en risico op handicaps zijn. Dit zal voor iedereen anders zijn. Belangrijk is dat ouders betrouwbare informatie krijgen, met indien gewenst getallen/percentages, zodat zij samen met de zorgverleners een passende keuze kunnen maken. Het heeft de voorkeur om Nederlandse getallen/percentages te kunnen noemen. Voor de meeste mensen zal het lastig zijn om te kunnen overzien hoe een lange opname periode op de NICU eruitziet, en ook hoe de toekomst er uit zal zien met een kind met een lichte of ernstigere beperking. Veel extreem prematuren ervaren op meerdere vlakken van hun ontwikkeling tenminste lichte problematiek (onhandige motoriek, cognitief onder gemiddeld, lichte visus- of gehoorproblematiek, concentratie, en gedragsproblemen). Juist door de combinatie van al deze (lichte) problemen op de verschillende vlakken is het moeilijker interventies of hulp te bieden dan wanneer er ernstigere problemen op één ontwikkelingsgebied zijn.
Kosten (middelenbeslag)
Als actieve opvang aangeboden zou worden aan kinderen geboren bij een zwangerschapsduur 23+0 -24+0 weken, leidt dit tot hogere kosten voor de gezondheidszorg; niet alleen omdat deze groep kinderen langer op een NICU opgenomen zal liggen maar ook omdat deze groep (meer) gebruik zal maken van de gezondheidszorg en ondersteuning vanuit het sociale domein (zoals speciaal onderwijs, jeugdzorg en opvang). Dit is nu al een groot probleem in Nederland en dit zal alleen maar groter worden. Zie ook de module Organisatie van zorg en randvoorwaarden.
Haalbaarheid en implementatie
Op dit moment is er tekort aan ICN-verpleegkundigen. Bij een eventuele verschuiving van de ondergrens voor het aanbieden van actieve opvang van 24 naar 23 weken zal dit probleem potentieel groter worden omdat deze kinderen in het algemeen lang op de NICU opgenomen liggen. Daarnaast verdienen deze kinderen vanwege de grote kans op ontwikkelingsproblematiek langdurige follow-up op een multidisciplinaire polikliniek (kinderarts, kinderfysiotherapeut en kinderpsycholoog); op dit moment zijn er al onvoldoende middelen om hieraan te voldoen, laat staan als de groep extreem vroeggeboren kinderen nog groter wordt. Dit dient eerst aangepakt te worden voordat een verdere verschuiving van de ondergrens haalbaar is. Het verdient ook aandacht om het effect op de obstetrische capaciteit in kaart te brengen voor zowel prenatale counseling als voor de vaak daarop volgende opname. In verband met het te verwachten beslag op middelen en de huidige capaciteitsproblematiek en mogelijke juridische knelpunten in relatie tot de Wet afbreking zwangerschap, is besloten de ondergrens in Nederland voor het aanbieden van actieve opvang op 24+0 weken geschatte zwangerschapsduur te houden. Zie ook hiervoor de module Organisatie van zorg en randvoorwaarden.
Aanbevelingen - rationale
Op basis van bovenstaande gegevens, de ethische discussie tijdens de invitational conference, de eerste commentaarronde en de praktijk in de landen om ons heen, stelde de werkgroep voor om in Nederland een zone van extreme vroeggeboorte te definiëren vanaf een zwangerschapsduur van 23+0 tot 26+0 weken, en om binnen deze zone een risico inschatting op basis van individuele factoren te maken. Na een tweede commentaarronde is in overleg met de werkgroep en de besturen van de NVK en NVOG besloten dat er binnen de huidige capaciteit van de geboortezorg onvoldoende ruimte is om de groep 23+0 tot 24+0 op dit moment structureel actieve opvang aan te bieden. Daarom blijft de periode waarin aan ouders de keuze wordt gelaten tussen actieve opvang of op comfort gerichte zorg, gedefinieerd als een geschatte zwangerschapsduur tussen 24+0 en 26+0 weken. Binnen deze periode wordt, op basis van diverse factoren, een risico inschatting gemaakt. Bij extreem hoog risico op overlijden of handicap wordt op comfort gerichte zorg aanbevolen. In de andere gevallen wordt zowel actieve opvang als op comfort gerichte zorg als optie besproken.
Er is bij extreme vroeggeboorte sprake van een voorkeursgevoelig besluit waarbij met behulp van adequate counseling en gedeelde besluitvorming samen met ouders tot de juiste behandeling wordt gekomen die het best bij hen past.
Bovenstaande kan worden samengevat als:
Extreem hoog risico :
- De meeste foetussen bij een zwangerschapsduur van 23+0 – 23+6 weken
- Sommige foetussen bij een zwangerschapsduur van 24+0 – 24+6 weken met meerdere ongunstige individuele factoren
- In zeldzame gevallen foetussen met meerdere ongunstige individuele factoren bij een zwangerschapsduur van 25+0 – 25+6 weken
Hoog risico :
- Foetussen met meerdere gunstige individuele factoren bij een zwangerschapsduur van 23+0 – 23+6 weken
- De meeste foetussen bij een zwangerschapsduur van 24+0 – 24+6 weken
- Sommige foetussen met meerdere ongunstige individuele factoren bij een zwangerschapsduur van 25+0 – 25+6 weken
Matig-hoog risico :
- De meeste foetussen bij een zwangerschapsduur van 25+0 – 25+6 weken
- Sommige foetussen met meerdere gunstige individuele factoren bij een zwangerschapsduur van 24+0 – 24+6 weken
Ten eerste is het van belang om een inschatting te maken van de prognose voor het individuele kind op basis van de geschatte zwangerschapsduur. Deze inschatting wordt op basis van individuele factoren aangepast zoals weergegeven in figuur 1.5. De systematische literatuuranalyse laat zien dat een hoger geboortegewicht, een vrouwelijk geslacht en een éénling zwangerschap leiden tot een hogere kans op overleving. Etniciteit lijkt geen voorspellende factor te zijn voor overleving (zie figuur 1.4). Bespreek het beleid op basis van de inschatting van het risico op slechte uitkomsten. Zwangere vrouwen blijven overigens het recht houden om bij een zwangerschap < 26 weken actieve opvang te weigeren.
Onderbouwing
Achtergrond
Sinds het uitkomen van de richtlijn in 2010 is de ondergrens voor het aanbieden van actieve opvang naast op comfort gerichte zorg in Nederland 24 weken, tenzij er zwaarwegende factoren zijn hiervan af te zien. In omringende landen wordt een beleid gevoerd met een ondergrens lager dan 24 weken, waarbij daarnaast ook individuele factoren worden meegewogen. Onderzoek van een aantal (buitenlandse) centra laat zien dat de overlevingskansen voor deze groep kinderen steeds beter worden en de vraag is of Nederlands beleid hierbij aan moet sluiten.
Vanaf welke zwangerschapsduur actieve neonatologische opvang gerechtvaardigd is, hangt mede af van de prognose van extreem vroeggeboren kinderen. In deze module wordt een
literatuuronderzoek beschreven naar de prognose van kinderen geboren bij een zwangerschapsduur tussen de 22-26 weken, waarbij de groep van 26 weken is meegenomen ter vergelijking omdat deze groep meestal actief wordt opgevangen.
Bij het beantwoorden van de uitgangsvraag zal literatuur worden beschreven die gaat over de risico’s op sterfte en overleving en over beperkingen in de ontwikkeling en/of aanwezigheid van handicaps bij extreem vroeggeboren kinderen. Overleving zonder ernstige handicaps wordt als meest relevante en gewenste uitkomstmaat gezien. Percentages worden voor zover mogelijk per zwangerschapsduur (weken) gepresenteerd. Ook werd een invitational conference georganiseerd om de ethische discussie te voeren met betrekking tot de gevonden uitkomsten in relatie tot acceptabele overleving met/zonder handicaps.
Conclusies
PICO 1 Uitkomsten na bij extreme vroeggeboorte
Overleving
|
Zeer laag GRADE |
De bewijskracht voor de uitkomstmaat overleving is onzeker.
Het overlevingspercentage extreem vroeggeboren kinderen van het totaal aantal NICU opnames is:
|
Ontwikkelingsstoornis (tot 10 jaar)
|
Zeer laag GRADE |
De bewijskracht voor de uitkomstmaat ontwikkelingsstoornissen tot 10 jaar is onzeker.
Het percentage extreem vroeggeboren kinderen met milde of geen ontwikkelingsstoornissen tot 10 jaar van het totaal aantal overlevenden is ongeveer: 22 weken:62%; 23 weken: 58%; 24 weken: 67%; 25 weken: 77%.
Het percentage extreem vroeggeboren kinderen met matige ontwikkelingsstoornissen tot 10 jaar van het totaal aantal overlevenden is ongeveer: 22 weken: 21%; 23 weken: 23%; 24 weken: 16%; 25 weken: 12%.
Het percentage extreem vroeggeboren kinderen met ernstige ontwikkelingsstoornissen tot 10 jaar van het totaal aantal overlevenden is ongeveer: 22 weken: 17%; 23 weken: 19%; 24 weken: 17%; 25 weken: 11%.
Bronnen: (Ding, 2019) |
Matige beperking: een IQ/cognitie tussen 55-70, ambulante CP, visusproblematiek maar niet blind en gehoor problemen waarvoor hulpmiddelen; ernstige beperking: IQ/cognitie < 55, non ambulante CP, blind of doof.
PICO 2 – Individuele factoren bij extreme vroeggeboorte
Geboortegewicht
|
Redelijk GRADE |
Geboortegewicht is waarschijnlijk een voorspellende factor voor overleving bij extreem vroeggeboren kinderen: een hoger geboortegewicht is gerelateerd aan hogere overleving (OR 1.08 [95% CI: 1.06; 1.11] voor 100 g hoger geboortegewicht)
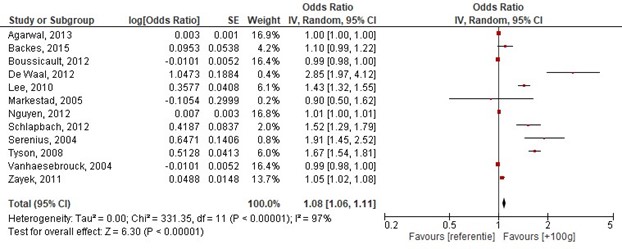
Bronnen: (Agarwal, 2013; Backes, 2015; Boussicault, 2012; De Waal, 2012; Lee, 2010; Markestad, 2005; Nguyen, 2012; Serenius, 2004; Schlapbach, 2012; Tyson, 2008; Vanhaesebrouck, 2004; Zayek, 2011) |
|
Zeer laag GRADE |
Op basis van de beschikbare evidentie is het onduidelijk of geboortegewicht een voorspellende factor is voor lange termijn uitkomsten bij extreem vroeggeboren kinderen.
Bronnen: (Schlapbach, 2012; Tyson, 2008; Vanhaesebrouck, 2004; Zayek, 2011) |
Geslacht
|
Redelijk GRADE |
Meisjes hebben hogere kans op overleven dan jongens (OR 1.29 [95% CI: 1.12; 1.49] voor overleven voor meisjes ten opzichte van jongens).
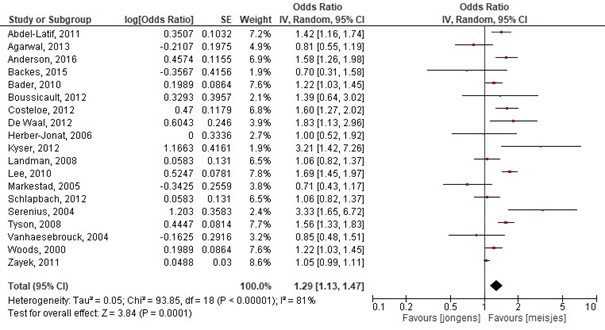
Bronnen: (Abdel-Latif, 2011; Agarwal, 2013; Anderson, 2016; Backes, 2015; Boussicault, 2012; Costeloe, 2012; De Waal, 2012; Herber-Jonat, 2006; Kyser, 2012; Landman, 2008; Lee, 2010; Markestad, 2005; Schlapbach, 2012; Serenius, 2004; Tyson, 2008; Vanhaesebrouck, 2004; Woods, 2000; Zayek, 2011; Bader, 2010) |
|
Zeer laag GRADE |
Op basis van de beschikbare evidentie is het onduidelijk of het geslacht een voorspellende factor is voor lange termijn uitkomsten bij extreem vroeggeboren kinderen.
Bronnen: (Schlapbach, 2012; Vanhaesebrouck, 2004; Woods, 2000; Zayek, 2011) |
Meerlingzwangerschap
|
Redelijk GRADE |
Een eenling heeft een hogere kans op overleven dan een kind van een meerling (OR 1.21 [95% CI: 1.05; 1.39] voor overleven voor eenling ten opzichte van meerling).
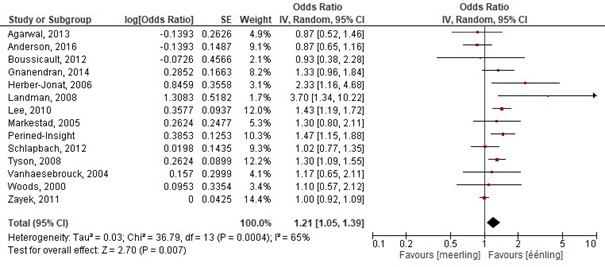
Bronnen: (Agarwal, 2013; Anderson, 2016; Boussicault, 2012; Gnanendran, 2014; Herber-Jonat, 2006; Landman, 2008; Lee, 2010; Markestad, 2005; Schlapbach, 2012; Tyson, 2008; Vanhaesebrouck, 2004; Zayek, 2011; Woods, 2000; Perined-Insight) |
|
Zeer laag GRADE |
Op basis van de beschikbare evidentie is het onduidelijk of meerlingzwangerschap een voorspellende factor is voor lange termijn uitkomsten bij extreem vroeggeboren kinderen.
Bronnen: (Schlapbach, 2012; Vanhaesebrouck, 2004; Zayek, 2011) |
Etniciteit
|
Laag GRADE |
Etniciteit lijkt geen voorspellende factor voor overleving bij extreem vroeggeboren kinderen.
Bronnen: (Anderson, 2016; De Waal, 2012; Serenius, 2008; Zayek, 2011) |
|
Laag GRADE |
Het is niet onderzocht of etniciteit een voorspellende factor is voor lange termijn uitkomsten bij extreem vroeggeboren kinderen.
Bronnen: (Anderson, 2016; De Waal, 2012; Serenius, 2008; Zayek, 2011) |
Samenvatting literatuur
PICO 1 - Uitkomsten na extreme vroeggeboorte
Voor het uitwerken van deze uitgangsvraag werden twee systematic reviews en één cohort studie geïncludeerd (Myrhaug, 2019; Ding, 2019; Helenius, 2017). De SR van Myrhaug (2019) includeert literatuur van 2000 tot maart 2017. Deze SR includeert cohortstudies die overleving en mate van ontwikkelingsstoornissen hebben gemeten met de BSID II of III op 18 en 36 maanden bij kinderen die geboren zijn tussen 22 en 27 weken. Om heterogeniteit te beperken zijn alleen studies uit hoog inkomenslanden geïncludeerd. De artikelen moesten beschikbaar zijn in het Engels, Duits, Frans of een Scandinavische taal. In totaal werden 65 studies geselecteerd. De meta-analyse is uitgevoerd voor overleving met artikelen met geboortes na 1998 en voor de ontwikkelingsstoornissen met artikelen met geboortes na 1994. Alleen artikelen met een laag risico op bias zijn geïncludeerd in de meta-analyse; 27 studies voor overleving (Ancel, 2015; Anderson, 2016; Berger, 2012; Bolisetty, 2015; Boussicault, 2012; Chen, 2016; Costeloe, 2012; De Waal, 2012; Doyle, 2010; Herber-Jonat, 2006; Ishii, 2013; Itabashi, 2009; Landmann, 2008; Lemyre, 2016; Malloy, 2015; Markestad, 2005; Rysavy, 2015; Schlapbach, 2012; Serenius, 2013; Serenius, 2016; Smith, 2017; Stensvold, 2017; Stichtenoth, 2012; Stoll, 2015; Vanhaesebrouck, 2004; Weber, 2005; Younge, 2017; Zayek, 2011) en 12 studies voor beperkingen/ontwikkeling (Kutz, 2009; Kyser, 2012; Morgillio, 2014; Poon, 2013; Rysavy, 2015; Schlapbach, 2012; Serenius, 2013, Serenius, 2016; Younge, 2017; Zayek, 2011). Overleving bij ontslag en op de leeftijd van 1 jaar en 6 jaar zijn gezamenlijk geanalyseerd. Overleving werd berekend als percentage van het (a) totaal aantal geborenen, (b) totaal aantal levendgeborenen en (c) totaal aantal pasgeborenen opgenomen op een NICU. In tabel 1.1 zijn de geïncludeerde studies voor zowel overleving als ontwikkelingsstoornissen weergegeven.
Tabel 1.1 Geïncludeerde studies SR Myrhaug (2019) voor overleving en ontwikkelingsstoornissen
|
Inclusie meta-analyse overleving |
Inclusie meta-analyse ontwikkelingsstoornissen |
|
Ancel et al 2015 |
Zayek et al 2011 |
|
Anderson et al 2016 |
Backes et al 2015 |
|
Berger et al 2012 |
De Groote et al 2007 |
|
Bolisetty et al 2015 |
Kutz et al 2009 |
|
Boussicault et al 2012 |
Kyser et al 2012 |
|
Chen et al 2016 |
Morgillio et al 2014 |
|
Costeloe et al 2012 |
Poon et al 2013 |
|
De Waal et al 2012 |
Rysavy et al 2015 |
|
Doyle et al 2010 |
Schlapbach et al 2012 |
|
Herber-Jonat et al 2006 |
Serenius et al 2013, |
|
Ishii et al 2013 |
Serenius et al 2016 |
|
Itabashi et al 2009 |
Younge et al 2017 |
|
Landmann et al 2008 |
Zayek et al 2011 |
|
Lemyre et al 2016 |
|
|
Malloy et al 2015 |
|
|
Markestad et al 2005 |
|
|
Rysavy et al 2015 |
|
|
Schlapbach et al 2012 |
|
|
Serenius et al 2013 |
|
|
Serenius et al 2016 |
|
|
Smith et al 2017 |
|
|
Stensvold et al 2017 |
|
|
Stichtenoth et al 2012 |
|
|
Stoll et al 2015 |
|
|
Vanhaesebrouck et al 2004 |
|
|
Weber et al 2005 |
|
|
Younge et al 2017 |
|
De SR van Ding (2019) is een update van een eerdere literatuurstudie van Moore uit 2013. Ding (2019) includeert literatuur van mei 2012 tot en met april 2018. Deze review includeert cohortstudies met een follow up van 4 tot en met 10 jaar bij kinderen die geboren zijn tussen 22 en 25 weken. Studies werden geïncludeerd als ze algemeen geaccepteerde classificatiesystemen en meetinstrumenten gebruikten om de ontwikkeling te meten bij kinderen geboren na 1995. Studies die een RCT beschreven werden geëxcludeerd. De artikelen mochten ook in een andere taal dan het Engels zijn gepubliceerd. In totaal werden 15 studies geïncludeerd; 6 nieuwe studies werden toegevoegd aan de oorspronkelijke studie van Moore (2013). In totaal beschrijven de studies ontwikkelingsscores bij 1697 kinderen met een leeftijd van 4 tot en met 10 jaar (Bickle-Graz, 2015; Herber-Jonat, 2014; Kuban, 2016; Larroque, 2008; Leversen, 2011; Marlow, 2005; Mikkola, 2005;
Roberts, 2010; Serenius, 2016; Stahlmann, 2009; Steinmacher, 2008; Takyanagi, 2013; Varendi, 2013; Oodward, 2009; Zlatohlávková, 2010). Tabel 1.2 geeft een overzicht van studies die werden geïncludeerd.
De cohortstudie van Helenius (2017) beschrijft overleving en leeftijd van overlijden van prematuren geboren tussen 24 en 29 weken die tussen 2007 en 2013 opgenomen zijn bij NICU’s die onderdeel uitmaken van het International Network for Evaluating Outcomes of Neonates. Deze studie werd niet opgenomen in de studies van Myrhaug (2019) en Ding (2019) omdat het een database onderzoek betreft uitgevoerd bij meerdere nationale onderzoekspopulaties van leeftijd tussen de 24 en 29 weken. De primaire uitkomstmaat was overleving bij ontslag van het ziekenhuis en/of transfer naar een lager niveau van ziekenhuis (indien mogelijk). De secundaire uitkomstmaat was leeftijd van overlijden. Een totaal van 91.835 pasgeborenen werd geïncludeerd in deze studie. Na exclusie van kinderen met een geboortegewicht > 1500 gram (n=3070) en kinderen die na 36 weken gecorrigeerde leeftijd op de NICU werden opgenomen (n=348) bestond de totale populatie uit 88.327 te vroeg geborenen.
Tabel 1.2 Geïncludeerde studies SR Ding (2019) voor ontwikkelingsstoornissen
|
Inclusie meta-analyse ontwikkelingsstoornissen |
|
Bickle-Graz et al 2015 |
|
Herber-Jonat et al 2014 |
|
Kuban et al 2016 |
|
Larroque et al 2008 |
|
Leversen et al 2011 |
|
Marlow et al 2005 |
|
Mikkola et al 2005 |
|
Roberts et al 2010 |
|
Serenius et al 2016 |
|
Stahlmann et al 2009 |
|
Steinmacher et al 2008 |
|
Takyanagi et al 2013 |
|
Varendi et al 2013 |
|
Woodward et al 2009 |
|
Zlatohlávková et al 2010 |
PICO 2 – Individuele factoren bij extreme vroeggeboorte
Voor het uitwerken van deze uitgangsvraag werden één systematic review en één cohort studie geïncludeerd (Myrhaug, 2019; Hafström, 2017). De SR van Myrhaug (2019) includeert literatuur van 2000 tot maart 2017. Deze SR includeert cohortstudies die overleving en mate van ontwikkelingsstoornissen hebben gemeten met de BSID II of III op 18 en 36 maanden bij kinderen die geboren zijn tussen 22 en 27 weken. Om heterogeniteit te beperken zijn alleen studies uit hoog inkomenslanden geïncludeerd. De artikelen moesten beschikbaar zijn in het Engels, Duits, Frans of een Scandinavische taal. In totaal werden 63 studies geselecteerd. De meta-analyse is uitgevoerd voor overleving met artikelen met geboortes na 1998 en voor de ontwikkelingsstoornissen met artikelen met geboortes na 1994. Alleen artikelen met een lage risk of bias zijn geïncludeerd in de meta-analyse; 27 studies voor overleving (Ancel, 2015; Anderson, 2016; Berger, 2012; Bolisetty, 2015; Boussicault, 2012; Chen, 2016; Costeloe, 2012; De Waal, 2012; Doyle, 2010; Herber-Jonat, 2006; Ishii, 2013; Itabashi, 2009; Landmann, 2008; Lemyre, 2016; Malloy, 2015; Markestad, 2005; Rysavy, 2015; Schlapbach, 2012; Serenius, 2013; Serenius, 2016; Smith, 2017; Stensvold, 2017; Stichtenoth, 2012; Stoll, 2015; Vanhaesebrouck, 2004; Weber, 2005; Younge, 2017; Zayek, 2011) en 12 studies voor beperkingen/ontwikkeling (Kutz, 2009; Kyser, 2012; Morgillio, 2014; Poon, 2013; Rysavy, 2015; Schlapbach, 2012; Serenius, 2013, Serenius, 2016; Younge, 2017; Zayek, 2011). Overleving bij ontslag, op de leeftijd van 1 jaar en 6 jaar zijn gezamenlijk geanalyseerd. In tabel 1.1 zijn de geïncludeerde studies voor overleving als ontwikkelingsstoornissen weergegeven.
Tenslotte werd de studie van Hafström (2017) geïncludeerd. Deze beschrijft een Zweeds cohort (EXPRESS study) en onderzocht de uitkomsten van kinderen geboren <27 weken tussen de verschillende geboorteweken. De studie van Hafström (2017) werd niet meegenomen in Myrhaug (2019) omdat de onderzoekspopulatie net verschilt. In de studie van Hafström (2017) werden extreem vroeggeboren kinderen <27 geïncludeerd waarbij de analyses voornamelijk gingen over kinderen met CP.
Resultaten
PICO 1 - Uitkomsten na extreme vroeggeboorte
1.1 OverlevingCijfers voor overleving zijn in twee SR’s onderzocht (Myrhaug, 2019; Helenius, 2017). Overleving werd berekend als percentage van het totaal aantal geborenen, het totaal aantal levendgeborenen en het totaal aantal pasgeborenen opgenomen op de NICU. Zie tabel 1.3 voor de verschillende percentages per week, het aantal studies en geboortes waarop de cijfers zijn gebaseerd.
Uit de SR van Myrhaug (2019) blijkt dat het overlevingspercentage hoger is bij kinderen die later geboren worden. Bij 22 weken is de overleving respectievelijk 0,1%, 7,3% en 24,1% voor het totaal aantal geborenen, het totaal aantal levendgeborenen en het aantal pasgeborenen opgenomen op de NICU. De overleving loopt op tot respectievelijk 63,7%, 84% en 84% bij geboortes bij 26 weken.
Uit de studie van Myrhaug (2019) blijkt dat geboortejaar geen modererend effect had op de uitkomsten. Tegelijkertijd zijn er wel verschillen tussen cohorten met name voor overleving onder 25 weken, wat de auteurs verklaren door verschillen in actieve opvang tussen de verschillende landen en kwaliteit van zorg. De hoogste overlevingscijfers kwamen van een NICU in de VS met 40% van de levendgeborenen bij 22 weken, 63% bij 23 weken en 81% bij 24 weken. Volgens de auteurs geeft dit aan wat mogelijk is onder ideale omstandigheden die zich kenmerkten door een proactief perinataal beleid, waaronder vroeg gebruik van corticosteroïden, keizersneden en actieve opvang voor levendgeborenen.
Tabel 1.3 Percentage overlevenden (Myrhaug, 2019)
|
weken |
Totaal geborenen1 |
Totaal levend geborenen2 |
Totaal NICU opnames3 |
|||
|
|
% (95%BI) |
n/N (studies) |
% (95%BI) |
n/N (studie) |
% (95%BI) |
n/N (studies) |
|
22 |
0,1 (0 - 37,1) |
6/948 (5) |
7,3 (3,9 - 13,1) |
486/4657 (23) |
24,1 (17,6 - 32) |
188/707 (16) |
|
23 |
9,0 (5,3 - 14,7) |
109/1102 (5) |
25,7 (20,3 - 31,9) |
2138/7746 (26) |
38,2 (31,0 - 45,9) |
1325/3421 (15) |
|
24 |
29,9 (23,0 - 39,9) |
401/1327 (5) |
53,9 (48,0 - 59,6) |
6093/11308 (21) |
59,7 (54,0 - 65,1) |
4087/6943 (17) |
|
25 |
50,7 (42,7 - 58,6) |
709/1401 (5) |
74,0 (68,7 - 78,6) |
7999/10885 (19) |
76,1 (70,8 - 80,7) |
4735/6288 (15) |
|
26 |
63,7 (56,4 - 70,4) |
710/1117 (4) |
84,0 (81,0 - 86,6) |
9907/11841 (17) |
84,0 (80,2 - 87,3) |
4144/4973 (11) |
n=aantal overlevenden, N=studiepopulatie; aantal studies staat tussen haakjes
1Het overlevingspercentage extreem vroeggeboren kinderen van het totaal aantal geborenen
2Het overlevingspercentage extreem vroeggeboren kinderen van het totaal aantal levendgeborenen 3Het overlevingspercentage extreem vroeggeboren kinderen van het totaal aantal NICU opnames
De studie van Helenius (2017) presenteert overlevingscijfers als percentage van het totaal aantal NICU opnames. Deze cijfers zijn vergelijkbaar met de resultaten die werden gevonden in de studie van Myrhaug (2019). In het cohort beschreven in Helenius (2017) werden kinderen geïncludeerd vanaf een zwangerschapsduur van 24 weken. Het overlevingspercentage van het totaal aantal NICU opnames was 64.1% bij 24 weken (5532/8631), 77.3% bij 25 weken (8593/1119) en 85.6% bij 26 weken (11810/13792).
1.2 Ontwikkelingsstoornissen
Ontwikkelingsstoornissen en beperkingen zijn onderzocht in twee SR’s (Myrhaug, 2019 en Ding, 2019) en een selectieve cohortstudie van Hafström (2017). De studie van Myrhaug (2019) heeft gekeken naar ontwikkelingsstoornissen en beperkingen tussen 18 en 36 maanden en de studie van Ding (2019) naar ontwikkelingsstoornissen en beperkingen tussen 4 en 10 jaar. Beide auteurs hebben de uitkomsten van de gebruikte meetinstrumenten vertaald naar een classificatie om de ernst van ontwikkelingsstoornissen of beperkingen weer te geven. De studie van Myrhaug (2019) beschrijft in het artikel niet welke definities gebruikt zijn voor de classificatie in de verschillende categorieën. Ook is onduidelijk of de verschillende categorieën complementair zijn of (deels) overlappend. Derhalve zijn deze data ons inziens niet te interpreteren en zijn deze uit de richtlijn gelaten (Myrhaug,2019). De studie van Ding (2019) heeft studies geïncludeerd die de definitie van de EPI-Cure studie hebben gebruikt voor de uitkomsten van ontwikkelingsstoornissen (waarbij ernstige beperking inhoudt: IQ/cognitie < 55, non ambulante CP, blind of doof en matige beperking een IQ/cognitie tussen 55-70, ambulante CP, visusproblematiek maar niet blind en gehoor problemen waarvoor hulpmiddelen). De studie van Hafström (2017) heeft gekeken naar de incidentie van CP en de mate van beperking bij kinderen met CP.
De SR van Ding (2019) heeft gekeken naar de prevalentie van matig tot ernstige beperkingen na extreme vroeggeboorte op latere leeftijd (tot 10 jaar). Deze review laat meer kans op matig tot ernstige beperkingen zien bij vroegere geboortes (zie tabel 1.4). Om het overzicht te behouden heeft de werkgroep tabel 1.4 ontwikkeld waarbij de kolom geen/milde beperking een afgeleide is van de getallen uit het oorspronkelijke artikel en de getallen representatief zijn voor de verdeling over 100%. Verdere analyse door Ding (2019) laat zien dat er een significante vermindering is van het aantal matig en ernstige beperkingen (bij elkaar opgeteld) van 8,1% per week.
Tabel 1.4 Percentage overlevenden met, a) matige beperkingen, b) matige-ernstige beperkingen en c) ernstige beperkingen op latere leeftijd (tot 10 jaar (Ding, 2019)
|
weken |
Geen/milde beperking |
Matige* beperking |
Ernstige** beperking |
|
22 |
62 |
21 (8-45) |
17 (6-37) |
|
23 |
58 |
23 (14-35) |
19 (14-25) |
|
24 |
67 |
16 (13-20) |
17 (13-22) |
|
25 |
77 |
12 (9-17) |
11 (8-15) |
*Matige beperking: een IQ/cognitie tussen 55-70, ambulante CP, visusproblematiek maar niet blind en gehoor problemen waarvoor hulpmiddelen; ** ernstige beperking: IQ/cognitie < 55, non ambulante CP, blind of doof
De cohortstudie van Hafström (2017) onderschrijft bovenstaande resultaten – meer problemen náást de Cerebrale Parese indien kinderen vroeger geboren zijn. De studie laat zien dat de incidentie van CP 10,5% is bij kinderen geboren tussen 22 en 26 weken. De ernst van de beperkingen verschilt tussen de groepen, waarbij kinderen met ernstigere beperkingen vroeger zijn geboren. In deze studie hadden 5/51 overlevende kinderen geboren bij op 22 weken geen CP. In totaal had 87% van de kinderen met CP die geboren waren tussen 23-24 weken een score van < -2SD op cognitie en ontwikkelingstesten, vergeleken met 50% van de kinderen met CP die tussen 25-26 weken werd geboren. Ook had de eerste groep (kinderen met CP geboren bij 23-24 weken) significant vaker een visuele beperking (47% versus 12%) dan de tweede groep (kinderen met CP geboren bij 25-26 weken). Bij de groep kinderen met CP geboren bij 25-26 weken was ook minder vaak sprake van comorbiditeit (naast de CP) in vergelijking met de groep kinderen met CP geboren bij 23-24 weken (7% versus 32%).
PICO 2 – Individuele factoren bij extreme vroeggeboorte
Geboortegewicht
In totaal werden 13 cohortonderzoeken geïncludeerd die het effect van het geboortegewicht op groepsniveau onderzochten in relatie tot de uitkomstmaat overleving (Agarwal, 2013; Backes, 2015; Boussicault, 2012; De Waal, 2012; Lee, 2010; Markestad, 2005; Nguyen, 2012; Serenius, 2004; Schlapbach, 2012; Tyson, 2008; Vanhaesebrouck, 2004; Zayek, 2011; Schlapbach, 2012).
Geboortegewicht was een significante voorspeller voor overleving. Samenvattend, uitgedrukt als OR op overleving per 100 gr geboortegewicht: OR: 1.08 (95%BI: 1.06 tot 1.11), dit betekent een statistisch significant hogere kans op overleving bij hoger geboortegewicht (per 100g) (zie figuur 1.1).
Figuur 1.1 Determinant: Geboortegewicht (+100g)
NOTE: Z: 6.29; p-waarde van het gepoolde effect =<0,001; df: 11 (vrijheidsgraden); I2: 97%; CI: 1.06-1.11
Het effect van geboortegewicht op de lange termijn uitkomsten bij extreme vroeggeboorte werd in 4 studies onderzocht (Schlapbach, 2012; Tyson, 2008; Vanhaesebrouck, 2004; Zayek, 2011) (tabel 1.5). Vanwege de heterogeniteit in gerapporteerde uitkomsten was het niet mogelijk om de resultaten van de studies te poolen. Schlapbach (2012), Vanhaesebrouck (2004) en Zayek (2011) laten geen significante OR’s zien, terwijl Tyson (2008) wel een significant effect laat zien van geboortegewicht op lange termijn uitkomsten bij extreme vroeggeboorte ten gunste van kinderen met een hoger geboortegewicht.
Tabel 1.5 Effect van geboortegewicht op lange termijn uitkomsten bij extreme vroeggeboorte
|
Geboortegewicht* |
|
|||||
|
Studie |
Weken |
N |
Uitkomst |
Unadjusted |
Adjusted |
|
|
Schlapbach, 2012* |
22-27 |
1266 |
Neuromotor disability 3 jaar |
OR 1.18 1.43) |
(0.96- |
n.s. |
|
Tyson, 2008 |
22-25 |
4446 |
Overleving zonder handicaps 18-22 maanden |
OR 1.64 1.79) |
(1.52- |
n.r. |
|
Vanhaesebrouck, 2004 |
22-26 |
525 |
Serious neuromorbiditiy 100 dagen |
OR 1.00 1.01) |
(1.00- |
n.r. |
|
Zayek, 2011 |
22-26 |
841 |
Severe neuromotor disability 24 maanden |
n.r. |
RR 1.00 (0.82-1.21)* |
|
NOTE: Schlapbach (2012) presenteert een gestandaardiseerde Z-score voor geboortegewicht. Zayek (2011) presenteert een gecorrigeerd relatief risico.
*Zayek (2011) presenteert een RR gecorrigeerd voor: zwangerschapsduur, geslacht, sectio caesarea, toediening steroïden, meerlingzwangerschap, geboorteland (Afro-Amerikaans), BPD, hoofdomtrek, witte hersenstof beschadiging.
Geslacht
In totaal werden 19 cohortonderzoeken geïncludeerd die de voorspellende waarde van het geslacht op groepsniveau onderzochten op de uitkomstmaten: overleving, neuro-motor disability en handicaps (Abdel-Latif, 2011; Agarwal, 2013; Anderson, 2016; Backes, 2015; Boussicault, 2012; Costeloe, 2012; De Waal, 2012; Herber-Jonat, 2006; Kyser, 2012; Landman, 2008; Lee, 2010;
Markestad, 2005; Schlapbach, 2012; Serenius, 2004; Tyson, 2008; Vanhaesebrouck, 2004; Woods, 2000; Zayek, 2011; Bader, 2010) . Geslacht was een significante voorspeller voor overleving, waarbij meisjes een betere uitkomst hebben dan jongens. De gepoolde OR= 1.33 (95%BI= 1.16 tot 1.54), dit betekent een statistisch significant hogere overleving voor meisjes (figuur 1.2) .
Figuur 1.2 Determinant: Geslacht
Z: 3.59; p-waarde van het gepoolde effect =<0,001; df: 17 (vrijheidsgraden); I2: 82%; CI: 1.12 tot 1.49
Het effect van geslacht op de lange termijn uitkomsten bij extreme vroeggeboorte werd in 3 studies onderzocht (Schlapbach, 2012; Vanhaesebrouck, 2004; Zayek, 2011) (tabel 1.6). Vanwege de heterogeniteit in gerapporteerde uitkomsten was het niet mogelijk om de resultaten van de studies te poolen. Schlapbach (2012), Vanhaesebrouck (2004) en Zayek (2011) laten geen significante verbanden zien. Woods (2000) laat wel een significante relatie zien van geslacht op ernstige motorische beperkingen (OR= 0.43; 95%BI= 0.19 tot 0.97) en cerebrale parese (OR= 0.82; 95%BI= 0.69 tot 0.97), ten gunste van het vrouwelijke geslacht.
Tabel 1.6 Effect van geslacht (meisje) op lange termijn uitkomsten bij extreme vroeggeboorte
|
Geslacht* |
|
|||||
|
Studie |
Weken |
N |
Uitkomst |
Unadjusted |
Adjusted |
|
|
Schlapbach, 2012* |
22-27 |
1266 |
Neuromotor disability 3 jaar |
OR 0.74 1.02) |
(0.54- |
OR 0.86 (0.61 -1.12) |
|
Vanhaesebrouck, 2004 |
22-26 |
525 |
Serious Neuromorbidity 100 dagen |
OR 1.08 2.22) |
(0.52- |
n.a. |
|
Zayek, 2011** |
22-26 |
841 |
Severe Neurodevelopmental impairment 24 maanden |
n.r. |
|
RR 0.99 (0.68-1.43)*
|
|
Woods, 2000 |
22-26 |
4004 |
Severe motor disability 30 maanden |
OR 0.43 0.97)
|
(0.19- |
n.r. |
|
|
|
|
Cerebrale parese |
OR 0.82 (0.69 – 0.97) |
n.r. |
|
* Schlapbach presenteert een OR gecorrigeerd voor: zwangerschapsduur, geboortegewicht, meerlingzwangerschap, hersenbeschadiging, PDA, BPD, ROP ≥3, NEC, sepsis, toediening steroïden, sociaaleconomische status
** Zayek (2011) presenteert een RR gecorrigeerd voor: zwangerschapsduur, geslacht, sectio caesarea, toediening steroïden, meerlingzwangerschap, geboorteland (Afro-Amerikaans), BPD, hoofdomtrek, witte hersenstof beschadiging
Meerlingzwangerschap
In totaal werden 14 cohortonderzoeken geïncludeerd die de voorspellende waarde van meerlingzwangerschap op groepsniveau onderzochten op de uitkomstmaten: overleving, neuromotor disability en handicaps (Agarwal, 2013; Anderson, 2016; Boussicault, 2012; Gnanendran, 2014; Herber-Jonat, 2006; Landman, 2008; Lee, 2010; Markestad, 2005; Schlapbach, 2012; Tyson, 2008; Vanhaesebrouck, 2004; Zayek, 2011; Woods, 2000; Perined-Insight). Eénlingzwangerschap was een significante voorspeller voor overleving. De kans op overleven is significant groter voor een eenling dan voor een meerling. De gepoolde OR: 1.21 (95%BI: 1.05 tot 1.39), dit betekent een statistisch significant hogere overleving bij een éénlingzwangerschap (figuur 1.3).
Figuur 1.3 Determinant: Meerlingzwangerschap
Z: 2.70; p-waarde van het gepoolde effect =<0,001; df: 13 (vrijheidsgraden); I2: 65%
Het effect van een meerlingzwangerschap op de lange termijn uitkomsten bij extreme vroeggeboorte werd in 3 studies onderzocht (Schlapbach, 2012; Tyson, 2008; Zayek, 2011) (tabel 1.7). Vanwege de heterogeniteit in gerapporteerde uitkomsten was het niet mogelijk om de resultaten van de studies te poolen. Schlapbach (2012) laat geen significante OR, terwijl Tyson (2008) en Zayek (2011) wel significante OR’s zien voor lange termijn uitkomsten, ten gunste van een éénling zwangerschap.
Tabel 1.7 Effect van meerlingzwangerschap op lange termijn uitkomsten bij extreme vroeggeboorte
|
Meerlingzwangerschap |
|
|
|
|
|
|
Studie |
Weken |
n |
Uitkomst |
Unadjusted |
Adjusted |
|
Schlapbach, 2012* |
22-27 |
1266 |
Neuromotor disability 3 jaar |
OR 1.11 (0.78- 1.58) |
OR 1.31 (0.88 – 1.96) |
|
Tyson, 2008 |
22-25 |
4446 |
Overleving zonder handicaps 18-22 maanden |
OR 1.43 (1.18- 1.72) |
n.a. |
|
Zayek, 2011** |
22-26 |
841 |
Severe Neurodevelopmental impairment 24 maanden |
n.r. |
RR 1.52 (1.00-2.27)
|
* Schlapbach presenteert een OR gecorrigeerd voor: zwangerschapsduur, geboortegewicht, geslacht, hersenbeschadiging, PDA, BPD, ROP ≥3, NEC, sepsis, toediening steroïden, sociaaleconomische status
** Zayek (2011) presenteert een RR gecorrigeerd voor: Zwangerschapsduur, geboortegewicht, geslacht, sectio caesarea, toediening steroïden, meerlingzwangerschap, geboorteland (Afro-Amerikaans), BPD, hoofdomtrek, witte hersenstof beschadiging
Etniciteit
In totaal werden 4 cohortonderzoeken geïncludeerd die de voorspellende waarde van etniciteit onderzocht op de overleving na extreme vroeggeboorte (22 tot 26 weken) (Anderson, 2016; De Waal, 2012; Serenius, 2008; Zayek, 2011). Etniciteit was geen significante voorspeller voor overleving. Samenvattend was de gepoolde OR voor overleving: 0.89 (95%CI 0.77; 1.03); dit betekent geen significant verschil in overleving tussen kinderen met een Kaukasische etniciteit versus nietKaukasische etniciteit (figuur 1.4). Het effect van etniciteit op de lange termijn uitkomsten bij extreme vroeggeboorte werd niet onderzocht.
Figuur 1.4 Determinant: Etniciteit
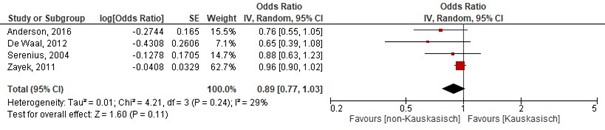
Z: 1.60; p-waarde van het gepoolde effect =0,11; df: 3 (vrijheidsgraden); I2: 29%;
Tabel 1.8 Descriptieve studiekarakteristieken.
|
Studie |
Country |
Year cohort |
N |
Zwangerschapsduur |
Corticosteroïden |
Factoren in multivariaat model |
|
Abdel-latif, 2011 |
Australië |
1997-2006 |
2529 |
< 28 weken |
88% |
- |
|
Agarwal, 2013 |
Singapore |
1999-2007 |
615 |
< 27 weken |
66% |
Zwangerschapsduur, geboortegewicht, geslacht, toediening steroïden, sectio caesarea, Apgar-score op 5 minuten ≤6, hypotensie, respiratoire distress, airleaks, IVH, NEC, sepsis |
|
Anderson, 2016 |
United States |
2007-2011 |
1454 |
< 28 weken |
94% |
- |
|
Backes, 2015 |
United States |
2004-2013 |
152 |
23 weken |
62% |
Foetale groei restrictie, NICU opname, verlengde intubatie/ beademing. |
|
Bader, 2010 |
|
1995-2006 |
3768 |
23-26 weken |
53% |
Zwangerschapsduur, geboortegewicht, meerlingzwangerschap, toediening steroïden, |
|
Binet, 2011 |
Canada |
2000-2005 |
2744 |
22-25 weken |
n.r. |
|
|
Boussicault, 2012 |
France |
2004-2005 |
444 |
22-26 weken |
63% |
Zwangerschapsduur, IVH III-IV, Postnatale overdracht naar NICU |
|
Costeloe, 2012 |
United Kingdom |
2006 |
2034 |
22-25 weken |
83% |
Zwangerschapsduur, geslacht, toediening steroïden, chorioamnionitis, vaginale geboorte, hartslag >100 op 5 minuten, temperatuur bij opname ≥35° |
|
De Waal, 2012 |
Netherlands |
2007 |
276 |
23-26+7 weken < 24 comfort care |
8-49% |
Zwangerschapsduur, geboortegewicht, geslacht, sectio caesarea, toediening steroïden, Nationaliteit Nederlands |
|
Gnanendran, 2015 |
Australië |
1998-2004 |
2701 |
<29 weken |
90% |
Zwangerschapsduur, geboortegewicht, geslacht, toediening steroïden, |
|
Herber- Jonat, 2006 |
Germany |
1999-2003 |
121 |
22-25 weken |
100% vanaf 23+5/7 |
Zwangerschapsduur, toediening steroïden |
|
Kyser, 2012 |
United States |
2000-2009 |
237 |
22-25 weken |
96% |
Zwangerschapsduur, geslacht, Apgar-score 1 minuut, toediening steroïden, geboortejaar |
|
Landman, 2008 |
Germany |
1998-2003 |
572 |
< 26 weken |
59% |
- |
|
Markestad, 2005 |
Norway |
1999-2000 |
464 |
22-27 weken |
94% |
Zwangerschapsduur, gescheurd membraan > 6 dagen, ziekte of zwangerschapscomplicatie |
|
Nguyen, 2012 |
United States |
2001-2010 |
126 |
23 weken |
52% |
Zwangerschapsduur, geboortegewicht, 5-min Apgar-score |
|
Schlapbach, 2012 |
Switzerland |
2000-2008 |
1266 |
24+0 – 27+0 weken |
69% |
Zwangerschapsduur, geboortegewicht, geslacht, meerlingzwangerschap, hersenbeschadiging, PDA, BPD, ROP ≥3, NEC, sepsis, toediening steroïden, sociaaleconomische status |
|
Serenius, 2013 |
Sweden |
2004-2007 |
707 |
< 27 weken |
68% |
Zwangerschapsduur, geboorteland van de moeder (Nordic/non-Nordic) en educatieniveau ouders |
|
Tyson, 2008 |
United States |
1998-2003 |
4446 |
22-25 weken |
97% |
Geboortegewicht, NICU opname, toediening steroïden, geslacht, meerlingzwangerschap |
|
Vanhaesebrouck, 2004 |
België |
1999-2000 |
322 |
< 27 weken |
n.r. |
Zwangerschapsduur, sectio caesarea, air leak syndroom, aantal dagen beademing, minimal Fio2 <12 h |
|
Woods, 2000 |
UK |
1998-1999 |
314 |
22-25 weken |
n.r. |
- |
|
Zayek, 2013 |
United States |
1998-2008 |
418 |
22-26+7 weken |
70% |
Zwangerschapsduur, geboortegewicht, geslacht, sectio caesarea, toediening steroïden, meerlingzwangerschap, geboorteland (Afro-Amerikaans), BPD, hoofdomtrek, witte hersenstof beschadiging |
Bewijskracht van de literatuur
PICO 1 - Uitkomsten na extreme vroeggeboorte
De bewijskracht van observationeel onderzoek start op LAAG.
- De bewijskracht van de literatuur voor de uitkomstmaat overleving werd met twee niveaus verlaagd vanwege het hoge risico op bias (geen correctie voor confounding) en de heterogene studiepopulaties. De bewijskracht is zeer laag.
- De bewijskracht van de literatuur voor de uitkomstmaat ontwikkelingsstoornis op 36 maanden werd met twee niveaus verlaagd vanwege het hoge risico op bias (geen correctie voor confounding) en de heterogene studiepopulaties. De bewijskracht is zeer laag.
- De bewijskracht van de literatuur voor de uitkomstmaat ontwikkelingsstoornis op 10 jaar werd met drie niveaus verlaagd vanwege het hoge risico op bias (geen correctie voor confounding) en de heterogene studiepopulaties. De bewijskracht is zeer laag.
PICO 2 – Individuele factoren bij extreme vroeggeboorte
De bewijskracht van de literatuur werd bepaald per determinant. De bewijskracht voor prognostische uitgangsvragen start op HOOG.
- De bewijskracht van de literatuur voor de voorspellende waarde van geboortegewicht op overleving is met één niveau verlaagd vanwege imprecisie (breed betrouwbaarheidsinterval doorkruist grens klinische relevantie). De bewijskracht is redelijk.
- De bewijskracht van de literatuur voor de voorspellende waarde van geboortegewicht op lange termijnuitkomsten is met drie niveaus verlaagd vanwege ernstige imprecisie en heterogeniteit (breed betrouwbaarheidsinterval doorkruist grens klinische relevantie). De bewijskracht is zeer laag.
- De bewijskracht van de literatuur voor de voorspellende waarde van geslacht op overleving is met één niveau verlaagd vanwege imprecisie (breed betrouwbaarheidsinterval doorkruist grens klinische relevantie). De bewijskracht is redelijk.
- De bewijskracht van de literatuur voor de voorspellende waarde van geslacht op lange termijnuitkomsten is met drie niveaus verlaagd vanwege ernstige imprecisie en heterogeniteit (breed betrouwbaarheidsinterval doorkruist grens klinische relevantie). De bewijskracht is zeer laag.
- De bewijskracht van de literatuur voor de voorspellende waarde van meerlingzwangerschap op overleving is met één niveau verlaagd vanwege imprecisie (breed betrouwbaarheidsinterval doorkruist grens klinische relevantie). De bewijskracht is redelijk.
- De bewijskracht van de literatuur voor de voorspellende waarde van meerlingzwangerschap op lange termijn uitkomsten is met drie niveaus verlaagd vanwege ernstige imprecisie en heterogeniteit (breed betrouwbaarheidsinterval doorkruist grens klinische relevantie). De bewijskracht is zeer laag.
- De bewijskracht van de literatuur voor de uitkomstmaat etniciteit op overleving is met twee niveau verlaagd vanwege imprecisie (breed betrouwbaarheidsinterval doorkruist grens klinische relevantie en grens van geen effect en kleine studie sample). De bewijskracht is laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende twee zoekvragen:
- Wat zijn de uitkomsten van actieve neonatologische opvang bij extreem vroeggeboren kinderen (22, 23, 24, 25, 26 weken)?
- Wat is de invloed van individuele factoren zoals geslacht, etniciteit, éénling en geboortegewicht op de uitkomst bij extreme vroeggeboorte?
Relevante uitkomstmaten
De werkgroep achtte overleving een voor de besluitvorming cruciale uitkomstmaat, evenals overleving zonder ernstige handicaps. Overleving is berekend als percentage van het (a) totaal aantal geborenen, (b) aantal levendgeborenen en (c) aantal geborenen opgenomen op een NICU.
Ontwikkelingsstoornissen zijn op basis van de originele studies geclassificeerd als ‘geen’, ‘milde’, ‘matige’, ‘matige-ernstige’ en ‘ernstige’ stoornissen, onder andere op basis van ontwikkelingstesten zoals de Bayley Scales of Infant Development (BSID).
PICO 1 - Uitkomsten na extreme vroeggeboorte
P: Extreem vroeggeboren kinderen (22, 23, 24, 25, 26 weken);
I: Actieve neonatologische opvang;
C: -
O: Overleving, Bayley Scales of Infant Development (BSID), cerebrale parese, blindheid, doofheid, cognitieve problemen en/of gedragsproblemen.
PICO 2 – Individuele factoren bij extreme vroeggeboorte
P: Extreem vroeggeboren kinderen (22, 23, 24, 25, 26 weken);
I: Individuele factoren: geslacht, etniciteit, gewicht, eenling;
C: -
O: Overleving, Bayley Scales of Infant Development (BSID, cerebrale parese, blindheid, doofheid, cognitieve problemen en/of gedragsproblemen, lange termijn uitkomsten.
Zoeken en selecteren (Methode)
PICO 1 - Uitkomsten na extreme vroeggeboorte
In de databases Medline (via OVID) en Embase (via Embase.com) is op 14 maart 2019 met relevante zoektermen gezocht naar studies over extreme prematuren en de geprioriteerde uitkomstmaten (zie PICO). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 869 treffers op en is in eerste instantie beperkt tot systematische reviews. Studies die geprioriteerde uitkomsten per zwangerschapsduur weergeven werden geselecteerd. Op basis van titel en abstract werden in eerste instantie 23 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 8 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en drie studies definitief geselecteerd. Omdat de reviews enkel mortaliteit en langere termijn morbiditeit rapporteerden zijn originele artikelen vanuit de reviews toegevoegd. Dit leverde in totaal 15 studies op.
PICO 2 – Individuele factoren bij extreme vroeggeboorte
In totaal worden 15 onderzoeken opgenomen in de literatuuranalyse. Twee studies beschrijven meta-analyses over de korte en lange termijn uitkomsten bij extreem vroeggeboren kinderen (Myrhaug, 2019; Ding, 2019). Twee studies betreffen cohortstudies, gepubliceerd na de searchdatum van de SR’s (Helenius, 2017; Hafstrom, 2017). De studie van Myrhaug (2019) beschrijft overleving bij extreem vroeggeboren kinderen. De studie van Ding (2019) beschrijft ontwikkelingsstoornissen op een leeftijd van 4 tot 10 jaar bij kinderen die werden geboren tussen de 22 en 25 weken. De belangrijkste studiekarakteristieken zijn opgenomen in de evidencetabellen en de beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de bijlagen.
Referenties
- Aarnoudse-Moens CSH, Rijken M, Swarte RM, Andriessen P, Ter Horst HJ, Mulder-de Tollenaer SM, Koopman-Esseboom C, Laarman ARC, Steiner K, van der Hoeven AHBM, Kornelisse RF, Duvekot JJ, Weisglas-Kuperus N. Follow-up na 2 jaar van kinderen geboren bij 24 weken [Two-year follow-up of infants born at 24 weeks gestation; first outcomes following implementation of the new 'Guideline for perinatal policy in cases of extreme prematurity']. Ned Tijdschr Geneeskd. 2017;161:D1168. Dutch. PMID: 28589868.
- Ancel PY, Goffinet F; EPIPAGE-2 Writing Group, Kuhn P, Langer B, Matis J, Hernandorena X, Chabanier P, Joly-Pedespan L, Lecomte B, Vendittelli F, Dreyfus M, Guillois B, Burguet A, Sagot P, Sizun J, Beuchée A, Rouget F, Favreau A, Saliba E, Bednarek N, Morville P, Thiriez G, Marpeau L, Marret S, Kayem G, Durrmeyer X, Granier M, Baud O, Jarreau PH, Mitanchez D, Boileau P, Boulot P, Cambonie G, Daudé H, Bédu A, Mons F, Fresson J, Vieux R, Alberge C, Arnaud C, Vayssière C, Truffert P, Pierrat V, Subtil D, D’Ercole C, Gire C, Simeoni U, Bongain A, Sentilhes L, Rozé JC, Gondry J, Leke A, Deiber M, Claris O, Picaud JC, Ego A, Debillon T, Poulichet A, Coliné E, Favre A, Fléchelles O, Samperiz S, Ramful D, Branger B, Benhammou V, Foix-L’Hélias L, Marchand-Martin L, Kaminski M. Survival and morbidity of preterm children born at 22 through 34 weeks’ gestation in France in 2011: results of the EPIPAGE-2 cohort study. JAMA Pediatr. 2015 Mar;169(3):230-8. Doi: 10.1001/jamapediatrics.2014.3351. Erratum in: JAMA Pediatr. 2015 Apr;169(4):323. Alberge, Catherine (Corrected to Alberge, Corine). PMID: 25621457.
- Anderson PJ, Burnett A. Assessing developmental delay in early childhood - concerns with the Bayley-III scales. Clin Neuropsychol. 2017 Feb;31(2):371-381. doi: 10.1080/13854046.2016.1216518. Epub 2016 Aug 12. PMID: 27687612.
- Bolisetty S, Legge N, Bajuk B, Lui K; New South Wales and the Australian Capital Territory Neonatal Intensive Care Units' Data Collection. Preterm infant outcomes in New South Wales and the Australian Capital Territory. J Paediatr Child Health. 2015 Jul;51(7):713-21. doi: 10.1111/jpc.12848. Epub 2015 Feb 3. PMID: 25644196.
- Boussicault G, Branger B, Savagner C, Rozé JC. Survie et devenir neurologique à l'âge corrigé de 2 ans des enfants nés extrêmement prématurés (Survival and neurologic outcomes after extremely preterm birth). Arch Pediatr. 2012 Apr;19(4):381-90. French. doi: 10.1016/j.arcped.2012.01.023. Epub 2012 Mar 15. PMID: 22425519.
- Costeloe KL, Hennessy EM, Haider S, Stacey F, Marlow N, Draper ES. Short term outcomes after extreme preterm birth in England: comparison of two birth cohorts in 1995 and 2006 (the EPICure studies). BMJ. 2012 Dec 4;345:e7976. doi: 10.1136/bmj.e7976. PMID: 23212881; PMCID: PMC3514472.
- Dance A. Survival of the littlest: the long-term impacts of being born extremely early. Nature. 2020 Jun;582(7810):20-23. doi: 10.1038/d41586-020-01517-z. PMID: 32488165.
- de Kluiver E, Offringa M, Walther FJ, Duvekot JJ, de Laat MW; Implementatiegroep Richtlijn Extreem Prematuren. Perinataal beleid bij extreme vroeggeboorte; een onderzoek naar de implementatie van de richtlijn [Perinatal policy in cases of extreme prematurity; an investigation into the implementation of the guidelines]. Ned Tijdschr Geneeskd. 2013;157(38):A6362. Dutch. PMID: 24050448.
- de Waal CG, Weisglas-Kuperus N, van Goudoever JB, Walther FJ; NeoNed Study Group; LNF Study Group. Mortality, neonatal morbidity and two year follow-up of extremely preterm infants born in The Netherlands in 2007. PLoS One. 2012;7(7):e41302. doi: 10.1371/journal.pone.0041302. Epub 2012 Jul 23. PMID: 22911776; PMCID: PMC3402477.
- Ding S, Lemyre B, Daboval T, Barrowman N, Moore GP. A meta-analysis of neurodevelopmental outcomes at 4-10 years in children born at 22-25 weeks gestation. Acta Paediatr. 2019 Jul;108(7):1237-1244. doi: 10.1111/apa.14693. Epub 2019 Jan 18. PMID: 30537197.
- Doyle LW, Carse E, Adams AM, Ranganathan S, Opie G, Cheong JLY; Victorian Infant Collaborative Study Group. Ventilation in Extremely Preterm Infants and Respiratory Function at 8 Years. N Engl J Med. 2017 Jul 27;377(4):329-337. doi: 10.1056/NEJMoa1700827. PMID: 28745986.
- Geurtzen R, van Heijst AFJ, Draaisma JMT, Kuijpers LJMK, Woiski M, Scheepers HCJ, van Kaam AH, Oudijk MA, Lafeber HN, Bax CJ, Koper JF, Duin LK, van der Hoeven MA, Kornelisse RF, Duvekot JJ, Andriessen P, van Runnard Heimel PJ, van der Heide-Jalving M, Bekker MN, Mulder-de Tollenaer SM, van Eyck J, Eshuis-Peters E, Graatsma M, Hermens RPMG, Hogeveen M. Development of Nationwide Recommendations to Support Prenatal Counseling in Extreme Prematurity. Pediatrics 2019 Jun;143(6).
- Hafström M, Källén K, Serenius F, Maršál K, Rehn E, Drake H, Ådén U, Farooqi A, Thorngren-Jerneck K, Strömberg B. Cerebral Palsy in Extremely Preterm Infants. Pediatrics. 2018 Jan;141(1):e20171433. doi: 10.1542/peds.2017-1433. Epub 2017 Dec 8. PMID: 29222398.
- Haikerwal A, Doyle LW, Cheung MM, Wark JD, Opie G, Roberts G, Patton G, Cheong JLY. High Blood Pressure in Young Adult Survivors Born Extremely Preterm or Extremely Low Birthweight in the Post Surfactant Era. Hypertension. 2020 Jan;75(1):211-217. doi: 10.1161/HYPERTENSIONAHA.119.13780. Epub 2019 Nov 18. PMID: 31735082.
- Helenius K, Sjörs G, Shah PS, Modi N, Reichman B, Morisaki N, Kusuda S, Lui K, Darlow BA, Bassler D, Håkansson S, Adams M, Vento M, Rusconi F, Isayama T, Lee SK, Lehtonen L; International Network for Evaluating Outcomes (iNeo) of Neonates. Survival in Very Preterm Infants: An International Comparison of 10 National Neonatal Networks. Pediatrics. 2017 Dec;140(6):e20171264. doi: 10.1542/peds.2017-1264. Epub 2017 Nov 21. PMID: 29162660.
- HerberHerber-Jonat S, Schulze A, Kribs A, Roth B, Lindner W, Pohlandt F. Survival and major neonatal complications in infants born between 22 0/7 and 24 6/7 weeks of gestation (1999-2003). Am J Obstet Gynecol. 2006 Jul;195(1):16-22. doi: 10.1016/j.ajog.2006.02.043. Epub 2006 May 5. PMID: 16678782.-Jonat et al 2006.
- Hintz SR, Kendrick DE, Stoll BJ, Vohr BR, Fanaroff AA, Donovan EF, Poole WK, Blakely ML, Wright L, Higgins R; NICHD Neonatal Research Network. Neurodevelopmental and growth outcomes of extremely low birth weight infants after necrotizing enterocolitis. Pediatrics. 2005 Mar;115(3):696-703. doi: 10.1542/peds.2004-0569. PMID: 15741374.
- Markestad T, Kaaresen PI, Rønnestad A, et al; Norwegian Extreme Prematurity Study Group. Early death, morbidity, and need of treatment among extremely premature infants. Pediatrics. 2005;115(5):1289–1298.
- Morgillo D, Morgillo-Mitchell J, Fontanta M, Steurer M, Schmitt-Mechelke T, Bauder F, Berger TM. Outcome of extremely low gestational age newborns (ELGANs) following a pro-active treatment approach: a Swiss single centre experience over 10 years. Swiss Med Wkly. 2014 Sep 25;144:w14014. doi: 10.4414/smw.2014.14014. PMID: 25255015.
- Myrhaug HT, Brurberg KG, Hov L, Markestad T. Survival and Impairment of Extremely Premature Infants: A Meta-analysis. Pediatrics. 2019 Feb;143(2):e20180933. doi: 10.1542/peds.2018-0933. PMID: 30705140.
- Stensvold HJ, Klingenberg C, Stoen R, Moster D, Braekke K, Guthe HJ, Astrup H, Rettedal S, Gronn M, Ronnestad AE; Norwegian Neonatal Network. Neonatal Morbidity and 1-Year Survival of Extremely Preterm Infants. Pediatrics. 2017 Mar;139(3):e20161821. doi: 10.1542/peds.2016-1821. Epub 2017 Feb 22. PMID: 28228499.
- Synnes A, Luu TM, Moddemann D, Church P, Lee D, Vincer M, Ballantyne M, Majnemer A, Creighton D, Yang J, Sauve R, Saigal S, Shah P, Lee SK; Canadian Neonatal Network and the Canadian Neonatal Follow-Up Network. Determinants of developmental outcomes in a very preterm Canadian cohort. Arch Dis Child Fetal Neonatal Ed. 2017 May;102(3):F235-F234. doi: 10.1136/archdischild-2016-311228. Epub 2016 Oct 6. PMID: 27758929.
- Tyson JE, Parikh NA, Langer J, Green C, Higgins RD; National Institute of Child Health and Human Development Neonatal Research Network. Intensive care for extreme prematuritymoving beyond gestational age. N Engl J Med. 2008 Apr 17;358(16):1672-81.
- van Beek PE, Groenendaal F, Broeders L, Dijk PH, Dijkman KP, van den Dungen FAM, van Heijst AFJ, van Hillegersberg JL, Kornelisse RF, Onland W, Schuerman FABA, van Westering-Kroon E, Witlox RSGM, Andriessen P. Survival and causes of death in extremely preterm infants in the Netherlands. Arch Dis Child Fetal Neonatal Ed. 2021 May;106(3):251-257. doi: 10.1136/archdischild-2020-318978. Epub 2020 Nov 6. PMID: 33158971; PMCID: PMC8070636.
- van Beek PE, Groenendaal F, Broeders L, Dijk PH, Dijkman KP, van den Dungen FAM, van Heijst AFJ, van Hillegersberg JL, Kornelisse RF, Onland W, Schuerman FABA, van Westering-Kroon E, Witlox RSGM, Andriessen P. Survival and causes of death in extremely preterm infants in the Netherlands. Arch Dis Child Fetal Neonatal Ed. 2020 Nov 6:fetalneonatal-2020-318978. doi: 10.1136/archdischild-2020-318978. Epub ahead of print. PMID: 33158971.
- van Beek PE, Groenendaal F, Onland W, Koole S, Dijk PH, Dijkman KP, van den Dungen F, van Heijst A, Kornelisse RF, Schuerman F, van Westering-Kroon E, Witlox R, Andriessen P, Schuit E; EPI-DAF study group. Prognostic model for predicting survival in very preterm infants: an external validation study. BJOG. 2021 Nov 15. doi: 10.1111/1471-0528.17010.
- van Beek PE, Andriessen P, Onland W, Schuit E. Prognostic Models Predicting Mortality in Preterm Infants: Systematic Review and Meta-analysis. Pediatrics. 2021 May;147(5):e2020020461. doi: 10.1542/peds.2020-020461. PMID: 33879518.
- van Beek PE, Rijken M, Broeders L, Ter Horst HJ, Koopman-Esseboom C, de Kort E, Laarman C, Mulder-de Tollenaer SM, Steiner K, Swarte RM, van Westering-Kroon E, Oei SG, Leemhuis AG, Andriessen P; EPI-DAF study group. Two-year neurodevelopmental outcome in children born extremely preterm: the EPI-DAF study. Arch Dis Child Fetal Neonatal Ed. 2022 Mar 2:fetalneonatal-2021-323124. doi: 10.1136/archdischild-2021-323124. Epub ahead of print. PMID: 35236745.
- Verweij EJ, de Proost L, Hogeveen M, Reiss IKM, Verhagen AAE, Geurtzen R. Dutch guidelines on care for extremely premature infants: Navigating between personalisation and standardization. Semin Perinatol. 2021 Nov 9;151532.Weber C, Weninger M, Klebermass K, Reiter G, Wiesinger-Eidenberger G, Brandauer M, Kraschl R, Lingitz K, Grassl-Jurek R, Sterniste W, Balluch B, Kolmer M, Bruckner R, Schweintzger G, Salzer H, Rath I, Kubitsch P, Zissler W, Müller W, Urlesberger B. Mortality and morbidity in extremely preterm infants (22 to 26 weeks of gestation): Austria 1999-2001. Wien Klin Wochenschr. 2005 Nov;117(21-22):740-6. doi: 10.1007/s00508-005-0468-y. PMID: 16416355.
- ref J Verweij n DOI: 10.1016/j.semperi.2021.151532
- Williams N, Synnes A, O'Brien C, Albersheim S. An alternative approach to developing guidelines for the management of an anticipated extremely preterm infant. J Perinat Med. 2020 Sep 25;48(7):751-756. doi: 10.1515/jpm-2019-0444. PMID: 32726290.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Myrhaug (2019)
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to August 2018
A. Ancel et al 2015 B. Anderson et al 2016 C. Berger et al 2012 D. Bolisetty et al 2015 E. Boussicault et al 2012 F. Chen et al 2016 G. Costeloe et al 2012 H. De Waal et al 2012 I. Doyle et al 2010 J. Herber-Jonat et al 2016 K. Ishii et al 2013 L. Itabashi et al 2009 M. Landmann et al 2008 N. Lemyre et al 2016 O. Malloy et al 2015 P. Markestad et al 2005 Q. Rysavy et al 2015 R. Schlapbach et al 2012 S. Serenius et al 2013,2016 T. Smith et al 2017 U. Stensvold et al 2017 V. Stichtenoth et al 2012 W. Stoll et al 2015 X. Vanhaesebrouck et al 2004 Y. Weber et al 2005 Z. Younge et al 2017 AA. Zayek et al 2011et al 2011 Study design: RCT
Setting and Country:
Source of funding and conflicts of interest: For the SR: the authors received no financial support for the research, authorship, and/or publication of this article. No source of funding reported for the individual included studies. |
Extrem preterm cohort studies: 22-26 weken. |
Describe intervention: Actieve treatment
|
Describe control: No control |
End-point of follow-up N.v.t.
|
Outcome measure-1: Overleving zonder beperking
Weken; zonder beperking 22; 6,3 (0,0 - 99,3) 22; 35,2 (16,6-59,9) 23; 37,5 (17,6 – 62,8) 24; 39,3 (27,4 – 52,5) 25; 54,6 (39,8 – 68,6) 26; 59,4 (46,6 - 71,0)
Weken; totaal 22; 1,2 (0,4 tot 3,7) 23; 4,5 (2,1 tot 9,6) 24; 9,3 (3,5 tot22,7) 25; 52,6 (35,7 tot 68,9) 26; 64,2 (49,8 tot 76,9)
Weken; Matig 22 21 ( 8-45) 23 23 (14-35) 24 16 (13-20) 25 12 ( 9-17)
Weken; BPD 22 65,7(22,2-100) 23 63,7(25-100) 24 55,8(31,8-79,7) 25 44,5(24,2-61,6) 26 38,0(12,8-60,7)
Weken; PVL 22 6,9 23 4,8(0-6,2) 24 3,8(0-13,8) 25 3,3(1,0-18,2) 26 3,7(2,2-12,8)
Weken; ROP 22 25,7 (27,6-33,3) 23 34,3 (17,1-55,6) 24 29,6 (4,5-43,8) 25 18,1(0-38,2) 26 9,3(1,9-26,8)
Weken IVH 22 37,9 23 14,4 (0-25) 24 15,9(0-38,5) 25 12,5(9,1-27) 26 9,4(3,9-24,2)
Weken; NEC 22 18,2(33,3-100) 23 11,7(0-18,5) 24 12,6(4,5-28,1) 25 8,2(0-11,3) 26 7,3(1,3-10,9)
|
Facultative:
Brief description of author’s conclusion
The prognosis for survival and survival without impairment, as assessed with the BSID, were markedly poorer for infants born at ,25 weeks’ GA than those born at $25 weeks’ GA. This threshold difference was probably related to variations in attitudes toward providing life support to the most immature infants because the variation between cohorts was particularly large at ,25 weeks’ GA. |
Tabel 2.1 Effect van geboortegewicht op overleving bij extreme vroeggeboorte
|
Geboortegewicht* |
||||
|
Studie |
Weken |
Uitkomst |
OR per 100 gram |
95% C.I. |
|
Agarwal, 2013 |
22-26 |
Overleving |
1.006 |
1.005-1.008 |
|
Backes, 2015 |
23 |
Overleving |
1.20 |
0.99-1.20 |
|
Bader, 2010 |
23-26 |
Overleving |
1.5 tot 3.1 |
NR |
|
Boussicault, 2012 |
22-26 |
Overleving |
0.99 |
0.99-1.00 |
|
De Waal, 2012 |
23-26 |
Overleving |
2.85 |
1.97-4.12 |
|
Lee, 2010 |
22-25 |
Overleving |
1.43 |
1.32- 1.54 |
|
Markestad, 2005 |
22-27 |
Overleving |
0.90 |
0.50-1.60 |
|
Schlapbach, 2012 |
22-27 |
Overleving |
1.52 |
1.29-1.79 |
|
Landman, 2008 |
22-25 |
Overleving |
0.93 |
0.1-8.63 |
|
Nguyen, 2012 |
23 |
Overleving |
1.007 |
1.001-1.013 |
|
Serenius, 2004 |
23-25 |
Overleving |
1.91 |
1.45-2.51 |
|
Tyson, 2008 |
22-25 |
Overleving |
1.67 |
1.54-1.81 |
|
Vanhaesebrouck, 2004 |
22-26 |
Overleving |
0.99 |
0.99-1.00 |
|
Zayek, 2011 |
22-26 |
Overleving |
1.05 |
1.02-1.08 |
* OR’s voor geboortegewicht zijn gecorrigeerd in multivariable model, correcties verschillen tussen de studies
Tabel 2.3 Effect van geboortegewicht op lange termijn uitkomsten bij extreme vroeggeboorte
|
Geboortegewicht* |
||||
|
Studie |
Weken |
Uitkomst |
OR |
95% C.I. |
|
Schlapbach, 2012 |
22-27 |
Neuromotor disablitiy |
1.18 |
0.96-1.43 |
|
Tyson, 2008 |
22-25 |
Overleving zonder handicaps |
1.64 |
1.52-1.79 |
|
Vanhaesebrouck, 2004 |
22-26 |
Serious neuromorbiditiy |
1.00 |
1.00-1.01 |
|
Zayek, 2011 |
22-26 |
Severe neuromotor disability |
1.00 |
0.82-1.21 |
* OR’s voor geboortegewicht zijn gecorrigeerd in multivariable model, correcties en uitkomstmaten verschillen tussen de studies
Tabel 2.4 Effect van geslacht op overleving bij extreme vroeggeboorte
|
Geslacht* |
||||
|
Studie |
Weken |
Uitkomst |
OR, meisjes |
95% C.I. |
|
Abdel-Latif, 2011 |
22-26 |
Overleving |
1.42 |
1.16-1.74 |
|
Agarwal, 2013 |
22-26 |
Overleving |
0.81 |
0.55-1.19 |
|
Anderson, 2016 |
22-24 |
Overleving |
1.58 |
1.26-1.98 |
|
Backes, 2015 |
23 |
Overleving |
0.70 |
0.31-1.58 |
|
Bader, 2010 |
22-25 |
Overleving |
1.22 |
1.03-1.45 |
|
Binet, 2012 |
24-26 |
Overleving 24 wk Overleving 25 wk Overleving 26 wk |
1.01 1.19 1.67 |
0.69-1.42 0.83-1.72 1.11-2.50 |
|
Boussicault, 2012 |
22-26 |
Overleving |
1.39 |
0.64-3.01 |
|
Costeloe, 2012 |
22-25 |
Overleving |
1.60 |
1.27-2.02 |
|
De Waal, 2012 |
23-26 |
Overleving |
1.83 |
1.13-2.95 |
|
Herber-Jonat, 2006 |
22-26 |
Overleving |
1.00 |
0.52-1.92 |
|
Kyser, 2012 |
22-25 |
Overleving |
3.21 |
1.42-7.26 |
|
Landman, 2008 |
22-25 |
Overleving |
1.06 |
0.47-2.44 |
|
Lee, 2010 |
22-25 |
Overelving |
1.69 |
1.45-1.97 |
|
Markestad, 2005 |
22-27 |
Overleving |
0.71 |
0.43-1.17 |
|
Schlapbach, 2012 |
22-27 |
Overleving |
1.06 |
0.82-1.37 |
|
Serenius, 2004 |
23-25 |
Overleving |
3.33 |
1.65-6.72 |
|
Tyson, 2008 |
22-25 |
Overleving |
1.56 |
1.33-1.83 |
|
Vanhaesebrouck, 2004 |
22-26 |
Overleving |
0.85 |
0.48-1.51 |
|
Zayek, 2011 |
22-26 |
Overleving |
1.05 |
0.99-1.11 |
* OR’s voor geslacht zijn gecorrigeerd in multivariable model, correcties verschillen tussen de studies
Tabel 2.6 Effect van geslacht op lange termijn uitkomsten bij extreme vroeggeboorte
|
Geslacht* |
||||
|
Studie |
Weken |
Uitkomst |
OR, meisjes |
95% C.I. |
|
Schlapbach, 2012 |
22-27 |
Neuromotor disability (18-24mnd) |
0.74 |
0.54-1.02 |
|
Vanhaesebrouck, 2004 |
22-26 |
Serious Neuromorbidity |
1.08 |
0.52-2.22 |
|
Zayek, 2011 |
22-26 |
Severe Neurodevelopmental impairment |
0.99 |
0.68-1.43
|
|
Woods, 2000 |
22-26 |
Severe motor disability |
0.43
|
0.19-0.97 |
|
|
|
CP |
1.22 |
1.03-1.45 |
* OR’s voor geslacht zijn gecorrigeerd in multivariable model, correcties en uitkomstmaten verschillen tussen de studies
Tabel 2.7 Effect van meerlingzwangerschap op overleving bij extreme vroeggeboorte
|
Meerlingzwangerschap |
||||
|
Studie |
Weken |
Uitkomst |
OR, éénling |
95% C.I. |
|
Agarwal, 2013 |
22-26 |
Overleving |
0.87 |
0.52-1.46 |
|
Anderson, 2016 |
22-24 |
Overleving |
0.87 |
0.65-1.16 |
|
Boussicault, 2012 |
22-26 |
Overleving |
0.93 |
0.38-2.28 |
|
Gnanendran, 2014 |
22-26 |
Overleving |
1.33 |
0.96-1.84 |
|
Herber-Jonat, 2006 |
22-26 |
Overleving |
2.33 |
1.16-4.68 |
|
Landman, 2008 |
22-25 |
Overleving |
3.7 |
1.34-10.26 |
|
Lee, 2010 |
22-25 |
Overelving |
1.43 |
1.19-1.69 |
|
Markestad, 2005 |
22-27 |
Overleving |
1.3 |
0.8-2.11 |
|
Schlapbach, 2012 |
22-27 |
Overleving |
1.02 |
0.77-1.35 |
|
Tyson, 2008 |
22-25 |
Overleving |
1.30 |
1.09-1.55 |
|
Vanhaesebrouck, 2004 |
22-26 |
Overleving, |
1.17 |
0.65-2.11 |
|
Zayek, 2011 |
22-26 |
Overleving |
1.00 |
0.92-1.08 |
|
Woods, 2000 |
22-26 |
Overleving |
1.10 |
0.57-2.12 |
|
Bader, 2010 |
22-25 |
Overleving |
1.4 |
NR |
|
Perined-Insight |
22-26 |
Overleving |
1.47 |
1.15-1.89 |
* OR’s voor pariteit zijn gecorrigeerd in multivariable model, correcties verschillen tussen de studies
Tabel 2.8 Effect van etniciteit po overleving bij extreme vroeggeboorte
|
Etnicity |
||||
|
Studie |
Weken |
Uitkomst |
OR, Kaukasisch |
95% C.I. |
|
Anderson, 2016 |
22-24 |
Overleving |
0.76 |
0.55-1.05 |
|
De Waal, 2012 |
23-26 |
Overleving |
0.65 |
0.39-1.08 |
|
Serenius, 2008 |
22-25 |
Overleving |
0.88 |
0.63-1.23 |
|
Tyson, 2008 |
22-25 |
Overleving |
- |
NS |
|
Zayek, 2011 |
22-26 |
Overleving |
0.96 |
0.90-1.02 |
Tabel 3.1 Effect van meerlingzwangerschap op lange termijn uitkomsten bij extreme vroeggeboorte
|
Meerlingzwangerschap |
||||
|
Studie |
Weken |
Uitkomst |
OR, éénling |
95% C.I. |
|
Schlapbach, 2012 |
22-27 |
Neuromotor disability (18-24mnd) |
1.11 |
0.78-1.58 |
|
Tyson, 2008 |
22-25 |
Overleving zonder handicaps |
1.43 |
1.18-1.72 |
|
Zayek, 2011 |
22-26 |
Severe Neurodevelopmental impairment |
1.52 |
1.00-2.27
|
* OR’s voor pariteit zijn gecorrigeerd in multivariable model, correcties en uitkomstmaten verschillen tussen de studies
Exclusie na het lezen van het volledige artikel.
|
Auteur en jaartal |
Redenen van exclusie |
|
Ireland, 2015 |
Narrative Review |
|
Moore, 2013 |
Komt niet overeen met de PICO |
|
Johnson, 2017 |
Komt niet overeen met de PICO: CP per AD |
|
Helenius, 2017 |
Narrative review survival |
|
Schlapbach, 2012 |
Komt niet overeen met de PICO: 24-27 weken |
|
Anderson, 2008 |
Komt niet overeen met de PICO: <26 weken en <750g |
|
Jonsdottir, 2012 |
Komt niet overeen met de PICO: <1000g |
|
Lorenz, 2012 |
Opgenomen in SR Myrhaug |
|
D'Onofrio, 2013 |
Narrative review |
|
Schulzke, 2007 |
Komt niet overeen met PICO: invloed NEC op uitkomsten |
|
van Vliet, 2013 |
Komt niet overeen met PICO: invloed sepsis op uitkomsten |
|
Fledelius, 2004 |
Komt niet overeen met PICO: invloed ROP op uitkomsten |
|
Malloy, 2008 |
Komt niet overeen met PICO: vaginal versus sectio |
|
Bonamy, 2013 |
Komt niet overeen met PICO: invloed ROP op uitkomsten |
|
Isaza, 2013 |
Effect van AD op ROP |
|
Randolph, 2014 |
Komt niet overeen met PICO: stopcriteria |
|
Malloy, 2008 |
Opgenomen in SR Myrhaug |
|
Kimura, 2017 |
Alleen groepsgemiddelden niet per week |
|
Tan, 2015 |
Percentage RoP per AD |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 07-02-2024
Laatst geautoriseerd : 07-02-2024
Geplande herbeoordeling : 01-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in (2017) een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom extreme vroeggeboorte.
Werkgroep
- Dr. M. (Monique) Rijken (voorzitter vanaf januari 2020), kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. A.F.J. (Arno) van Heijst (voorzitter tot december 2019), kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. M. (Marjon) de Boer, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dhr. S.P. (Bas) Bol, Verpleegkundig Specialist, Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Dr. J.J. (Hans) Duvekot, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. A. (Annemiek) Evers, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. M. (Marije) Hogeveen, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. J.J. (Joepe) Kaandorp, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. M.J.K. (Martin) de Kleine, Kinderarts n.p., Care4Neo
- Drs. K.E. (Karianne) Kraft, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. G.T.R. (Wendy) Manten, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Mw. F. (Farideh) Mostafai Alai, Physician Assistant / Klinisch Verloskundige, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV)
- Drs. M.E. (Mayke) van der Putten, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. M.M. (Martina) Porath, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
Klankbordgroep
- Dr. P. (Peter) Andriessen, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. A. (Annemieke) Bolte, gynaecoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. A.B.C. (Audrey) Coumans, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Drs. M. (Maureen) Franssen, gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Dr. F. (Floris) Groenendaal, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Mw. Marie-Josée de Haan – Gremmé MSc, klinisch Verloskundige, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV)
- Mw. Bianca Hekkink, ICN verpleegkundige, Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Dr. R. (Rene) Kornelisse, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. E.M. (Margo) Lutke Holzik (Graatsma), gynaecoloog-perinatoloog, Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Drs. S. (Susanne) Mulder-de Tollenaer, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Mw. Janine Pingen MSc, Stichting Kind en Ziekenhuis (SKZ)
- Drs. J.J. (Jeanine) Sol, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
- Dr. W.G. (Minke) van Tuijl, kinderarts-neonatoloog, Nederlandse Verenging voor Kindergeneeskunde (NVK)
Externe experts (betrokken in diverse fasen van de ontwikkeling van de richtlijn)
- Dr. R. (Rosa) Geurtzen, kinderarts, fellow neonatologie Radboud UMC – later toegevoegd aan de werkgroep
- Mw. I. (Ilona) Jochems, Care4Neo
- Mw. B. (Brenda) van Osch, journalist, schrijver ('Het onvoltooide kind')
- prof. dr. A.A.E. (Eduard) Verhagen, kinderarts, afdelingshoofd, UMCG
- Dr. A.E. (Anna) Westra, kinderarts, medisch ethicus namens de werkgroep ethiek in richtlijnen, Flevoziekenhuis
Met ondersteuning van
- Dr. J. (Janke) de Groot, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2019)
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2019)
- Mw. A.L.J. (Andrea) Kortlever - van der Spek MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. (Marjolein) de Weerd, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot augustus 2019)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mostafai Alai |
PA Klinisch verloskundige Werkgever: Admiraal De Ruyter ziekenhuis Goes" |
"lid van patiënten veiligheidscommissie. Bespreking en beoordeling van de calamiteiten in het ziekenhuis. Werkgever: Admiraal De Ruyter ziekenhuis Goes - lid van de commissie Veilig incident melden (VIM). Bespreking en beoordeling van de incidenten op de kraam/zwangere afdeling. werkgever: Admiraal De Ruyter Goes. - Lid van de commissie perinatale audit. Maken van de chronologische verslagen van de intrauteriene vrucht dood en andere calamiteiten, bespreking en beoordeling van de casussen. Werkgever: Admiraal De Ruyter ziekenhuis Goes." |
Geen |
Geen actie |
|
Bol |
Verpleegkundig Specialist. Neonatologie Erasmus MC -sophia, Rotterdam |
Bestuurslid VenVN VS - onbetaald |
Geen |
Geen actie |
|
Kraft |
Kinderartsneonatoloog UMCG |
Geen |
Geen |
Geen actie |
|
Manten |
Gynaecoloogperinatoloog, Afdeling gyneaecologie en obstetrie, Isala klinieken, Zwolle |
Geen |
Geen |
Geen actie |
|
Rijken |
Kinderarts neonatoloog Leids Universitair Medisch Centrum |
Voorzitter werkgroep Landelijke Neonatale Follow-up (multidisciplinaire werkgroep), bestaande uit hoofdzakelijk kinderartsen, kinderfysiotherapeuten en kinderpsychologen, die goede en gestructureerde nazorg van NICU patienten in Nederland als doel heeft)
-Vice-voorzitter lokale en regionale Perinatale Audit-team Leiden - Lid Verloskundig SamenwerkingsVerband (VSV) Leiden (buitengewoon bestuurslid) - Lid Nederlands- Vlaamse Werkgroep Neonatale Neurologie - Lid Projectgroep JGZrichtlijn Motorische Ontwikkeling (meelezen en beoordelen geleverde stukken) - Lid adviescommissie ontwikkelingsonderzoek Nederlands Centrum Jeugdgezondheidszorg (op persoonlijke titel; 3x per jaar vergadering - beoordeling vergaderstukken en meebeslissen hierover) |
Betrokken bij promotietraject EPI-DAF studie (Extremely Preterm Infants - Dutch Analysis on Follow-up). Recent gestarte studie vanuit MMC te Veldhoven, in samenwerking met de NICU's, LNF, N3 en Perined |
Geen actie |
|
Hogeveen |
Kinderartsneonatoloog |
Voorzitter WLAN/ N3 Aanbevelingen - Bestuurslid N3 -principal lecturer -associate professor
|
PreCo studie: framework keuzehulp; PreCo study = Prenatal counseling in extreme prematurity |
Geen actie |
|
Kleine de |
Kinderarts, gepensioneerd |
Bestuurslid Vereniging van Ouders van Couveusekinderen, onbetaald als bestuurslid Care4Neo een One time vendor agreement met Philips Design, betaald aan de Care4Neo. Medisch adviseur VEDUMA" |
De Care4Neo participeert in onderzoek. De vertegenwoordigers van Care4Neo participeren niet op persoonlijk basis of voor eigen rekening in onderzoek. |
Geen actie |
|
Duvekot |
GynaecoloogPerinatoloog |
Directeur Medisch Advies en Expertise Bureau Duvekot (betaald) kwaliteitsdocumenten (betaald) Voorzitter Adviescommissie Richtlijnen FMS (betaald) |
Geen |
Geen actie |
|
Boer |
GynaecoloogPerinatoloog, Amsterdam UMC, locatie VUMC |
Geen |
ZON-MW gesubsidieerd onderzoek naar vroeggeboorte. |
Geen actie |
|
Heijst van |
Kinderarts- Neonatoloog, Radboudumc, Nijmegen |
Geen |
Geen |
Geen actie |
|
Putten van der |
Kinderartsneonatoloog te MUMC |
NLS-instructeur (SSHK), onbetaald |
Geen |
Geen actie |
|
Porath |
Gynaecoloogperinatoloog Máxima Medisch Centrum te Eindhoven/Veldhoven |
"Lid NVOG werkgroep Otterlo, onbetaald Lid NVOG werkgroep Foetale Echoscopie, onbetaald Lid NVOG werkgroep Foeto-Maternale ziekte, onbetaald" |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door de afgevaardigde van de patiëntenvereniging in de werkgroep en door participatie van ouders van patiënten in de Invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deelnemers van de Invitational conference en de betrokken patiëntenvereniging. De aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntvertegenwoordigers van Care4Neo en Kind en Ziekenhuis hebben deelgenomen aan de knelpuntenanalyse, er heeft een vertegenwoordiger in de werkgroep gezeten die betrokken is geweest bij de module over samen beslissen. Beide organisaties waren onderdeel van de klankbord groep en hebben in die rol de richtlijn van commentaar voorzien en Care4Neo had een actieve rol in het ouderperspectief tijdens een extra ingelaste IC over ethische overwegingen bij deze richtlijn.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg rondom extreme vroeggeboorte. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en stakeholders via een Invitational conference. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review (SR) per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de
GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-todecision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; AlonsoCoello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADEmethodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur).
Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast. De wijzigingen werden voorgelegd aan de klankbordgroep. Vanwege het feit dat er buitengewoon veel wijzigingen zijn doorgevoerd werd een tweede commentaarronde uitgezet. De definitieve tekst werd na de tweede commentaarronde vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënten)organisaties voorgelegd voor autorisatie. Ook in deze vorm kon de richtlijn niet geaccordeerd worden door NVK en NVOG gezien de te verwachten capaciteits- en juridische problemen bij een ondergrens voor actieve opvang van 23 weken, nader besproken in het hoofdstuk ‘Organisatie van Zorg’ en de juridische paragraaf. Derhalve vond op 29 november 2022 een consultatie plaats van de richtlijnwerkgroep met de besturen van NVK en NVOG. In gezamenlijk overleg werd uiteindelijk besloten in deze richtlijn de ondergrens voor actieve opvang in Nederlandse ziekenhuizen te handhaven op 24 weken en dit ook als zodanig in deze richtlijn op te nemen.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.