Medicamenteuze behandeling van vermoeidheid bij MS
Uitgangsvraag
Wat is de optimale medicamenteuze behandeling van MS-gerelateerde vermoeidheid?
Aanbeveling
Zoek uit of er sprake is van primaire of secundaire vermoeidheid bij MS (zie module Diagnostiek van vermoeidheid).
Behandel primaire vermoeidheid door middel van conservatieve behandelmethoden (zie de module Niet-medicamenteuze behandeling van vermoeidheid).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Effecten op vermoeidheid
De bewijskracht voor de conclusies uit de literatuursamenvatting is laag tot zeer laag. Dit wordt veroorzaakt door de matige methodologische kwaliteit van de betreffende studies en het kleine aantal patiënten op wie de middelen getest zijn. Er is dan ook behoefte aan grote, kwalitatief goed opgezette RCT’s. Er lijkt een relevant gunstig effect te zijn op de cruciale uitkomstmaat vermoeidheid in bij patiënten met MS bij gebruik van alfacalcidol en retinyl palmitate. Ten aanzien van de studie met alfacalcidol moet opgemerkt worden dat in de placebo groep veel meer relapses (zelfs statistisch significant) voorkwamen dan in de behandelde groep. Relapsen gaan vaak gepaard met moeheid. Mogelijk wordt hierdoor het positieve effect van alfacalcidol wel overschat. Ten aanzien van retinyl palmitate merkt de werkgroep op dat volgens de opgestelde definitie van 0,5 SD weliswaar een klinisch relevant effect werd gevonden, maar dat het absolute verschil (2,7 punten op de modified fatigue impact scale) in de praktijk niet klinisch relevant is. Van de middelen acetyl-l-carnitine (positieve effecten gemeten), amantadine (tegenstrijdige effecten gemeten), en acetylsalicylzuur (geen effecten gemeten) is de werking onzeker. American ginseng en modafinil lijken geen effect te hebben op vermoeidheid bij patiënten met MS.
Hoewel wel gekwantificeerd door middel van een vragenlijst, is ernstige vermoeidheid niet altijd duidelijk gedefinieerd en is het niet altijd duidelijk of deze primair door MS wordt veroorzaakt of door secundaire oorzaken. Het is niet duidelijk wat de consequenties hiervan zijn ten aanzien van de getrokken conclusies.
Vanwege de zeer lage bewijskracht maakt de werkgroep in de overwegingen ook gebruik van expert opinion en resultaten uit observationele studies. Het is de ervaring van de werkgroep dat patiënten met MS een afname van vermoeidheid kunnen ervaren van alfacalcidol, amantadine, methylfenidaat en 4-aminopyridine. Het is niet uitgesloten dat een placebo-effect hier een rol kan spelen, of dat patienten zich vooral alerter voelen en een betere concentratie hebben.
- Alfacalcidol wordt in de dagelijkse praktijk weinig voorgeschreven. Wel hoort de werkgroep van patiënten die dit middel nemen op eigen initiatief terug dat zij een positief effect ervaren. Amantadine wordt wel regelmatig voorgeschreven. Van 25 tot 50% van de gebruikers hoort de werkgroep terug dat zij een positief effect ervaren op de afname van vermoeidheid bij gebruik van amantadine. Wel merkt de werkgroep op dat dit een placebo-effect zou kunnen zijn. Uit een recente na de searchdatum gepubliceerde analyse verricht naar het gebruik van amantadine, modafanil en methylfenidaat onder patienten bij MS met vermoeidheid, gepubliceerd in de Lancet Neurology (Nourbakhsh, 2021), blijkt dat er geen verschil is in effect op de ervaren vermoeidheid tussen amantadine en placebo.Methylfenidaat (Ritalin) lijkt bij een deel van de patiënten met MS een positief effect te hebben op vermoeidheid (ervaring van de werkgroep). Mensen geven aan zich alerter te voelen. Er is onderzoek gedaan bij mensen met de ziekte van Parkinson en bij mensen met licht traumatisch hersenletsel. Een cochrane review uit 2015 (Elbers, 2015) toonde geen bewijs voor de effectiviteit van dit middel bij mensen met Parkinson. Bij mensen met traumatisch hersenletsel werd in een niet vergelijkende studie (Johansson, 2017) en in een randomised controlled trial met herhaalde metingen (Johansson, 2014) gevonden dat methyfenidaat mogelijk een positief effect heeft op de ervaren vermoeidheid. Uit een recente, na de searchdatum gepubliceerde analyse verricht naar het gebruik van amantadine, modafanil en methylfenidaat onder patienten bij MS met vermoeidheid, gepubliceerd in de Lancet Neurology (Nourbakhsh, 2021), blijkt dat er geen verschil is in effect op de ervaren vermoeidheid tussen methylfenidaat en placebo.
- Recent werd fampridine beschikbaar voor patiënten met MS en loopstoornissen. Dit medicijn lijkt wat betreft de werking erg op 4-aminopyridine, maar heeft een langere afgifte van de werkzame stof. In observationele studies worden wisselende resultaten ten aanzien van het effect op vermoeidheid gerapporteerd (Allart, 2015; Bakirtzis, 2018; Korsen, 2017; Morrow, 2017; Rodriguez-Leal, 2019).
Bijwerkingen
De aanwezigheid van bijwerkingen bij het gebruik van bovengenoemde medicijnen is matig onderzocht. Ten aanzien van serieuze adverse events werd alleen in een studie met betrekking tot modafinil beschreven dat een aantal deelnemers zijn gestopt met de studie vanwege een niet nader beschreven adverse event. Ten aanzien van gerapporteerde bijwerkingen is het voor de middelen acetylsalicylzuur en modafinil onzeker of het gebruik van deze medictie effect heeft op bijwerkingen als misselijkheid. Voor alfacalcidol is het onzeker of deze hoofdpijn en duizeligheid veroorzaakt. In de studie die uit de search kwam werd zowel in de alfacalciferol groep als in de placebo een hoge incidentie van bijwerkingen beschreven (>10% hoofdpijn en duizeligheid). Dit in tegenstelling tot wat in het farmacotherapeutisch kompas vermeld staat bij alfacalciferol (0.1-1% en 0.01-0.1% respectievelijk). Aangezien er weinig ervaring is met het voorschrijven van alfacalciferol bij patienten met MS is het niet mogelijk om op basis van deze gegevens een oordeel te vormen over de incidentie van bijwerkingen bij Alfacalciferol. Voor de andere middelen konden geen conclusies getrokken worden over de aanwezigheid van bijwerkingen.
Ten aanzien van acetylsalicylzuur worden in het Farmacotherapeutisch Kompas (Zorginstituut Nederland, 2020) bijwerkingen als maag-darm stoornissen en bloedingen en huidreacties benoemd. Dit is een reden om dit middel niet laagdrempelig voor te schrijven.
Ten aanzien van amantadine is de ervaring van de werkgroep dat patiënten lichte bijwerkingen als droge mond en oedeem bij het gebruik kunnen ervaren. Naar mening van de werkgroep vallen de bijwerkingen van amantadine in de praktijk erg mee. Dit geldt ook voor medicatie die niet uit de literatuursamenvatting naar voren is gekomen, zoals methylfenidaat en 4-aminopyridine.
In het geval van mythylfenidaat worden volgens het farmacotherapeutisch Kompas (Zorginstituut Nederland (2020) zeer vaak hartkloppingen, verminderde eetlust, misselijkheid en nervositeit ervaren en vaak gedragsveranderingen gezien of worden patiënten te actief. Vanwege de veelgehoorde bijwerking slapeloosheid is het advies van de werkgroep om dit middel niet te laat in te nemen (niet meer na het begin van de middag).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Naar idee van de werkgroep zijn de belangrijkste doelen van de patiënt ten aanzien van de interventie gericht op meer energie hebben en minder vermoeid voelen. Patiënten met MS willen meer activiteiten op een dag kunnen ondernemen zoals (langer) werken, sporten, sociale activiteiten of meer participeren in het gezinsleven. Ook willen patiënten met MS niet overvallen worden door extreme vermoeidheid. Er zijn relatief weinig nadelen voor de patiënt aan het eventueel uitproberen van medicatie. Dit gezien het feit dat er relatief weinig bijwerkingen worden ervaren. De bestaande middelen worden goed verdragen. Ook is de inname eenvoudig, in tabletvorm. De frequentie van inname wisselt per soort geneesmiddel van 1x tot 3x per dag. Niet alle mensen zijn genegen (symptomatische) medicatie te gebruiken. Gezien de matige bewijslast heeft dat ook de voorkeur van de werkgroep. Een (substantiële) groep zal de voorkeur geven aan niet-medicamenteuze interventies.
Kosten (middelenbeslag)
De wetenschappelijke onderbouwing voor het voorschrijven van de medicatie is laag. Wel is de werkgroep van mening dat een patiënt bij positief effect een betere kwaliteit van leven kan ervaren, en/of meer kan doen in het dagelijks leven. Denk aan arbeidsparticipatie, zelfverzorging, en verzorging van bijvoorbeeld huis en familie. De kosten voor de medicatie zijn zeer laag en kunnen naar mening van de werkgroep verantwoord worden wanneer de patiënt positieve effecten van de medicatie ervaart.
Aanvaardbaarheid, haalbaarheid en implementatie
Bij de werkgroep zijn geen kwalitatieve of kwantitatieve trials naar de haalbaarheid van het gebruik van relevante medicaties bekend. Uit de in de literatuursamenvatting aangehaalde onderzoeken zijn echter geen grote problemen omtrent de haalbaarheid of aanvaardbaarheid van het gebruik van medicatie naar voren gekomen. De matig opgezette studies en het matige bewijs dat medicatie effectief zou kunnen zijn, zou aanleiding kunnen zijn voor collega’s of patiënten met MS om geen medicatie voor te schrijven/te gebruiken.
Mogelijk zullen sommige verzekeraars deze (off-label) medicatie niet vergoeden. Sommige patiënten met MS zoeken dan de beste verzekeraar uit en zullen zich beraden over een switch naar een andere verzekeraar. Er zijn geen direct belemmerende factoren voor de implementatie van het gebruik van medicatie. Wel zal er een uitleg bij de aanvang van het medicatiegebruik moeten komen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er is geen sterk bewijs voor de effectiviteit, of beter gezegd er is zelfs bewijs van inneffectiviteit, van medicatie tegen vermoeidheid. Uit de module Niet-medicamenteuze behandeling van vermoeidheid blijkt dat een niet-medicamenteuze behandeling effectief kan zijn. De werkgroep beveelt deze niet-medicamenteuze behandeling aan voor patiënten met vermoeidheid.
Op grond van de recent verschenen negatieve studie in de Lancet Neurology (Nourbakhsh, 2021) waarbij er een placebo gecontroleerde studie is gedaan naar de meest veelbelovende middelen (amantadine, modafanil en methylfenidaat) is de werkgroep van mening dat er onvoldoende grond is om medicatie voor te schrijven tegen vermoeidheid.
De ervaren positieve effecten die door patienten genoemd worden, zouden deels kunnen berusten op een placebo effect. Anderzijds zou het positieve effect voort kunnen komen uit een verbeterde alertheid of verbeterde concentratie.
De combinatie van door meerdere patiënten met MS ervaren positief effect, weinig bijwerkingen, en een lage kostprijs zou een reden kunnen zijn om medicatie op proef voor te schrijven. De werkgroep is van mening dat medicatie maximaal zes tot acht weken geprobeerd kan worden. Bij een ervaren positief effect van medicatiegebruik na zes tot acht weken, kan het gebruik worden voortgezet. Maak duidelijk aan de patiënt dat het een proefperiode betreft en dat er een evaluatie volgt en leg dat vast.
Indien een arts toch besluit tot het voorschrijven van alfacalcidol dient er rekening te worden gehouden met de bijwerkingen hoofdpijn en duizeligheid. Tevens dient bij het voorschrijven van alfacalcidol ook rekening te worden gehouden met de interacties. Let ook op de geadviseerde laboratoriumcontroles conform het Farmacotherapeutisch Kompas.
Ook bij acetyl-l-carnitine is het effect onzeker, maar hierbij is weinig bekend over de bijwerkingen. Er zijn geen ernstige bijwerkingen gerapporteerd. Daarom zou ook bij dit extra aandacht moeten worden gegeven aan bijwerkingen.
Voor middelen die niet in de literatuursamenvatting beschreven zijn (methylfenidaat of 4-aminopyridine), wordt niet gekozen deze voor te schrijven. Voor 4-aminopyridine geldt dat er nog geen RCT’s naar de effectiviteit beschikbaar is bij patiënten met MS. Voor methylfenidaat is er recent wel een RCT verricht die geen effectiviteit liet zien (deze studie is niet meegenomen in literatuuranalyse, omdat deze is gepubliceerd na de search datum (Nourbakhsh, 2021). Voor overige medicatie wordt niet gekozen, omdat uitgevoerde studies geen aanwijzingen geven dat deze medicatie zal zorgen voor een afname van vermoeidheid bij patiënten met MS.
Onderbouwing
Achtergrond
Rooney (2019) rapporteert dat 68,7% van de patiënten met MS aangeeft vermoeid te zijn (Fatigue Severity Scale > 5). Bij de behandeling van vermoeidheid bij MS is lange tijd gedacht dat deze mensen veel moeten rusten om energie te sparen en toename van vermoeidheid te voorkomen. De laatste jaren wordt er genuanceerder gedacht over de relatie tussen activiteiten en rust, en wordt er actief beleid ingezet om de vermoeidheid te verminderen of om er beter mee om te (leren) gaan. Naast conservatieve behandelmethoden (zie de module Niet-medicamenteuze behandeling van vermoeidheid) bestaat er ook de mogelijkheid om medicatie in te zetten.
We richten ons in deze module primair op medicamenteuze behandelopties voor primaire vermoeidheid. Bij primaire vermoeidheid is de vermoeidheid een directe consequentie van de pathofysiologische mechanismen van MS (Chaudhuri, 2004; MacAllister, 2005), terwijl bij secundaire vermoeidheid factoren als pijn, spierspasmen, infecties, zwangerschap, alcoholgebruik en depressie een rol spelen (Vucic, 2010). Helaas is het onderscheid tussen primaire en secundaire vermoeidheid in studies vaak niet zo duidelijk gemaakt.
Conclusies
Acetyl-l-carnitine versus placebo
1. Vermoeidheid (cruciale uitkomstmaat)
|
Zeer laag GRADE |
Het is onzeker of acetyl-l-carnitine een effect heeft op vermoeidheidsklachten bij patiënten met MS-gerelateerde vermoeidheid.
Bronnen: (Ledinek, 2013) |
2. Adverse events (belangrijke uitkomstmaat)
|
- GRADE |
Gezien de beperkte rapportage van de adverse events in de studie van Ledinek (2013) is het niet mogelijk om conclusies te trekken over het effect van Aaetyl-l-carnitine ten opzichte van placebo op het voorkomen van adverse events bij patiënten met MS-gerelateerde vermoeidheid. |
Alfacalcidol versus placebo
1. Vermoeidheid (cruciale uitkomstmaat)
|
Laag GRADE |
Alfacalcidol lijkt een gunstig effect te hebben op vermoeidheidsklachten van patiënten met MS-gerelateerde vermoeidheid.
Bronnen: (Achiron, 2015) |
2. Adverse events (belangrijke uitkomstmaat)
|
Zeer laag GRADE |
Het is onzeker of alfacalcidol leidt tot hoofpijn- en duizeligheidsklachten bij patiënten met MS gerelateerde vermoeidheid.
Bronnen: (Achiron, 2015) |
Amantadine versus placebo
1. Vermoeidheid (cruciale uitkomstmaat)
|
Zeer laag GRADE |
Het is onduidelijk of amantadine een (gunstig) effect heeft op vermoeidheidsklachten bij patiënten met MS-gerelateerde vermoeidheid.
Bronnen: (Ashtari, 2009; Ledinek, 2013) |
2. Adverse events (belangrijke uitkomstmaat)
|
- GRADE |
Gezien de beperkte rapportage van de adverse events in de studie van Ahstari (2009) en Ledinek (2013) is het niet mogelijk om conclusies te trekken over het effect van amantadine ten opzichte van placebo op het voorkomen van adverse events bij patiënten met MS-gerelateerde vermoeidheid. |
American ginseng versus placebo
1. Vermoeidheid (cruciale uitkomstmaat)
|
Laag GRADE |
American ginseng lijkt geen klinische relevant effect te hebben op vermoeidheidsklachten van patiënten met MS-gerelateerde vermoeidheid.
Bronnen: (Kim, 2011) |
2. Adverse events (belangrijke uitkomstmaat)
|
- GRADE |
Gezien de beperkte rapportage van de adverse events in de studie van Kim (2011) is het niet mogelijk om conclusies te trekken over het effect van American ginseng ten opzichte van placebo op het voorkomen van adverse events bij patiënten met MS-gerelateerde vermoeidheid. |
Acetylsalicylzuur versus placebo
1. Vermoeidheid (cruciale uitkomstmaat)
|
Zeer laag GRADE |
Het is onzeker of acetylsalicylzuur een effect heeft op vermoeidheidsklachten bij patiënten met MS-gerelateerde vermoeidheid.
Bronnen: (Wingerchuk, 2005) |
2. Adverse events (belangrijke uitkomstmaat)
|
Zeer laag GRADE |
Het is onzeker of acetylsalicylzuur leidt tot misselijkheid en/of epigastrische pijn bij patiënten met MS-gerelateerde vermoeidheid.
Bronnen: (Wingerchuk, 2005) |
Modafinil versus placebo
1. Vermoeidheid (cruciale uitkomstmaat)
|
Laag GRADE |
Modafinil lijkt geen klinisch relevant effect te hebben op vermoeidheidsklachten van patiënten met MS-gerelateerde vermoeidheid.
Bronnen: (Ledinek, 2013; Möller, 2011) |
2. Adverse events (belangrijke uitkomstmaat)
|
Zeer laag GRADE |
Het is onzeker of modafinil leidt tot bijwerkingen zoals misselijkheid en rusteloosheid bij patiënten met MS-gerelateerde vermoeidheid.
Bronnen: (Ledinek, 2013; Möller, 2011) |
Retinyl palmitate versus placebo
1. Vermoeidheid (cruciale uitkomstmaat)
|
Laag GRADE |
Retinyl palmitate lijkt een gunstig effect te hebben op vermoeidheid bij patiënten met MS.
Bronnen: (Bitafaran, 2016) |
2. Adverse events (belangrijke uitkomstmaat)
|
- GRADE |
Gezien het uitblijven van rapportage van de adverse events is het niet mogelijk om een conclusie te trekken over het effect van retinyl palmitate op adverse events. |
Samenvatting literatuur
De geselecteerde studies richtten zich op acetyl-l-carnitine (Ledinek, 2013), alfacalcidol (Achiron, 2015), amantadine (Ahstari, 2019; Ledinek, 2013), American ginseng (Kim, 2011), acetylsalicylzuur (Wingerchuk, 2005), modafinil (Ledinek, 2013; Möller, 2011) en retinyl palmitate (Bitafaran, 2016). De gevonden studies en hun resultaten worden hieronder per vergelijking beschreven.
Alle studies zijn RCT’s. Binnen deze studies werd MS gedefinieerd volgens de McDonald criteria, met uitzondering van Wingerchuk (2005). In deze studie werd de diagnose MS gesteld op basis van klinische symptomen of laboratorium uitslagen. MS-gerelateerde vermoeidheid werd gemeten met behulp van verschillende vragenlijsten. De Fatigue Severity Scale (FSS) werd gebruikt in 4 studies (Ashtari, 2009; Kim, 2011; Möller, 2011; Wingerchuk, 2005) en is een negen-item vragenlijst die het algemene effect van vermoeidheid op dagelijkse activiteiten meet. De totale score loopt van 9 (strongly disagree) tot 63 (strongly agree), welke ook wel wordt gepresenteerd als de gemiddelde score per vraag (lopend van 1 tot 7). De modified FSS (mFSS) is afgeleid van de FSS en bevat 7 items. Deze schaal werd aanvullend gebruikt door Möller (2011). De Fatigue Impact Scale (FIS) werd gebruikt door Achiron (2015) en is een 40-item vragenlijst die een behandeleffect op vermoeidheid meet. Het bevat de subschalen lichamelijke, cognitieve en sociale vermoeidheid. Elke vraag resulteert in een score van 0 tot 4, met een maximale totale score van 160. Hogere scores geven een hogere mate van vermoeidheid aan. De Modified Fatigue Impact scale (MFIS) is afgeleid van de FIS en werd door 6 studies (Achiron, 2015; Bitafaran, 2016; Kim, 2011; Ledinek, 2013; Möller, 2011; Wingerchuk, 2005) gebruikt en bestaat in totaal uit 21 items. De maximale score is hier 84. Een hogere score geeft een hogere mate van vermoeidheid aan. De Brief Fatigue Inventory (BFI) werd door Möller (2011) gebruikt en meet de verschillende aspecten van vermoeidheid en vermoeidheidsgerelateerde verslechtering. Een hogere score geeft een hogere mate van vermoeidheid aan. De MS-Specific Fatigue Scale (MS-FS) werd gebruikt door Wingerchuk (2005), maar werd verder niet gespecificeerd.
Acetyl-l-carnitine versus placebo
Beschrijving studies
Ledinek (2013) onderzocht het effect van één maand amantadine gebruik (200 milligram per dag), en één maand acetyl-l-carnitine (ALCAR) gebruik (2 gram per dag) en één maand modafinil gebruik (200 milligram per dag) ten opzichte van een placebobehandeling op vermoeidheid. Bij deze vergelijking beperken we ons tot de resultaten voor de ALCAR-groep (N=15; leeftijd in jaren: 35,6 ± 2,8; aantal vrouwen: 53,3%; EDSS: 2,8 ± 1,0) en de groep die placebo medicatie (N=15; leeftijd in jaren: 37,6 ± 6,3; aantal vrouwen: 46,6%; EDSS: 2,0 ± 1,1) ontving. Alleen patiënten met vermoeidheidsklachten (gedocumenteerd door MFIS, afkapwaarden niet gespecificeerd) werden geïncludeerd. Er waren enkele verschillen in de EDSS en MFIS-score tussen de behandelgroepen op baseline en ook is de wijze van randomisatie en blindering van de zorgverleners en onderzoekers die de vragenlijsten afnamen niet goed beschreven. Daarnaast is niet beschreven of de analyse volgens het intention to treat principe werd uitgevoerd.
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
Er werd door Ledinek (2013) geen significant verschil tussen de groepen gerapporteerd na behandeling. Analyses in RevMan, uitgevoerd door de werkgroep op basis van de gepubliceerde gemiddelden en betrouwbaarheidsintervallen, toonden wel een significant verschil in MFIS-waarden na één maand medicatiegebruik (gecorrigeerd voor leeftijd, geslacht en baseline MFIS-score, zie figuur 1). Het betrof een verschil in MFIS-score van -0,95 SD van de interventiegroep ten opzichte van de controlegroep en wordt door de werkgroep aangemerkt als klinisch relevant.
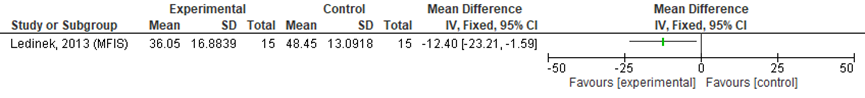
Figuur 1 MFIS (1 maand follow-up, gecorrigeerd voor leeftijd, geslacht en baseline MFISscore)
2. Adverse events (belangrijke uitkomstmaat)
Ledinek (2013) rapporteerde als meest voorkomend adverse event van acetyl-l-carnitine een milde vorm van insomnia. Overige adverse events die voorkwamen in de placebogroep werden niet gerapporteerd. Verschillen tussen de groepen werden niet getest.
Bewijskracht van de literatuur
RCT’s beginnen binnen GRADE bij een therapeutische vraag op een hoge bewijskracht.
De bewijskracht voor de uitkomstmaat vermoeidheid is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen blindering van zorgverleners/onderzoekers en mogelijk geen intention to treat analyse, 1 niveau) en het zeer geringe aantal patiënten (imprecisie, 2 niveaus). De uiteindelijke bewijskracht is zeer laag.
De bewijskracht voor de uitkomstmaat adverse events kon niet worden gegradeerd gezien de beperkte rapportage van de adverse events.
Alfacalcidol versus placebo
Beschrijving studies
Achiron (2015) onderzocht het effect van zes maanden alfacalcidol gebruik (1 mcg per dag) op vermoeidheid door een interventiegroep (N=80; leeftijd in jaren: 41,3 ± 9,8; aantal vrouwen: 73,8%; EDSS: 2,5 ± 1,6; duur vermoeidheid in jaren: 3,7 ± 3,7) met een groep te vergelijken die een placebomiddel (N=78; leeftijd in jaren: 40,8 ± 8,7; aantal vrouwen: 75,6%; EDSS: 2,8 ±1,6; duur vermoeidheid in jaren: 4,1 ± 3,8) ontving. Alleen patiënten met vermoeidheidsklachten werden geïncludeerd (inclusiecriterium: negende item FSS ≥ 3 en FIS≥ 40). De wijze van randomisatie en blindering van de onderzoekers die de vragenlijsten afnamen is niet goed beschreven en de zorgverleners waren niet geblindeerd. De studie werd gesponsord door TEVA Pharmaceuticals LtD, Israël. Twee van de auteurs waren in dienst bij dit bedrijf.
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
Achiron (2015) rapporteerde dat de gemiddelde afname in FIS-score statistisch significant (p=0,007) groter was in de patiëntengroep die alfacalcidol (-46,6%) gebruikte ten opzichte van de placebogroep (-27,4%). Dit gold ook voor de MFIS-score (-40,5% versus -25,1%, p=0,005). De studie rapporteerde geen ruwe scores, standaarddeviaties en/of betrouwbaarheidsintervallen voor de FIS en MFIS, waardoor de grootte van het verschil in score tussen de groepen niet als proportie van de standaarddeviatie bepaald kon worden. Daarom is de number needed to treat bepaald. De number needed to treat betreft hier 5 patiënten. Dit aantal werd wel klinisch relevant geacht.
2. Adverse events (belangrijke uitkomstmaat)
Achiron (2015) vond geen verschil in de frequentie van adverse events tussen de groepen. Er werden geen serieuze adverse events gerapporteerd. Wel rapporteerde de auteurs in 15,8% van de patiënten in de interventiegroep hoofdpijn- en duizeligheidsklachten. In de placebogroep rapporteerde 16,7% van de patiënten buikpijnklachten.
Bewijskracht van de literatuur
RCT’s beginnen binnen GRADE bij een therapeutische vraag op een hoge bewijskracht.
De bewijskracht voor de uitkomstmaat vermoeidheid is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen blindering van de onderzoekers en zorgverleners, 1 niveau) en het geringe aantal patiënten (imprecisie, 1 niveau). De uiteindelijke bewijskracht is laag.
De bewijskracht voor de uitkomstmaat adverse events is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen blindering van de onderzoekers en zorgverleners, mogelijke missing data door uitblijven dossier onderzoek, 2 niveaus) en het geringe aantal patiënten (imprecisie, 1 niveau). De uiteindelijke bewijskracht is zeer laag.
Amantadine versus placebo
Beschrijving studies
Ahstari (2009) onderzocht het effect van twee maanden amantadine gebruik (200 milligram per dag) op vermoeidheid door een interventiegroep (N=21; leeftijd in jaren: 26,1 ± 6,0; aantal vrouwen: 33,3%; EDSS: 2,1 ± 0,8; ziekteduur in jaren: 5,9 ± 2,3) met een groep te vergelijken die een placebomiddel (N=21; leeftijd in jaren: 24,9 ± 4,0; aantal vrouwen: 19%; EDSS: 3,0 ± 5,1; ziekteduur in jaren: 5,5 ± 2,1) ontving. Alleen patiënten met vermoeidheidsklachten werden geïncludeerd (inclusiecriterium: FSS ≥ 4,5). De wijze van randomisatie en blindering van de onderzoekers die de vragenlijsten afnamen is niet goed beschreven. Daarnaast werd niet beschreven of de analyse volgens het intention to treat principe werd uitgevoerd.
Ledinek (2013) onderzocht het effect van één maand amantadine gebruik (200 milligram per dag), en één maand acetyl-l-carnitine gebruik (2 gram per dag) en één maand modafinil gebruik (200 milligram per dag) ten opzichte van een placebobehandeling op vermoeidheid. Bij deze vergelijking beperken we ons tot de resultaten voor de amantadine groep (N=15; leeftijd in jaren: 40,7 ± 7,0; aantal vrouwen: 83,3%; EDSS: 2,5 ± 1,1) en die van de placebo medicatie (N=15; leeftijd in jaren: 37,6 ± 6,3; aantal vrouwen: 46,6%; EDSS: 2,0 ± 1,1) ontving. Alleen patiënten met vermoeidheidsklachten werden geïncludeerd (gedocumenteerd door MFIS, afkapwaarden niet gespecificeerd). Er waren enkele verschillen in de EDSS- en MFIS-score tussen de behandelgroepen op baseline. De wijze van randomisatie en blindering van de zorgverleners en onderzoekers die de vragenlijsten afnamen is niet goed beschreven. Daarnaast werd niet beschreven of de analyse volgens het intention to treat principe werd uitgevoerd.
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
Ahstari (2009) rapporteerde een statistisch significant verschil tussen de verschilscores (follow-up - baseline scores) van de groepen. Ledinek (2013) vond een significant verschil voor het voor leeftijd, geslacht en de baseline MFIS score gecorrigeerde verschil in MFIS score. Analyses in RevMan, uitgevoerd door de werkgroep op basis van gepubliceerde data, toonden geen significant verschil in vermoeidheids-verschilscores na één tot twee maanden medicatiegebruik (zie figuur 2, SMD (95%BI): -0.18 (-0.64 tot 0.28)).
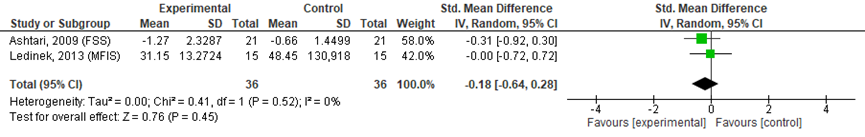
Figuur 2 FSS (verschil baseline en 2 maanden follow-up) & MFIS (1 maand follow-up, na correctie voor baseline MFIS score, leeftijd en geslacht)
2. Adverse events (belangrijke uitkomstmaat)
Ahstari (2009) rapporteerde dat 47% van de patiënten uit de interventiegroep last hadden gehad van een droge mond en 14% had last gehad van insomnia. Over de placebogroep werden geen uitspraken gedaan. Verschillen tussen de groepen werden niet getest.
Ledinek (2013) rapporteerde in 2 van de patiënten die amantadine gebruikten misselijkheid. Over de placebogroep werden geen uitspraken gedaan. Verschillen tussen de groepen werden niet getest.
Bewijskracht van de literatuur
RCT’s beginnen binnen GRADE bij een therapeutische vraag op een hoge bewijskracht.
De bewijskracht voor de uitkomstmaat vermoeidheid is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen blindering van zorgverleners/onderzoekers en mogelijk geen intention to treat analyse, 1 niveau), en het zeer geringe aantal patiënten (imprecisie, 2 niveaus). De uiteindelijke bewijskracht is zeer laag.
De bewijskracht voor de uitkomstmaat adverse events kon niet worden gegradeerd in verband met de beperkte rapportage van de resultaten.
American ginseng versus placebo
Beschrijving studies
Kim (2011) onderzocht het effect van zes weken American Ginseng extract gebruik (tot 400 milligram per dag) op MS-gerelateerde vermoeidheid door een interventiegroep te vergelijken met een groep die een placebomiddel ontving door middel van een cross-over design. De patiëntkarakteristieken werden alleen voor de gehele groep gerapporteerd: N=56; leeftijd in jaren: 46,5 ± 10,4; aantal vrouwen: 94%; EDSS: 3,1 ± 1,8; ziekteduur in jaren: 10,1 ± 8,6). Er werd geen nieuwe ‘baseline’ meting gedaan voorafgaand aan de tweede fase, wat voor een bias in de resultaten gezorgd kan hebben. In de studie werden alleen patiënten met vermoeidheidsklachten (FSS ≥ 4) geïncludeerd. De wijze van randomisatie en blindering van de zorgverleners en onderzoekers die de vragenlijsten afnamen is niet goed beschreven. De interventiegroep was mogelijk in staat te identificeren welke medicatie zij ontvingen door het verschil in effect van de genomen medicatie tijdens de twee verschillende fasen van de studie.
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
Kim (2011) rapporteerde geen verschil in vermindering van FSS en MFIS scores na 6 weken American Ginseng/ placebo gebruik ten opzichte van baseline. Op basis van de FSS- en MFIS-scores na twee maanden medicatiegebruik concludeerde de werkgroep dat de verschillen tussen de groepen niet klinisch relevant zijn (FSS: 0 SD, MFIS: 0,07 SD).
Tabel 1 Resultaten Kim (2011)
|
Score ± SD |
Baseline |
Interventie |
Placebo |
|
FSS |
5,7 ± 0,98 |
5,5 ± 1,3 |
5,5 ± 1,3 |
|
MFIS |
47,0 ± 15,0 |
42,7 ± 15,7 |
43,7 ± 16,7 |
2. Adverse events (belangrijke uitkomstmaat)
Kim (2011) rapporteerde 29 adverse events tijdens het gebruik van American ginseng en 26 tijdens placebo gebruik. Dit verschil werd niet statistisch getest. Het betroffen geen serieuze adverse events die medische behandeling behoefden. Voor American ginseng betrof het voornamelijk misselijkheid, insomnia, hoofdpijn, uitslag en griepachtige symptomen. Adverse events in de placebogroep werden niet beschreven.
Bewijskracht van de literatuur
RCT’s beginnen binnen GRADE bij een therapeutische vraag op een hoge bewijskracht.
De bewijskracht voor de uitkomstmaat vermoeidheid is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: inadequate blindering van patiënt, 1 niveau); en het kleine aantal studies (imprecisie, 1 niveau). De uiteindelijke bewijskracht is laag.
De bewijskracht voor de uitkomstmaat adverse events kon niet worden gegradeerd in verband met de beperkte rapportage van de resultaten.
Acetylsalicylzuur versus placebo
Beschrijving studies
Wingerchuk (2005) onderzocht het effect van zes weken acetylsalicylzuur gebruik (650 milligram, 2x per dag) op MS-gerelateerde vermoeidheid door een interventiegroep (N=14) te vergelijken met een groep die een placebo (N=15) ontving door middel van een cross-over design. De patiëntkarakteristieken werden voor de gehele onderzoekspopulatie gezamenlijk gegeven: leeftijd in jaren: 38,7 ± 6,1; EDSS: 2,5 ± 1,9; ziekteduur in jaren: 10,4 ± 8,3; duur vermoeidheid in maanden: 33,2 ± 25,1. De baseline metingen werden wel herhaald voorafgaand aan de tweede fase. In de studie werden alleen patiënten met vermoeidheidsklachten (FSS ≥ 4) geïncludeerd. De interventiegroep was mogelijk in staat te identificeren welke medicatie zij ontvingen door het verschil in effect van de genomen medicatie tijdens de twee verschillende fasen van de studie.
Resultaten
1. Vermoeidheid (cruciale uitkomstaat)
Wingerchuk (2005) rapporteerde significant lagere MFIS-scores na acetylsalicylzuur gebruik in vergelijking met placebo, geanalyseerd met een repeated measures ANOVA (zie tabel 2). Voor de andere metingen werden er geen significante verschillen gevonden (zie tabel 2). Op basis van de vermoeidheidsscores na medicatiegebruik concludeert de werkgroep dat de gevonden verschillen (MFIS: 0,2 SD, FSS: 0,2 SD, MS: 0,1 SD) niet klinisch relevant zijn.
Tabel 2 Wingerchuk (2005)
|
|
Baseline |
Interventie |
Placebo |
|
MFIS |
46,3 ± 16,0 |
38,1 ± 17,0 |
42,5 ± 18,8 |
|
FSS |
5,7 ± 0,8 |
5,1 ± 1,1 |
5,3 ± 1,1 |
|
MS |
5,5 ± 0,8 |
5,0 ± 1,9 |
5,2 ± 0,7 |
2. Adverse events (belangrijke uitkomstmaat)
Wingerchuk (2005) rapporteerde geen serieuze adverse events. Wel werd in de Aspirine-groep drie keer misselijkheid en één keer epigastrische pijn gerapporteerd. In de placebogroep werd twee keer misselijkheid, één keer hoofpijn en één keer diarree gerapporteerd. De groepen werden niet statistisch met elkaar vergeleken.
Bewijskracht van de literatuur
RCT’s beginnen binnen GRADE bij een therapeutische vraag op een hoge bewijskracht.
De bewijskracht voor de uitkomstmaat vermoeidheid is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: inadequate blindering patiëntengroepen, 1 niveau) en het zeer geringe aantal patiënten (imprecisie, 2 niveaus). De uiteindelijke bewijskracht is zeer laag.
De bewijskracht voor de uitkomstmaat adverse events is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: inadequate blindering patiëntengroepen en mogelijke missing data door uitblijven dossier onderzoek, 1 niveau) en het zeer geringe aantal patiënten (imprecisie, 2 niveaus). De uiteindelijke bewijskracht is zeer laag.
Modafinil versus placebo
Beschrijving studies
Ledinek (2013) onderzocht het effect van één maand amantadine gebruik (200 milligram per dag), en één maand acetyl-l-carnitine gebruik (2 gram per dag) en één maand modafinil gebruik (200 milligram per dag) ten opzichte van een placebobehandeling op vermoeidheid. Bij deze vergelijking beperken we ons tot de resultaten voor de modafinil-groep (N=15; leeftijd in jaren: 41,5 ± 8,4; aantal vrouwen: 96,6%; EDSS: 3,8 ± 1,6) en die van de placebo medicatie (N=15; leeftijd in jaren: 37,6 ± 6,3; aantal vrouwen: 46,6%; EDSS: 2,0 ± 1,1) ontving. Alleen patiënten met vermoeidheidsklachten werden geïncludeerd (gedocumenteerd door MFIS, afkapwaarden niet gespecificeerd). Er waren enkele verschillen in de EDSS- en MFIS-score tussen de behandelgroepen op baseline. De wijze van randomisatie en blindering van de zorgverleners en onderzoekers die de vragenlijsten afnamen is niet goed beschreven. Daarnaast werd niet beschreven of de analyse volgens het intention to treat principe werd uitgevoerd.
Möller (2011) onderzocht het effect van 4 en 8 weken modafinil gebruik (200 mg per dag) op vermoeidheid. 121 patiënten me een FSS-score ≥ 4 namen deel aan de studie. Tweeënzestig patiënten werden geloot naar de interventiegroep (leeftijd in jaren: 41,4 ± 9,5; aantal vrouwen: 63%; EDSS: 3,5 ± 1,4; ziekteduur in jaren: 7,1 ± 6,1) en 59 naar de controlegroep (leeftijd in jaren: 40,8 ± 11,2; aantal vrouwen: 78%; EDSS: 3,1 ± 1,4; ziekteduur in jaren: 6,8 ± 5,5). Het is onduidelijk of de zorgverleners en onderzoekers die de vragenlijsten afnamen geblindeerd waren.
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
Ledinek (2013) heeft niet gerapporteerd of het verschil in voor leeftijd, geslacht en baseline gecorrigeerde MFIS-score statistisch significant was. Analyses in RevMan, uitgevoerd door de werkgroep op basis van gepubliceerde data, toonden geen significant verschil in MFIS-waarden na één maand medicatiegebruik (gecorrigeerd voor leeftijd, geslacht en baseline MFIS-score, zie figuur 3). Het betrof een verschil in MFIS-score van -0,08 SD van de interventiegroep ten opzichte van de controlegroep en wordt door de werkgroep aangemerkt als niet klinisch relevant.

Figuur 3 MFIS (1 maand follow-up, na correctie voor baseline MFIS-score, leeftijd en geslacht)
Möller (2011) rapporteerde dat er geen statistisch significante verschillen tussen de groepen werden gevonden. Het blijft wel onduidelijk voor welke onderdelen uit de ANOVA de p-waarden zijn gerapporteerd, en of er bijvoorbeeld naar de interactieterm is gekeken. Analyses in RevMan, uitgevoerd door de werkgroep op basis van gepubliceerde data, toonden geen significante verschillen in vermoeidheidsscores tussen de groepen na medicatiegebruik (zie figuur 4). De niet significante verschillen worden door de werkgroep ook aangemerkt als niet klinisch relevant (BFI: -0,01 SD (-0,37, 0,69), FSS: -0,15 SD (-0,51, 0,21), MFIS: 0,06 SD (0,29, 0,42), mFSS: 0,02 (-0,34, 0,38)).
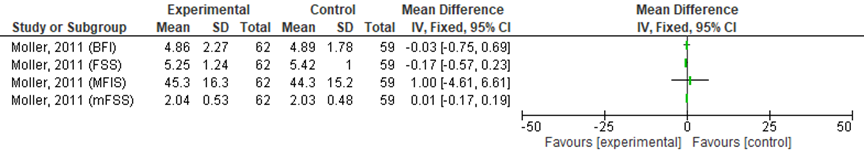
Figuur 4 Vermoeidheidsscores (4-8 weken follow-up)
2. adverse events
Ledinek (2013) rapporteerde dat drie van de patiënten die modafinil gebruikten last hadden van insomnia. Over de placebogroep werden geen uitspraken gedaan.
Möller (2011) rapporteerde dat zes patiënten stopten met de studie vanwege een adverse event. Deze zes adverse events werden niet specifieker beschreven. Wel werd gerapporteerd dat er na vier weken een trend was in toegenomen rusteloosheid in de modafinil groep vergeleken met de placebogroep. Aan het einde van de studie werd er een trend richting meer misselijkheid in de modafinil groep in vergelijking met de placebogroep waargenomen. Andere bijwerkingen als diarree, algehele malaise en maagpijn werden significant vaker gerapporteerd na vier weken modafinil ten opzichte van placebo.
Bewijskracht van de literatuur
RCT’s beginnen binnen GRADE bij een therapeutische vraag op een hoge bewijskracht.
De bewijskracht voor de uitkomstmaat vermoeidheid is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen blindering van zorgverleners/onderzoekers en mogelijk geen intention to treat analyse, 1 niveau) en het geringe aantal patiënten (imprecisie, 1 niveau). De uiteindelijke bewijskracht is laag.
De bewijskracht voor de uitkomstmaat adverse events is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: mogelijk onvoldoende blindering van zorgverleners/onderzoekers, mogelijk geen intention to treat analyse en mogelijke missing data door uitblijven dossier onderzoek, 2 niveaus) en het geringe aantal patiënten (imprecisie, 1 niveau). De uiteindelijke bewijskracht is zeer laag.
Retinyl palmitate versus placebo
Beschrijving studies
Bitafaran (2016) onderzocht het effect van zes maanden retinyl palmitate gebruik (25000 IU eerste zes maanden, 10000 IU tweede zes maanden) op vermoeidheid door een interventiegroep (N=51; leeftijd in jaren: 30,4 ± 1,0; aantal vrouwen: 75%; EDSS: 1,3 ± 0,1; ziekteduur in jaren: 4,3 ± 0,6) met een groep die een placebomiddel (N=50; leeftijd in jaren: 32,3 ± 1,0; aantal vrouwen: 76%; EDSS: 1,4 ± 0,2; ziekteduur in jaren: 5,4 ± 0,6) te vergelijken. Alleen patiënten met vermoeidheidsverschijnselen (MFIS> 20) werden geïncludeerd. Het onderzoek is onderdeel van een grotere studie waarvan niet alle resultaten in dit artikel zijn verwerkt. De wijze van randomisatie en de eventuele blindering van de zorgverleners en onderzoekers die de vragenlijsten afnamen zijn niet goed beschreven. Daarnaast werd niet beschreven of de analyses volgens het intention to treat principe werd uitgevoerd.
Resultaten
1. Vermoeidheid
Bitafaran (2016) rapporteerde een significant verschil (p=0,004) in de verandering van de MFIS-score Analyses in RevMan, uitgevoerd door de werkgroep op basis van gepubliceerde data, toonden ook een significant verschil in verandering van MFIS-scores na 6 maanden medicatiegebruik (zie figuur 5). Dit verschil wordt door de werkgroep aangemerkt als klinisch relevant (-0,53 SD van de interventiegroep ten opzichte van de controlegroep.

Figuur 5 MFIS (verschilscores)
2. Adverse events
Bitafaran (2016) maakte geen melding betreffende adverse events.
Bewijskracht van de literatuur
RCT’s beginnen binnen GRADE bij een therapeutische vraag op een hoge bewijskracht.
De bewijskracht voor de uitkomstmaat vermoeidheid is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: mogelijk inadequate blindering van zorgverleners/onderzoekers en mogelijk geen intention to treat analyse, 1 niveau), het kleine aantal studies, het geringe aantal patiënten en het betrouwbaarheidsinterval dat de grenzen van klinische besluitvorming overschrijdt (imprecisie, 1 niveau). De uiteindelijke bewijskracht is laag.
De bewijskracht voor de uitkomstmaat adverse events kon niet worden gegradeerd, omdat er niets over adverse events werd gerapporteerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de effecten van een medicamenteuze behandeling voor MS-gerelateerde vermoeidheid op vermoeidheid en adverse events?
P: patiënten met MS-gerelateerde vermoeidheid;
I: medicamenteuze interventie (bijvoorbeeld amantadine, pemoline, modafinil, methylfenidaat);
C: placebo;
O: MS-gerelateerde vermoeidheid, adverse events.
Patiënten
In de literatuursamenvatting zijn alleen studies geïncludeerd waarbij als inclusiecriterium voor de patiëntenpopulatie het hebben van vermoeidheidsklachten was opgenomen. Hierbij is gekozen om niet a priori een ondergrens voor de vermoeidheidsklachten te definiëren. Het onderscheid tussen primaire en secundaire vermoeidheid is vaak in de geïncludeerde studies niet duidelijk gemaakt. Er is gekozen om artikelen waar niet duidelijk uit bleek of zij alleen patiënten met primaire vermoeidheid hebben geïncludeerd, wel mee te nemen.
Relevante uitkomstmaten
De werkgroep achtte MS-gerelateerde vermoeidheid een voor de besluitvorming cruciale uitkomstmaat; en adverse events een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde de uitkomstmaat MS-gerelateerde vermoeidheid als vermoeidheid vastgesteld met een gevalideerde vragenlijst, zoals de fatigue severity scale (FSS) of de modified fatigue impact scale (MFIS). De werkgroep definieerde niet a priori de uitkomstmaat adverse events, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde een verschil van 0,5 standardized mean difference tussen de groepen als een klinisch (patiënt) relevant verschil voor de uitkomstmaat MS-gerelateerde vermoeidheid. Voor de uitkomstmaat adverse events werden de ‘default grenzen’ van GRADE aangehouden (RR=0,8 en RR 1,25; Schünemann, 2013).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Elsevier) werd op 22 juli 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerd onderzoek (RCT’s) die zijn verschenen na 2000. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 331 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en risk of bias beoordeling) of RCT’s waarin patiënten met MS die last hadden van MS-gerelateerde vermoeidheid participeerden en waarin een vergelijking werd gemaakt tussen een medicamenteuze behandeling van MS-gerelateerde vermoeidheid en een placebobehandeling. Daarnaast moesten ten minste tien patiënten per studie-arm en één van bovenstaande (relevante) uitkomstmaten zijn geïncludeerd.
Op basis van titel en abstract werden in eerste instantie 40 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 33 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en zeven studies definitief geselecteerd.
Resultaten
Zeven (Achiron, 2015; Ahstari, 2009; Bitafaran, 2016; Ledinek, 2013; Kim, 2011; Möller, 2011; Wingerchuk, 2015) studies zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Achiron, A.; Givon, U.; Magalashvili, D.; Dolev, M.; Liraz Zaltzman, S.; Kalron, A.; Stern, Y.; Mazor, Z.; Ladkani, D.; Barak, Y. (2015). Effect of Alfacalcidol on multiple sclerosis-related fatigue: A randomized, double-blind placebo-controlled study. Multiple Sclerosis 21(6), 767-75.
- Allart, M., E., Benoit, A., Blanchard-Dauphin, a., Tiffreau, V., Thevenon, A., Zephir, H., Outteryck, O., Lacour, A., Vermersch, P. (2015) Sustained-released Fampridine in Multiple Sclerosis: Effects on Gait Parameters, Arm function, Fatigue, and Quality of Life. J Neurol, 262 (8), 1936-45.
- Ashtari, F.; Fatehi, F.; Shaygannejad, V.; Chitsaz, A. (2009). Does amantadine have favourable effects on fatigue in Persian patients suffering from multiple sclerosis? Neurologia i Neurochirurgia Polska 43(5), 428-32.
- Bakirtzis, C., Konstantinopoulou, E., Langdon, D.W., Grigoriadou, E., Minti, F., Nikolaidis, I., Boziki, M.K., Tatsi, R., Ionnidis, P., Karapanayiotides, r., Afrantou, T., Hadjigeorgiou, G., grigoriadis, N. (2018) Long-term effects of prolonged-release fampridine in cognitive function, fatigue, mood and quality of life of MS patients: the IGNITE study. J Neurol Sci 15, 395, 106-112.
- Bitarafan, S.; Saboor-Yaraghi, A.; Sahraian, M. A.; Soltani, D.; Nafissi, S.; Togha, M.; Beladi Moghadam, N.; Roostaei, T.; Mohammadzadeh Honarvar, N.; Harirchian, M. H. (2016). Effect of Vitamin A Supplementation on fatigue and depression in Multiple Sclerosis patients: A Double-Blind Placebo-Controlled Clinical Trial.Iranian Journal of Allergy Asthma & Immunology 15(1), 13-9.
- Chaudhuri, A., Behan, P.O.. (2004) Fatigue in neurological disorders. Lancet. 363 (9413), 978-88.
- Elbers, R.G.; Verhoef, J., van Wegen, E.E., Berendse, h.W., Kwakkel, G. (2015) Interventions for fatigue in Parkinson’s disease. Cochrane Database Syst. Rev 8(10, CD010925).
- Johansson, B., Wentzel, A.P., Andréll, P., Odenstedt, J., Mannheimer, C., Rönnbäck, L. (2014) Evaluation of dosage, safety and effects of methylphenidate on post-traumatic brain injury symptoms with a focus on mental fatigue and pain. Brain Inj 28(3): 304-10.
- Johansson, B., Wentzel, A.P., Andréll, P., Rönnbäck, L., Mannheimer, C. (2017) Long-term treatment with methyphenidate for fatigue after traumatic brain injury. Acta Neurol Scand 135 (1) ,100-107.
- Kim, E.; Cameron, M.; Lovera, J.; Schaben, L.; Bourdette, D.; Whitham, R. (2011). American ginseng does not improve fatigue in multiple sclerosis: a single center randomized double-blind placebo-controlled crossover pilot study. Multiple Sclerosis 17(12), 1523-6.
- Korsen, M., Kunz, r., Schminke, U., Runge, U., Kohlmann, T., Dressel, A. (2017). Dalfampridine Effects on Cognition, Fatigue, and Dexterity. Brain Behav 7(1)e00559.
- Ledinek, A. H.; Sajko, M. C.; Rot, U. (2013). Evaluating the effects of amantadin, modafinil and acetyl-l-carnitine on fatigue in multiple sclerosis - Result of a pilot randomized, blind study. Clinical Neurology and Neurosurgery 115(0), S86-S89.
- MacAllister, W.S., Krupp, L.B. (2005) Multiple sclerosis-related fatigue. Phys Med Rehabil Clin N Am. 16(2),483-502.
- Moller, F.; Poettgen, J.; Broemel, F.; Neuhaus, A.; Daumer, M.; Heesen, C. (2011). Multiple Sclerosis 17(8), 1002-9
- Morrow, S.A., Rosehart, H., Johnson, A. (2017) The Effect of Fampridine-SR on Cognitive Fatigue in a Randomized Double-Blind Crossover Trial in Patients with MS. Mult Scler Relat Disord 11, 4-9.
- Nourbakhsh, B., Revirajan, N., Morris, B., Cordano, C., Creasman, J., Manguinao, M., ... & Waubant, E. (2021). Safety and efficacy of amantadine, modafinil, and methylphenidate for fatigue in multiple sclerosis: a randomised, placebo-controlled, crossover, double-blind trial. The Lancet Neurology, 20(1), 38-48.
- Rodriguez-Leal, F.A., Haase, R., Akgün, K., Proschmann, U., Schultheiss, T., Kern, R., Ziemssen, T. (2019) Nonwalkin gresponse to fampridine in patients with multiple sclerosis in a real-world setting. Ther adv Chronic Dis 10:2040622319835136.
- Rooney S, Wood L, Moffat F, Paul L. (2019) Prevalence of fatigue and its association with clinical features in progressive and non-progressive forms of Multiple Sclerosis. Mult Scler Relat Disord. 28, 276-282. doi: 10.1016/j.msard.2019.01.011. Epub 2019 Jan 3. PMID: 30639830.
- Schünemann, H., Brożek, J., Guyatt, G., et al. (2013) GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Vucic, S., Burke, D., Kiernan, M.C. (2010) Fatigue in multiple sclerosis: mechanisms and management. Clin Neurophysiol. 121(6), 809-17.
- Wingerchuk, D. M. (2005). A randomized controlled crossover trial of aspirin for fatigue in multiple sclerosis. Neurology 64(7), 1267-9
- Zorginstituut Nederland. Farmacotherapeutisch Kompas. Beschikbaar via https://farmacotherapeutischkompas.nl. Geraadpleegd op 6-2-2020.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Möller, 2011 |
1:1 central randomisation |
Unlikely |
Unlikely (placebo) |
Unclear: double blind, but not further described |
Unclear (double blind, but not further described) |
Unlikely |
Unclear: reasons for drop-put were not specified per group |
Unlikely |
|
Ahstari, 2009 |
Not reported |
Unclear (not reported) |
Unlikely (placebo) |
Unlikely (caregivers were blinded) |
Unclear (not reported) |
Unlikely |
Unclear (not reported) |
Unclear: not reported |
|
Achiron, 2015 |
Not reported |
Unclear (not reported) |
Unlikely (placebo) |
Likely |
Unclear (not reported) |
Unlikely |
Unclear (not reported) |
Unlikely |
|
Kim, 2011 |
Not reported |
Unclear (not reported) |
Likely (patients might have identiefied their group due to differences in symptom relief due to crossover design) |
unclear (double blind, but not further specified) |
unclear (double blind, but not further specified) |
Likely (PSS and other parameters were not reported) |
Unclear (6 of 53 for unknown reasons) |
Unlikely |
|
Bitafaran, 2016 |
Not reported, Stratification per gender |
Unclear (not reported) |
Unlikely (placebo) |
Unclear (not reported) |
Unlikely (researchers were blinded) |
Unlikely |
Unlikely |
Unclear (not reported) |
|
Ledinek 2013 |
Not reported |
Unclear (not reported) |
Unlikely (placebo) |
Unclear (blinded study, but not further reported) |
Unclear (blinded study, but not further reported) |
Unlikely |
Unclear (not reported) |
Unclear (not reported) |
|
Wingerchuk, 2005 |
Algorithm generated by a random number programm |
Unlikely |
Likely (patients identified their group due to differences in symptom relief due to crossover design) |
Unlikely (allocation results were secured in pharmacy) |
Unlikely (allocation results were secured in pharmacy) |
Unlikely |
Unlikely (drop outs only in first phase placebo group, no drop outs in second phase placebo group) |
Unlikely |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Shangyan, 2018 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Yang, 2017 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Khan, 2014 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Asano, 2014 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Sheng, 2013 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Tejani, 2012 |
Geen vergelijking met placebo |
|
Brown, 2010 |
Geen systematic review |
|
Lee, 2008 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Pucci, 2007 |
Geen vergelijking met placebo |
|
Lange, 2009 |
Voldoet niet aan PICO (interventie combinatie met TMS) |
|
Miller, 2017 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Ayoobi, 2019 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Broicher, 2018 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Ford-Johnson, 2016 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Bertoglio, 2016 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Etemadifar, 2013 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Johnson, 2006 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Khazaei, 2019 |
Geen vergelijking met placebo |
|
Cambron, 2018 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Cameron, 2017 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Shaygannejad, 2012 |
Geen vergelijking met placebo |
|
Aragona, 2009 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Rammohan, 2005 |
Betreft Comment |
|
Kraft, 2005 |
Betreft Commend |
|
Tomassini, 2004 |
Geen vergelijking met placebo |
|
Generali, 2004 |
Review is niet systematisch |
|
Willoughby, 2002 |
Review is niet systematisch |
|
Wade, 2002 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
Rammohan, 2002 |
Voldoet niet aan studydesign (geen RCT) |
|
Gillson, 2002 |
Voldoet niet aan studydesign (7 patiënten in placebo groep) |
|
Zifko, 2002 |
Betreft nieuwsbericht |
|
Rossini, 2001 |
Voldoet niet aan PICO (populatie niet specifiek vermoeid) |
|
The pharmaceutical journal, 2000 |
Betreft nieuwsbericht |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 08-07-2021
Laatst geautoriseerd : 08-07-2021
Geplande herbeoordeling : 01-01-2027
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met Multiple Sclerose (MS).
Werkgroep
- Prof. dr. V. de Groot, revalidatiearts, Amsterdam UMC, locatie VUmc, Amsterdam, VRA (voorzitter)
- Dr. J. van Meeteren, revalidatiearts, Rijndam, locatie Erasmus MC, Rotterdam, VRA (voorzitter)
- Dr. A.C. van Voskuilen, revalidatiearts, Klimmendaal Revalidatiespecialisten, Arnhem, VRA
- Dr. N.F. Kalkers, neuroloog, OLVG, Amsterdam en Amsterdam UMC, locatie VUmc, Amsterdam, NVN
- Drs. C. van Gelder, specialist ouderengeneeskunde, GGzE, Eindhoven, Verenso
- Prof. dr. F.G. Schaafsma, bedrijfsarts, bijzonder hoogleraar arbeid en bedrijfsgeneeskunde Amsterdam UMC, Afdeling Public & Occupational Health, NVAB
- R. Standhardt-Keilman, ergotherapeut, Nieuw Unicum, Zandvoort, EN (tot oktober 2019)
- Dr. I.C.J.M. Eijssen, ergotherapeut, Amsterdam UMC, locatie VUmc, Amsterdam, EN (vanaf november 2019)
- Dr. M.B. Rietberg, fysiotherapeut, Amsterdam UMC, locatie VUmc, Amsterdam, KNGF
- Dr. R. Kemps, GZ-psycholoog, Prinses Máxima Centrum voor Kinderoncologie, Utrecht, NIP (tot mei 2020 werkgroeplid, vanaf juni 2020 lid klankbordgroep)
- Drs. M.G.E. Huijsmans, GZ-psycholoog, OLVG, Amsterdam en Reade, NIP (vanaf juni 2020)
- K. Harrison, verpleegkundig specialist neurologie, Ter Gooi, locatie Blaricum, V&VN
- J.E. Schoonen-Ouwehand, revalidatie maatschappelijk werker, Basalt Revalidatie, Den Haag, BPSW (tot maart 2020)
- Dhr. R.G. Hoogakker, medisch maatschappelijk werker en aandachtsfunctionaris huiselijk geweld, Amsterdam UMC, locatie VUmc, Amsterdam, BPSW (vanaf maart 2020)
- Drs. L.S. Ruhaak, logopedist, logopediewetenschapper en onderzoeker in opleiding, Amsterdam UMC, locatie VUmc, Amsterdam, (en tot juli 2020 Nieuw Unicum, Zandvoort), NVLF
- E. Kruijver, seksuoloog, PsyQ, Utrecht en De Hoogstraat, Revalidatie, Utrecht, NVVS
- C.E. Helfrich-Smallegange, diëtist, Siza, Arnhem, NVD
- F. Kingma, patiëntvertegenwoordiger, MS Vereniging Nederland
Met ondersteuning van
- Dr. S. Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S. Van Dijk, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot januari 2019)
- Dr. G. Peeters, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf januari 2019 tot november 2019)
- Dr. J.C. Maas, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf november 2019)
- Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf augustus, 2020)
- Dr. Mevr. R. Zwarts - van de Putte, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf augustus, 2020)
Met dank aan
- M.E. Wessels MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- M. van der Maten MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Groot (voorzitter) |
Hoofd afdeling revalidatiegeneeskunde Amsterdam UMC. |
President Rehabilitation in MS (RIMS; onbetaald, tot en met juni 2019). |
Diverse onderzoeksprojecten op het gebied van MS bij MS research en ZonMW. Door eigen wetenschappelijk onderzoek bijgedragen aan kennisvermeerdering.
De activiteiten van RIMS worden gesponsord door Biogen, Roche and Medday. Deze bedrijven produceren ziektemodulerende behandelingen voor MS. Biogen heeft ook symptomatische behandeling voor loopproblemen. |
Geen actie nodig. Ziektemodulerende behandelingen vormen verder geen onderdeel van de richtlijn. |
|
Meeteren (voorzitter) |
Revalidatiearts, Rijndam, locatie Erasmus MC |
Geen |
Geen |
Geen actie nodig |
|
Eijssen (vanaf 11-2019) |
Ergotherapeut, onderzoeker VU medisch centrum |
Lid Ergotherapie Nederland (onbetaald)
Commissielid Adviesraad Onderzoek en Wetenschap - Ergotherapie Nederland (onbetaald)
Lid Rehabilitation in Multiple sclerosis (RIMS) - European Network for best Practice and Research in MS (onbetaald)
Commissielid Wetenschappelijk raad van de RIMS - Special Interest Group Occupation (SIG-Occupation) (onbetaald)
Commissielid MS netwerk Groot Amsterdam (onbetaald) |
In het verleden deelgenomen aan onderzoeksprojecten die gefinancierd werden door ZONmw (>3 jaar geleden) en MS research (afgerond 30-09-2019). Er zijn geen belangen voor de adviezen van de richtlijn. |
Geen actie nodig |
|
Harrison |
Verpleegkundig Specialist Neurologie bij Tergooi ziekenhuizen locatie Blaricum |
Werkgroeplid MS richtlijn behandeling (onkostenvergoeding).
MS registratie commissie / wetenschap commissie (onkostenvergoeding).
Bestuurslid Landelijke Vereniging MS verpleegkundigen (onkostenvergoeding). |
Geen |
Geen actie nodig |
|
Helfrich |
SIZA, Arnhem; diëtist: 20 uur per week
Tot 1 mei 2020: Diëtistenpraktijk Corine Helfrich, Maurik: eigen 1e lijnspraktijk: 20 uur per week |
Bestuurslid MDL-netwerk NVD (onbetaald) |
Geen |
Geen actie nodig |
|
Hoogakker (vanaf 01-03-2020) |
Medisch maatschappelijk werker polikliniek Revalidatie, Amsterdam UMC, locatie De Boelelaan. 20 uur per week
Aandachtfunctionaris huiselijk geweld, Amsterdam UMC, locatie De Boelelaan, 16 uur per week |
Voorzitter GZ maatschappelijk werk BPSW (onbetaald) |
Geen |
Geen actie nodig |
|
Huijsmans (vanaf -01-06-2020) |
GZ-psycholoog OLVG en Reade |
Lid CognetMS Docent Rino (betaald): onderwijs aan zorgprofessionals vakgebied neuropsychologie |
Geen |
Geen actie nodig |
|
Kemps (tot 1-5-2020 werkgroeplid, daarna lid klankbordgroep) |
Tot 01-05-2020 GZ-psycholoog, Rijndam Revalidatie, locatie Erasmus MC
Vanaf 01-05-2020 Psycholoog, Prinses Máxima Centrum voor Kinderoncologie |
Docent voor AXON leertrajecten Werkzaamheden (betaald): onderwijs en voorlichting aan zorgprofessionals met betrekking tot de begeleiding van patiënten met niet-aangeboren hersenletsel |
Geen |
Geen actie nodig |
|
Kalkers |
Neuroloog OLVG, 0,7 fte, neuroloog VUmc 0,1 fte |
Secretaris bestuur Nederlandse Vereniging voor Neurologie 0,1 fte (sinds 1-6-2019).
Voorzitter bestuur landelijke MS registratie: 2 vergaderingen per jaar (vacatiegelden) (tot 1-11-2020). |
Geen |
Geen actie nodig |
|
Kingma |
Geen |
Geen |
Geen |
Geen actie nodig |
|
Kruijver |
Seksuoloog NVVS voor Basalt Revalidatie (28 uur p/w tot 01-10-2020)
Seksuoloog NVVS voor PsyQ Utrecht (28 uur p/w vanaf 01-10-2020)
Seksuoloog NVVS voor De Hoogstraat Revalidatie (4 uur p/w) |
Nederlandse wetenschappelijke Vereniging voor Seksuologie: Coördinator NVVS werkgroep Richtlijnen (onbetaald)
Incidenteel gastdocent diverse opleidingen Amstel Academie en Antonius Academie (betaald per lesuur) |
Geen |
Geen actie nodig |
|
Rietberg |
Paramedisch manager (0,56) /Fysiotherapeut (0,33) /Onderzoeker (0,11) Amsterdam UMC, locatie VUmc |
Penningmeester EFOX: European Foundation for Health and Exercise, onbetaald. Voorzitter MS Netwerk Groot Amsterdam, (onbetaald).
Voorzitter F-UMC (fysiotherapie universitair medische centra) (onbetaald).
Consilium KNGF (vacatievergoeding). |
Geen |
Geen actie nodig |
|
Ruhaak |
Logopedist (0,4 fte) en Logopediewetenschapper (0,4 fte) bij Nieuw Unicum tot september 2020
Onderzoeker in opleiding bij Amsterdam UMC, locatie VUMC (Niet in loondienst contract)
|
Voorzitter SIG Communication & Swallowing van Rehabilitation In Multiple Sclerosis (RIMS) (onbetaald): - organiseren van meetings 2 keer per jaar - communicatie met bestuur - communicatie met SIG leden |
Werkt aan onderzoek wat qua onderwerp overeenkomt met enkele richtlijnmodules (bijv. dysartrie). Echter zijn er op dit moment nog geen publicaties verschenen over deze onderzoeken. Het onderzoek wordt gefinancierd door MS research en RIMS, waarbij RIMS geen invloed op het verloop of uitkomsten van de studie.
Heeft onlangs een narratieve review artikel ingediend over communicatie en slikken bij MS (niet gefinancierd). |
Geen actie nodig |
|
Schaafsma |
Bedrijfsarts, senior onderzoeker Amsterdam UMC, 0,8 fte
Bijzonder hoogleraar, NVAB, 0,2 fte |
Commissielid Raad van Toezicht bij Vitaalpunt (betaald).
Plaatsvervangend commissielid Commissie Klachtenafhandeling Aanstellingskeuringen bij SER (vacatiegelden).
Commissielid Commissie Richtlijnontwikkeling en wetenschap voor de NVAB (onbetaald).
Commissielid Burger- Zielhuispenning voor de NVAB (onbetaald). |
Geen. Betrokken bij diverse onderzoeksprojecten die gefinancierd worden door ZONmw, Instituut GAK of UWV. Er zijn geen belangen voor de adviezen van de richtlijn. |
Geen actie nodig |
|
Schoonen-Ouwehand (werkgroeplid tot maart 2020) |
Basalt Revalidatie, maatschappelijk werker |
BPSW voorzitter functiegroep gezondheidszorg maatschappelijk werk; aansturen van leden binnen de functiegroep, vallende onder de beroepsvereniging in kader van afstemming en uitzetten beleid. Functiegroepleden uit verpleeghuizen, ziekenhuizen en revalidatie. Vrijwillig |
Geen |
Geen actie nodig |
|
Standhardt-Keilman (werkgroeplid tot oktober 2019) |
Ergotherapeut bij Stichting Nieuw-Unicum |
Geen |
Geen |
Geen actie nodig |
|
Van Gelder |
Specialist oudergeneeskunde Vitalis woonzorggroep tot 1-1-2021, vanaf 1-3-2021 bij GGzE Eindhoven Beoordelingen wilsbekwaamheid voor notarissen en rechtbank Bestuurslid MS zorg Nederland |
"Lid medische adviesraad restless legs stichting onbetaald Maker filmdocumentaire euthanasie en psychiatrische ziekte, euthanasie en dementie onbetaald." |
Geen |
Geen actie nodig |
|
Van Voskuilen |
Revalidatiearts bij Klimmendaal Revalidatiespecialisten. |
Geen |
In 2012 gepromoveerd op Sacrale Neuromodulatie bij lagere urineweg symptomen |
Geen actie nodig |
|
Persoon |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Tot oktober 2018 Gastvrijheidsaanstelling afdeling Revalidatie Academisch Medisch Centrum, Amsterdam, in verband met promotietraject. Project: Physical fitness to improve fitness and combat fatigue in patients with multiple myeloma or lymphoma treated with high dose chemotherapy.
April 2018-september 2018: Docent Team Technologie, Fontys Paramedische Hogeschool. Begeleiden van studenten bij afstudeerstages. Max 1 dag in de week, betaald. |
Geen, promotieonderzoek werd gefinancierd door KWF, financier had geen invloed op uitkomsten onderzoek of op huidige werkzaamheden. |
Geen actie nodig |
|
Peeters (tot 11-2019) |
Senior adviseur/teamleider Kennisinstituut van de Federatie Medisch Specialisten |
Senior Atlantic Fellow for Equity in Brain Health, Global Brain Health Institute, Trinity College Dublin (onderzoeker; onbetaald).
Verzorgen van onderwijs voor de epidemiologische onderwerpen in het curriculum voor de eerstejaars fellows in het programma van de Global Brain Health Institute. |
Functie bij het Global Brain Health Institute: Er zijn soms financiële voordelen in de vorm van vergoeding van registratie en reiskosten voor congresbezoek. De lopende onderzoeksprojecten hebben geen connectie met MS.
|
Geen actie nodig. |
|
Maas (vanaf 11-2019) |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Onderzoeker in opleiding VU Medisch Centrum 1-4-2009 tot 1-9-2017, vanaf 1-10-2013 onbetaald; Dienstverband National Cardiovascular Data Registry 1-1-2014 tot en met 31-8-2019; Dienstverband Nederlandse Hart Registratie 1-9-2018 tot en met 31-7-2019 |
Geen, onderzoek inmiddels volledig afgerond, financiering van PhD onderzoek of de sponsors van het proefschrift hebben geen enkele invloed op de huidige werkzaamheden. |
Geen actie nodig. |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie nodig. |
|
Zwarts – van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Afronding promotieonderzoek ‘Etiology of the VACTERL association: genetic and non-genetic risk factors’, Radboudumc (onbetaald). |
Geen, promotieonderzoek werd gefinancierd uit een persoonlijke beurs ontvangen vanuit het Radboudumc. |
Geen actie nodig. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van MS Vereniging Nederland, MS Research en het Nationaal MS Fonds voor de Invitational conference en de afvaardiging van de patiëntenvereniging MS Vereniging Nederland in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan MS Vereniging Nederland, MS Research, Nationaal MS Fonds en Patiëntenfederatie Nederland. De aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patienten met MS. Tevens zijn er knelpunten aangedragen door de VRA, IGJ, VIG, ZiNL, MS Research, Nationaal MS Fonds, Nieuw Unicum, NVLF, NVD, MS Zorg Nederland, MS Vereniging Nederland, NVU, NOG, KNGF, EN, NVAB en Archipel tijdens een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Hiernaast beoordeelde de werkgroep de aanbeveling(en) uit de eerdere richtlijnmodule (NVN, 2012) op noodzaak tot revisie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Nederlandse Vereniging voor Neurologie (NVN). Richtlijn Multiple sclerose. Utrecht, 2012.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
