Stappenplan bij zeerhoogrisicopatiënten met diabetes mellitus type 2 (DM2)
Uitgangsvraag
Wat is het optimale medicamenteuze stappenplan voor volwassen personen met DM type 2 en een zeer hoog risico op hart- en vaatziekten?
Aanbeveling
Voor de aanpassingen in het stappenplan medicamenteuze therapie van zeerhoogrisicopatienten met Diabetes Mellitus type 2 verwijzen we naar de het stappenplan in de NHG-Standaard Diabetes Mellitus type 2.
Overwegingen
De literatuuranalyse is gebaseerd op de recente systematische review en netwerk meta-analyse van Palmer (2021). De conclusies, overwegingen en aanbevelingen zijn te vinden in de module ‘SGLT2-remmers’ en de module ‘GLP1-receptoragonisten’. In de huidige module is aanvullend een vergelijking tussen SGLT2-remmers en GLP1-receptoragonisten uitgevoerd. De overwegingen in de module ‘SGLT-2-remmers’ en module ‘GLP1-receptoragonist’ zijn ook relevant voor deze module: zie hiervoor de betreffende modules.
Voor- en nadelen (vergelijking tussen SGLT2-remmers en GLP1-receptoragonisten)
Uit een vergelijking van de effecten van SGLT2-remmers en GLP1-receptoragonisten komt naar voren dat SGLT2-remmers een voordeel bieden, afhankelijk van de patiëntengroep (DM type 2 met eerder bewezen hart- en vaatziekten, DM type 2 met chronische nierschade, DM type 2 met zowel bewezen hart- en vaatziekten als chronische nierschade) voor de totale mortaliteit (6-13 minder per 1000 personen), ziekenhuisopname voor hartfalen (18-48 minder per 1000 personen), en eindstadium nierfalen (1-10 minder per 1000 personen). GLP1-receptoragonisten bieden daarentegen een voordeel ten opzichte van SGLT2-remmers voor niet-fatale beroertes (16-27 minder per 1000 personen). Bij een vergelijking van bijwerkingen is er een nadeel voor SGLT2-remmers voor (mycotische) genitale infecties (158 meer per 1000 personen), en een mogelijk nadeel voor diabetische ketoacidose (1 meer per 1000 personen). Omgekeerd hebben GLP1-receptoragonisten een nadeel ten opzichte van SGLT2-remmers voor ernstige gastro-intestinale events (58 meer per 1000 personen). Een belangrijk voordeel van SGLT2-remmers is de orale toedieningsvorm, terwijl de meeste GLP1-receptoragonisten geïnjecteerd moeten worden.
Kwaliteit van bewijs
Het door de richtlijncommissie als cruciaal benoemde samengestelde cardiovasculaire eindpunt MACE ontbreekt in de systematische review van Palmer (2021), net als een eveneens als cruciaal bestempelde composiet renaal eindpunt. Deze uitkomstmaten worden echter voldoende gedekt door de wel gerapporteerde cardiovasculaire en renale eindpunten. Daarnaast ontbreekt de cruciale uitkomstmaat acuut nierfalen. De zekerheid van het bewijs is afhankelijk van de risicogroep. In de risicogroep met bewezen hart- en vaatziekten maar geen chronisch nierschade is er, met uitzondering van de uitkomstmaat acuut nierfalen (geen bewijs), een redelijke tot hoge zekerheid van het bewijs voor de cruciale uitkomstmaten. In de risicogroep met chronische nierschade maar geen hart- en vaatziekten is er, met uitzondering van de uitkomstmaten acuut nierfalen (geen bewijs) en eindstadium nierfalen (lage zekerheid van bewijs), een redelijke tot hoge zekerheid van het bewijs voor de cruciale uitkomstmaten. Ten slotte is er in de risicogroep met zowel chronische nierschade als hart- en vaatziekten met uitzondering van de uitkomstmaten acuut nierfalen (geen bewijs), totale sterfte, cardiovasculaire sterfte, niet-fataal hartinfarct, en eindstadium nierfalen (lage zekerheid van bewijs), een redelijke tot hoge zekerheid van het bewijs voor de cruciale uitkomstmaten.
Aanvullende overwegingen en medicamenteus stappenplan gericht op zeerhoogrisicopatiënten
Op basis van de bevindingen stelt de richtlijnwerkgroep een wijziging voor in het medicamenteuze stappenplan van de NHG-Standaard Diabetes mellitus type 2 (NHG, 2018) voor een specifieke groep patiënten met een zeer hoog risico op hart- en vaatziekten.
Algemene inleiding en motivatie tot wijziging medicamenteuze stappenplan
Het primaire doel van de behandeling van patiënten met DM type 2 is op korte termijn het behandelen van hyperglykemie en op langere termijn het voorkomen van complicaties, zoals hart- en vaatziekten, nierfalen, blindheid en amputaties, met als beoogd resultaat een betere kwaliteit van leven en, indien mogelijk, een langer leven. Hierbij zijn hart- en vaatziekten de meest prevalente complicatie. Uitgebreide aandacht voor de behandeling van hyperglykemie en cardiovasculair risicomanagement (CVRM) is in de afgelopen jaren succesvol geweest met een duidelijk afname van (sterfte aan) hart- en vaatziekten en microvasculaire complicaties bij patiënten met DM type 2 (Gregg, 2014; Rawshani, 2017; Gregg, 2019). Ondanks deze verbeterde behandeling blijft echter de kans op overlijden en hospitalisatie als gevolg van coronaire hartziekten en hartfalen ruim tweemaal hoger dan de achtergrondpopulatie (Rawshani, 2018). Bovendien zijn micro- en macrovasculaire complicaties na de initiële daling zowel in de Verenigde Staten (Gregg, 2019) als in Nederland (Heintjes, 2019) niet verder afgenomen. Ondanks goed gestructureerde diabeteszorg is in Nederland het risico op hart- en vaatziekten bij mensen met DM type 2 nog steeds verhoogd vergeleken bij mensen zonder DM type 2, en dit is in de periode 2008-2016 gelijk gebleven (Heintjes, 2019). Meerdere Nederlandse studies rapporteren prevalentiecijfers over hart- en vaatziekten van 25-30% (Wermeling, 2012; Hart, 2018; Hart, 2019; Heintjes, 2019). In de studie van Boonman (2012) is het voorkomen van hartfalen onderzocht bij mensen ≥ 60 jaar met DM type 2 en blijkt er sprake te zijn van een niet-gestelde diagnose hartfalen bij 28% van de patiënten. Van de 161 nieuwe diagnosen hartfalen was 17% HFrEF en 83% HFpEF. Verder heeft ruim 10% van de patiënten met eindstadium nierfalen DM type 2 (https://ivisualz.nl/ivisualz/chartFlash/charts). Recent gepubliceerde data suggereren dat dit percentage tussen 2000-2015 van 8,8% naar 12,7% is gestegen (Cheng, 2021). Nadere analyse van de landelijke cijfers afkomstig uit Renine (Registratie Nierfunctievervanging Nederland), toont verder dat tussen 2010 en 2019 de totale populatie (> 45 jaar) met nierfunctievervangende therapie is gestegen van 11.477 tot 15.207 (32%), terwijl dit aantal onder de patiënten met DM type 2 is gestegen van 1058 tot 1700 (61%). Deze laatste toename wordt geregistreerd, terwijl de prevalentie van diabetes in de periode van 2010 tot 2019 nauwelijks veranderde (Volksgezondheidenzorg.info). Ook de sterfte is nog duidelijk verhoogd. Gemiddeld zal een 60-jarige patiënt met DM en hart- en vaatziekten 5,2 jaar eerder overlijden vergeleken met iemand zonder DM (Heintjes, 2019). Deze data geven aan dat er duidelijk nog ruimte is om het verhoogde risico op cardiorenale morbiditeit en mortaliteit bij patiënten met DM type 2 aan te pakken. Het behandelen van patiënten met een zeer hoog risico op hart- en vaatziekten past ook binnen een persoonsgerichte aanpak.
Effect intensieve glucoseverlaging
Uit observationeel onderzoek is bekend dat hyperglykemie samenhangt met het risico op macro- en microvasculaire complicaties, maar verbetering van de glykemische regulatie uitgedrukt als een daling van het HbA1c vertaalt zich niet automatisch in betere patiëntuitkomsten over hart- en vaatziekten. Een meta-analyse van 3 grote studies - ACCORD, ADVANCE, VADT - toonde aan dat een vermindering van het HbA1c van 1% verband houdt met een relatieve risicovermindering van 15% van niet-fatale myocardinfarcten (MI), zonder gunstige effecten op beroerte, sterfte aan hart- en vaatziekten, totale sterfte, of ziekenhuisopname voor hartfalen (Ray, 2009). Intensieve glucosecontrole was gunstiger bij patiënten met een korte diabetesduur, een lager HbA1c bij aanvang en zonder eerder bewezen hart- en vaatziekten (Turnbull, 2009). Bovendien lieten de UKPDS en VADT (beide patiënten met DM type 2) zien dat vroege intensieve glucosecontrole verband houdt met het voorkomen van hart- en vaatziekten op de lange termijn, maar dat hiervoor een lange follow-up (≥ 10 jaar) noodzakelijk is (Laiteerapong, 2019).
Literatuuranalyse: effectiviteit en veiligheid van SGLT2-remmers en GLP1-receptoragonisten
Er zijn inmiddels meerdere gerandomiseerde studies die aantonen dat behandeling met SGLT2-remmers en GLP1-receptoragonisten kan leiden tot minder hart- en vaatziekten, nierfalen, ziekenhuisopnames voor hartfalen, sterfte aan hart- en vaatziekten en totale sterfte (Zelniker, 2019; Mannucci, 2020). Dit werd met name aangetoond bij volwassenen met DM type 2 met hart- en vaatziekten en/of chronische nierschade, een categorie patiënten met een hoog tot zeer risico op (recidief) hart- en vaatziekten, ondanks optimaal cardiovasculair risicomanagement (CVRM). Om tot een goede plaatsbepaling te komen is het essentieel dat er helderheid is over de grootte van het (on)gunstige effect van deze middelen en hierover was de literatuur tot voor kort niet eenduidig.
De huidige literatuuranalyse is gebaseerd op de systematische review van Palmer (2021), die deze onzekerheden adresseert. Deze netwerk meta-analyse (van hoge kwaliteit) en de daarop gebaseerde richtlijn in BMJ Rapid Recommendations (Li, 2021) heeft het effect van SGLT2-remmers en GLP1 receptoragonisten op alle relevante uitkomstmaten beoordeeld op personen met een gradatie in risico op hart- en vaatziekten (Palmer, 2021).
De literatuurconclusies zijn overgenomen uit deze netwerk meta-analyse. De zekerheid (bewijskracht) van de literatuurconclusies is waar nodig (verder) verlaagd als er sprake was van overlap van de effectschatting met de door de huidige werkgroep bepaalde grenzen voor klinische relevantie en besluitvorming. De werkgroep stelt dat voor het beoordelen van de klinische relevantie van het effect een tijdshorizon van 5 jaar de voorkeur heeft en hanteert voor alle cardiovasculaire en renale eindpunten samen een numbers needed to treat van 20 tot 30 (NNT 5 jaar) als grens voor klinische besluitvorming. Deze grens komt overeen met de grens voor andere alom geaccepteerde behandelingen, zoals bloeddrukverlaging, cholesterolreductie of het voorschrijven van plaatjesaggregatieremmers na een beroerte. Zo legt de CVRM-richtlijn (NHG/NIV/NVvC, 2019) de behandelgrens bij een 10-jaarsrisico op hart- of vaatziekte van circa 20% (dus 5-jaarsrisico van 10%), terwijl dit risico met bloeddrukverlaging of cholesterolreductie met ongeveer een derde en met de combinatie van beide behandelingen circa 50% gereduceerd kan worden (wat dus een NNT van 20-30 in 5 jaar is). Omdat patiënten met een hoog tot zeer risico op (recidief) hart- en vaatziekten kans hebben op uiteenlopende uitkomsten gedurende de follow-upperiode, is voor diverse te onderscheiden afzonderlijke eindpunten (zoals totale sterfte, myocardinfarct, beroerte, hartfalen, eindstadium nierfalen) genoegen genomen met een hogere NNT-waarde van 100 over 5 jaar. Deze NNT-grens werd met name gebruikt om het GRADE-domein 'imprecisie' te kunnen beoordelen (per uitkomstmaat). Belangrijk om te benadrukken dat laatstgenoemde grens dus NIET betekent dat elke interventie met een NNT < 100 wordt aanbevolen. Voor ernstige bijwerkingen en complicaties zoals ketoacidose en amputaties werd een NNT (5 jaar) van 1000 gehanteerd als grens voor klinische relevantie en besluitvorming, omdat het hier mogelijke schadelijke effecten (harms) van behandeling met SGLT2-remmers en GLP1-receptoragonisten betreft.
De richtlijncommissie selecteert bij het definiëren van de patiëntenpopulatie die in aanmerking dient te komen voor een SGLT2-remmer of GLP1-receptoragonist een enigszins andere groep met chronische nierschade dan de netwerk meta-analyse en de diabetische nefropathierichtlijn (zie figuur 2). De werkgroep is echter van mening dat dit niet leidt tot relevante problemen bij de interpretatie van de resultaten en daarom geen reden is voor de werkgroep om de bewijskracht van de literatuurconclusie (verder) af te waarderen voor indirectheid.
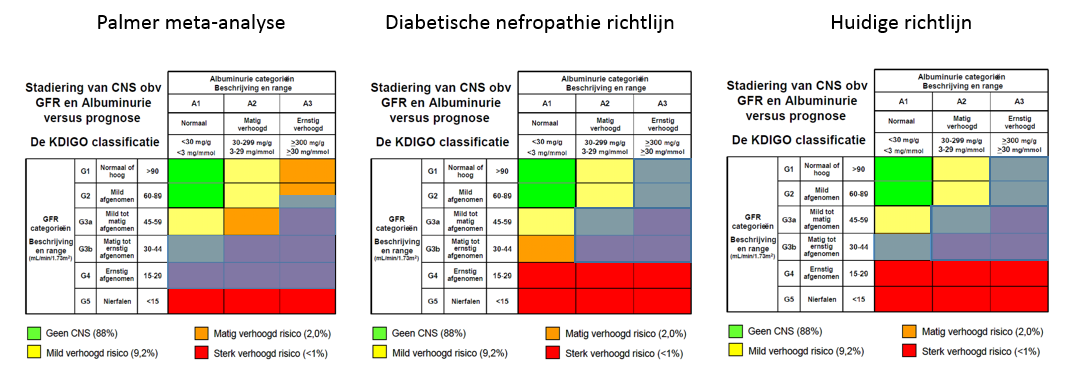
Figuur 2. Definitie van patiëntenpopulatie met chronische nierschade die in aanmerking dient te komen voor een SGLT2-remmer of GLP1-receptoragonist: vergelijk de grijs gearceerde vlakken tussen Palmer (2020), richtlijn Diabetische nefropathie (NIV, 2020) en de huidige richtlijn. Zie de hoofdtekst voor verdere toelichting.
Conform de diabetische nefropathie richtlijn (NIV, 2020) is G4 niet toegevoegd, omdat een eGFR van ≥ 30 ml/min/1,73 m² het inclusiecriterium was in alle cardiovasculaire veiligheidsstudies met SGLT2-remmers (met uitzondering van DECLARE-TIMI 58, waarbij een eGFR van ≥ 60 ml/min/1,73 m² vereist was) waardoor de gerapporteerde effecten op de harde eindpunten niet direct kunnen worden geëxtrapoleerd naar eGFR < 30 ml/min/1,73 m². Verder is conform de richtlijn diabetische nefropathie G1A3 en G2A3 toegevoegd. Conform de netwerk meta-analyse van Palmer heeft de richtlijncommissie G3bA1 toegevoegd.
Feitelijk heeft de richtlijncommissie het voorstel de combinatie DM type 2 en chronische nierschade die gepaard gaat met een matig verhoogd risico (oranje in KDIGO-classificatie) op te waarderen naar rood (waarbij diabetes met orgaanschade of een belangrijke risicofactor zoals gedefinieerd als zeer hoog risico in de CVRM-richtlijn meer wordt geconcretiseerd). Een grote meta-analyse, deels gebaseerd op Nederlandse data, laat zien dat chronische nierschade en diabetes een additief risico geven op sterfte aan hart- en vaatziekten (Fox, 2012). De sterfterisico's waren 1,2-1,9 keer hoger voor deelnemers met diabetes dan voor deelnemers zonder diabetes over de volledige bandbreedte van eGFR en albumine-creatinineratio (ACR). Dit komt overeen met de gerapporteerde forse onderschatting van het risico op hart- en vaatziekten en cardiovasculaire sterfte met SCORE bij mensen met chronische nierschade (Matsushita, 2020; http://ckdpcrisk.org/ckdpatchscore). Integratie van SCORE en een ‘CKD-patch’ volgens KDIGO toont gemiddeld een 1,86 (95%-BI 1,48 tot 2,44) maal hoger risico op mortaliteit indien rekening wordt gehouden met chronische nierschade. Verder zijn er aanwijzingen dat bij mensen met DM type 2 de combinatie van een eGFR < 60 ml/min/1,73 m² en ACR ≥ 3 mg/mmol en een eGFR ≥ 60 ml/min/1,73 m² en ACR ≥ 30 mg/mmol gepaard gaat met een risico op sterfte aan hart- en vaatziekten en renale complicaties dat vergelijkbaar is met reeds geïncludeerde groepen (Ninomiya, 2009). Ten slotte zijn de gunstige effecten van SGLT2-remmers op sterfte, hart- en vaatziekten, en nierfalen consistent over alle KDIGO-risicoclassificaties heen (Neuen, 2021a; Levin, 2020).
Effectiviteit van SGLT2-remmers en GLP1-receptoragonisten
Bij patiënten met eerder bewezen hart- en vaatziekten en/of chronische nierschade hebben zowel SGLT2-remmers als GLP1-receptoragonisten klinisch relevante effecten op totale sterfte, eindstadium nierfalen, en niet-fataal hartinfarct. SGLT2-remmers hebben daarnaast klinisch relevante effecten op ziekenhuisopnames voor hartfalen, terwijl GLP1-receptoragonisten een klinisch relevant effect op niet-fatale beroerte hebben. In tabel 5 worden de belangrijke uitkomsten weergegeven indien 1000 mensen met eerder bewezen hart- en vaatziekten en/of chronische nierschade gedurende 5 jaar worden behandeld (Palmer, 2021). Het uitgangsrisico is gebaseerd op Risk Equations for Complications Of type 2 Diabetes (RECODe; Basu, 2017, 2018). De number needed to treat (NNT 5 jaar) is weergegeven voor de afzonderlijke uitkomstmaten. Omdat patiënten met een hoog tot zeer risico op (recidief) hart- en vaatziekten kans hebben op meerdere uitkomsten gedurende de follow-upperiode, is de NNT aanzienlijk lager indien de belangrijkste uitkomsten gecombineerd in ogenschouw worden genomen: de schatting hiervan varieert tussen de 7-22 patiënten die gedurende 5 jaar behandeld dienen te worden om 1 van die uitkomsten te voorkomen. Bij patiënten met DM type 2 met een lager risico op hart- en vaatziekten zijn deze gunstige effecten (uitgedrukt als NNT 5 jaar) beduidend kleiner (hogere NNT) en daarom vooralsnog niet klinisch relevant. Zoals benoemd selecteerde de richtlijncommissie bij het definiëren van de patiëntenpopulatie die in aanmerking dient te komen voor een SGLT2-remmer of GLP1-receptoragonist een enigszins andere groep met chronische nierschade dan de netwerk meta-analyse van Palmer (2021). Desondanks is de richtlijncommissie van mening dat het aannemelijk is dat de resultaten niet heel anders zouden zijn als Palmer (2021) een andere definitie van chronische nierschade had gebruikt. Dit kan echter niet met zekerheid gezegd worden.
Tabel 5. Belangrijke uitkomsten indien 1000 mensen met eerder bewezen hart- en vaatziekten en/of chronische nierschade gedurende 5 jaar worden behandeld.
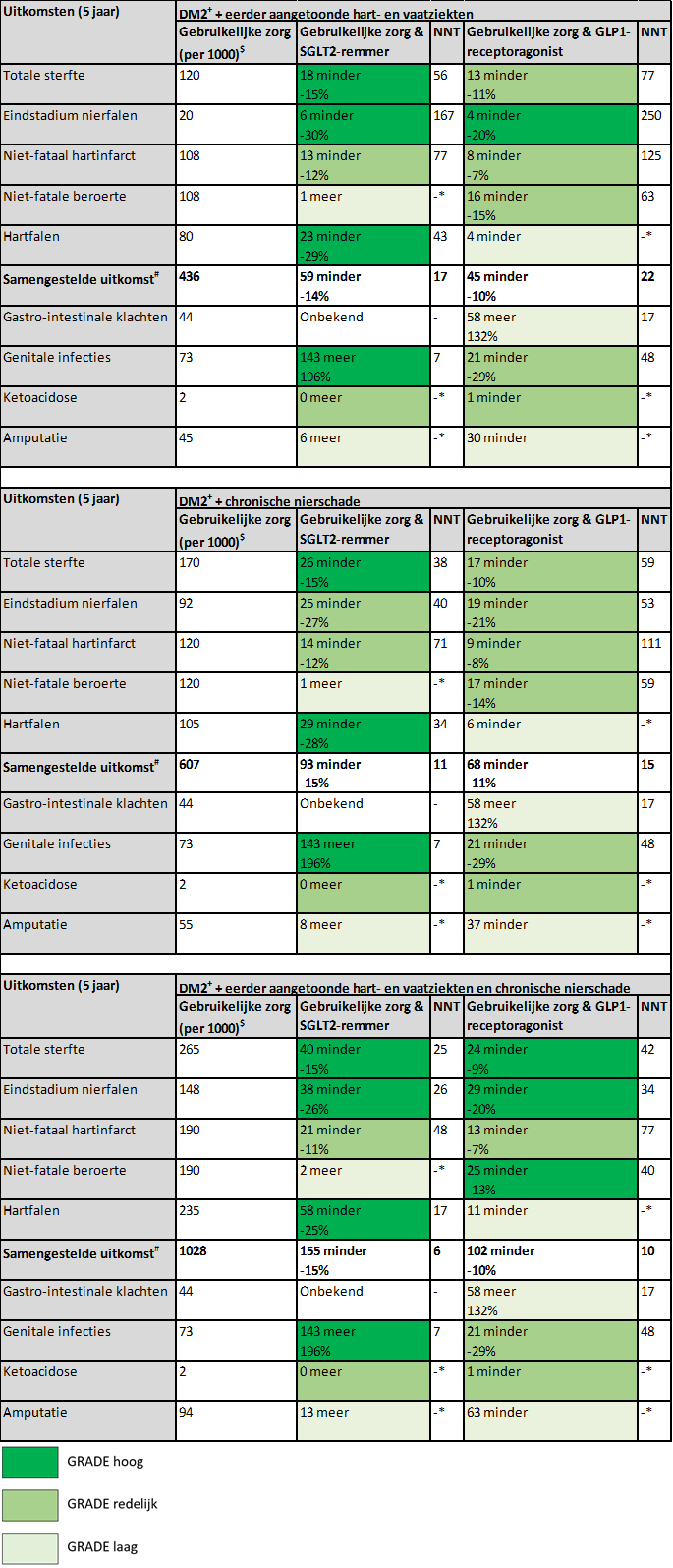
$ Uitgangsrisico gebaseerd op RECODe
* Statistisch niet-significant effect
# Samengestelde uitkomst van totale sterfte, eindstadium nierfalen, niet-fataal hartinfarct, niet-fatale beroerte en hartfalen (geen GRADE-beoordeling)
NNT, number needed to treat (voor een (extra) gunstige uitkomst, of voor een (extra) ongunstige uitkomst)
+ Patiënten met DM type 2
Palmer (2021) berekent een overall (niet gestratificeerde) oddsratio om daarmee de NNT’s te berekenen voor de verschillende risicogroepen, waarbij de baselinerisico’s verschillen. Tsapas (2021) voerde een vergelijkbare netwerk meta-analyse uit, waarbij er wel werd gestratificeerd voor baselinerisico. De methode die Palmer (2021) volgt, wordt gesteund door resultaten uit een studie van Furukawa (2001). Zij hebben diverse meta-analyses bekeken, waarbij ze de oddsratio’s (OR), relatieve risico’s (RR) en risicoverschillen (RD) zoals gerapporteerd in de meta-analyse vergeleken met de gerapporteerde OR, RR of RD in de afzonderlijke trials. Vervolgens hebben ze gekeken in hoeverre deze uitkomsten van elkaar verschilden. Uit deze studie is gebleken dat de effectmaten in hoge mate overeenkwamen, ook als er sprake was van een verschil in baselinerisico. De auteurs concluderen op basis van deze gegevens dat met name de OR (random effects/fixed effects models) en RR (random effects models) redelijk constant blijven, ondanks verschillen in baselinerisico. Tsapas (2021) geeft overigens zelf als een belangrijke limitatie aan dat de stratificatie op cardiovasculair risico eigenlijk niet mogelijk was, omdat er sprake was van inconsistente definities van cardiovasculair risico tussen de studies van de netwerk meta-analyse. Ook geeft Tsapas (2021) als limitatie aan dat door de data op te delen aan de hand van onderliggend cardiovasculair risico er een lage bewijskracht ontstaat omdat de aantallen te klein worden in subgroepanalyses. De netwerk meta-analyse van Tsapas werd overigens gefinancierd door de farmaceutische industrie en die van Palmer niet.
Veiligheid van SGLT2-remmers
In de netwerk meta-analyse (Palmer, 2021) werden (euglykemische) ketoacidose en (mycotische) genitale infecties als bijwerkingen gerapporteerd bij SGLT2-remmers (tabel 5). Er is sprake van een klinisch relevante toename in (mycotische) genitale infecties (143 (119-170) per 1000 mensen meer na 5 jaar behandeling), maar geen klinisch relevante toename van (euglykemische) ketoacidose (0 (1 minder tot 2 meer) per 1000 mensen meer na 5 jaar behandeling). Niettemin dienen gezien het mogelijk (kleine) risico op (euglykemische) ketoacidose de risicofactoren en symptomen van (euglykemische) ketoacidose met de patiënt besproken te worden. Informeer de patiënt over de noodzaak om inname van de SGLT2-remmer (tijdelijk) te staken bij elke situatie waarin de voedselinname fors verminderd is, bij koortsende ziekte, misselijkheid, braken, diarree, extreme dorst bij een chirurgische ingreep, en om in deze gevallen contact op te nemen met de behandelend arts. Wees terughoudend met het gebruik van SGLT2-remmers indien er een verhoogd risico is op ketoacidose, zoals bij alcoholisme, ondervoeding (gewichtsverlies van > 5% binnen 1 maand of > 10% binnen 6 maanden en/of een te laag lichaamsgewicht (18-65 jaar: BMI < 18,5 en > 65 jaar: BMI < 20 (Artsenwijzer Diëtiek)), intermitterend vasten of een sterk koolhydraat beperkt dieet (< 70 gram koolhydraten per dag). Er was weinig tot geen bewijs voor de effecten van SGLT2-remmers op amputatie, blindheid, oogaandoeningen die interventie behoeven, gangreen van Fournier en neuropathische pijn.
De combinatie perifeer vaatlijden en DM type 2 geeft een additief sterk verhoogd risico op sterfte aan hart- en vaatziekten, hartinfarct of ischemische beroerte, hartfalen en amputaties ten opzichte van mensen met slechts 1 van deze aandoeningen (Bonaca, 2018). SGLT2-remmers verlagen aangetoond de sterfte aan hart- en vaatziekten, hartinfarct, beroerte, hartfalen, en eindstadium nierfalen (Palmer, 2021). In het CANVAS (Canagliflozin cardiovascular assessment study)-programma, werd echter een tweevoudig verhoogd risico op amputatie gevonden. De resultaten van CREDENCE (Canagliflozin and Renal Events in Diabetes with Established Nephropathy Clinical Evaluation), die ook canagliflozine versus placebo onderzocht, liet geen verhoogd risico zien op amputatie. De cardiovasculaire veiligheidsstudies met empagliflozine, dapagliflozine, en ertugliflozine toonden ook geen verhoogd risico op amputaties. De netwerk meta-analyse (Palmer, 2021) geeft aan dat behandeling met SGLT2-remmers mogelijk resulteert in een toename in het aantal amputaties: afhankelijk van de risicogroep (eerder bewezen hart- en vaatziekten, chronische nierschade, of beide) 6-13 extra amputaties per 1000 mensen na 5 jaar behandeling. De effectschattingen zijn echter erg onprecies; de betrouwbaarheidsintervallen lopen van 2-4 minder amputaties tot 16-23 meer amputaties, en de bewijskracht volgens GRADE is laag. Men dient zich niettemin bewust te zijn van deze mogelijke bijwerking, ook al is er (nog) geen causaal verband aangetoond. Post-hoc studies van de EMPA-REG en DECLARE-TIMI 58 bevestigen dat de patiënten met perifeer vaatlijden een sterk verhoogd risico hebben op sterfte aan hart- en vaatziekten, hartfalen en chronische nierschade, maar net zoveel baat hadden bij behandeling met een SGLT2-remmer als patiënten zonder perifeer vaatlijden. Het aantal amputaties was hoger bij patiënten met perifeer vaatlijden, maar hing niet samen met het empagliflozine- of dapagliflozinegebruik (Bonaca, 2020; EMA, 2017). In DECLARE-TIMI 58 en EMPAREG was perifeer vaatlijden een belangrijk inclusiecriterium. Zelfs in CREDENCE was perifeer vaatlijden geen exclusiecriterium. Wel werd in de CREDENCE het gebruik van canagliflozine gestaakt bij symptomen die het amputatierisico mogelijk verhogen, zoals een ulcus en/of wondinfectie. Bij ontstaan van een voetulcus/wondinfectie dient de SGLT2-remmer daarom te worden gestaakt, maar SGLT2-remmers zijn niet gecontra-indiceerd bij perifeer vaatlijden.
Er zijn meldingen van gangreen van Fournier bij gebruik van SGLT2-remmers met de werkzame stof canagliflozine, dapagliflozine, empagliflozine of ertugliflozine. Gangreen van Fournier is een zeldzame, maar ernstige en mogelijk levensbedreigende infectie. Het risico op gangreen van Fournier is ook opgenomen in de bijsluiter (CBG, 2019). In de netwerk meta-analyse (Palmer, 2021) is er mogelijk geen effect op gangreen van Fournier: 0 minder (1 minder tot 18 meer) per 1000 mensen na 5 jaar behandeling (bewijskracht volgens GRADE: laag). Men dient zich niettemin bewust te zijn van deze mogelijke bijwerking, ook al is er (nog) geen causaal verband aangetoond (Bersoff-Matcha, 2019). Behandelaars wordt geadviseerd om bij het vermoeden op gangreen van Fournier te stoppen met het gebruik van SGLT2-remmers en onmiddellijk te starten met een gerichte behandeling. Verder is er geen verhoogd risico op botfracturen (Cheng, 2019).
Veiligheid GLP1-receptoragonisten
In de netwerk meta-analyse (Palmer, 2021) werden ernstige gastro-intestinale bijwerkingen (in de onderliggende studies gedefinieerd als misselijkheid, braken, diarree, verminderde eetlust, buikklachten) gerapporteerd bij GLP1-receptoragonisten. Er is sprake van een klinisch relevante toename van ernstige gastro-intestinale bijwerkingen (58 (9-142) per 1000 mensen meer na 5 jaar behandeling). GLP1-receptoragonisten hebben mogelijk geen effect op pancreatitis (1 (1 minder tot 3 meer) per 1000 personen na 5 jaar behandeling) en pancreascarcinoom (1 (1 minder tot 3 meer) per 1000 personen na 5 jaar behandeling; bewijskracht volgens GRADE: redelijk). Galblaasaandoeningen, zoals cholelithiasis en acute cholecystitis, worden niet genoemd in de netwerk meta-analyse, maar er zijn aanwijzingen dat deze vaker voorkomen bij GLP1-receptoragonistgebruik (Nauck, 2019; Nreu, 2020). Een recente meta-analyse rapporteert een verhoogd risico op cholelithiase (oddsratio (OR) 1,28; 95%-BI 1,11-1,48) (Nreu, 2020). Het betreft een relatief klein risico: in de LEADER-trial (Marso, 2016a) betrof het 3,1% van de patiënten (141-145 van totaal 4668 patiënten) in de liraglutide-arm die een vorm van galblaasaandoening (cholelithiase, cholecystitis) kreeg versus 1,9% in de controle-arm (88 van in totaal 4672 patiënten; hazardratio (HR) 1,60; 95%-BI 1,23-2,09). Het mechanisme hiervan is onduidelijk, maar hangt mogelijk samen met gewichtsverlies of directe effecten van GLP1-receptoragonisten op de galblaasmotiliteit. Een onverwacht veiligheidssignaal dat uit de SUSTAIN 6 naar voren kwam, was dat van verhoogd risico op diabetische retinopathie bij deelnemers aan de studie die gerandomiseerd waren naar semaglutide (Marso, 2016b). Diabetische retinopathie werd significant vaker gemeld bij personen gerandomiseerd naar semaglutide (50 proefpersonen, 3,0%) dan naar placebo (29 proefpersonen, 1,8%; p = 0,02). Dit resultaat heeft terecht geleid tot veel extra onderzoek. Visbøll et al. (2018) voerden een gedetailleerde evaluatie uit van het gehele SUSTAIN clinical trial programma. In de SUSTAIN 1–5 was geen sprake van een verhoogd risico op verslechtering van de diabetische retinopathie. Opgemerkt werd dat in deze studies patiënten met bestaande diabetische retinopathie die actieve medische behandeling nodig hadden, werden uitgesloten en dat deze onderzoeken ook een bovengrens van HbA1c (86-91 mmol/mol) hadden voor opname. Een groot deel van het verhoogde risico op diabetische retinopathie van semaglutide in SUSTAIN 6 kon worden toegeschreven aan de snelheid en mate van HbA1c-reductie tijdens de eerste 16 weken van de studie. Bovendien werd deze complicatie alleen gezien bij personen met reeds bestaande diabetische retinopathie, een hoog HbA1c bij aanvang, en behandeling met insuline. Bij een patiënt met diabetische retinopathie dient de behandelend arts alert te zijn op toename van de retinopathie en is extra monitoring nodig. Zie verder de richtlijn over Diabetische nefropathie (NIV, 2017).
Voorstel wijziging NHG-Standaard Diabetes mellitus type 2 ten aanzien van de behandeling van patiënten met een zeer hoog risico op hart- en vaatziekten
De richtlijnwerkgroep stelt op basis van bovenstaande bevindingen en afwegingen een uitbreiding van het medicamenteuze stappenplan voor: in de NHG-Standaard Diabetes mellitus type 2 is een indicatie gecreëerd voor zowel SGLT2-remmers als GLP1-receptoragonisten bij de behandeling van patiënten met DM type 2 en eerder aangetoonde hart- en vaatziekten en/of chronische nierschade. Voor alle andere patiënten blijft de NHG-Standaard Diabetes mellitus type 2 (NHG, 2018) onveranderd gehandhaafd.
Het merendeel van patiënten met DM type 2 en eerder bewezen hart- en vaatziekten en/of chronische nierschade en/of hartfalen zal inmiddels worden behandeld volgens het medicamenteuze stappenplan conform de NHG-Standaard uit 2018. Het nieuwe advies is om bij deze patiënten - bij een HbA1c-waarde > 53 mmol/mol en indien hiervoor geen contra-indicaties bestaan - een SGLT2-remmer toe te voegen aan de bestaande medicatie. Afhankelijk van de HbA1c-streefwaarde dient andere glucoseverlagende medicatie te worden aangepast om hypoglykemie te voorkomen.
SGLT2-remmers en GLP1-receptoragonisten zijn niet direct (head to head) met elkaar vergeleken. De richtlijncommissie geeft de voorkeur aan SGLT2-remmers, omdat een indirecte vergelijking van het effect op relevante uitkomsten gunstiger uitvalt voor de SGLT2-remmers in vergelijking tot GLP1-receptoragonisten (tabel 5). Bovendien zijn SGLT2-remmers goedkoper en oraal in te nemen, terwijl de meeste GLP1-receptoragonisten subcutaan dienen te worden toegediend. Bij contra-indicaties voor SGLT2-remmers hebben GLP1-receptoragonisten de voorkeur. Hierbij wordt het BMI-criterium > 30 losgelaten bij patiënten met DM type 2 en eerder bewezen hart- en vaatziekten en/of chronische nierschade. De gunstige cardiovasculaire effecten van GLP1-receptoragonisten zijn vergelijkbaar bij een BMI < 30 ten opzichte van een BMI ≥ 30 (Mannucci 2020). Indien het enige ingangscriterium hartfalen is (HFrEF met linkerventrikelejectiefractie < 40% zonder eerder bewezen hart- en vaatziekten en/of chronische nierschade), is de toegevoegde waarde van een GLP1-receptoragonist nog onduidelijk (Seferović, 2020); in dat geval kan elke ander vorm van glucoseverlagende medicatie worden gestart. Indien na de toevoeging van de SGLT2-remmer aan de bestaande medicatie de HbA1c-streefwaarde niet wordt behaald of na enige tijd wederom gestegen is, overweeg dan toevoeging van een middel dat het risico op hart- en vaatziekten aangetoond verlaagt, zoals een GLP1-receptoragonist. De keuze zal hier dus vooral geschieden op basis van individuele voordelen van middelen en het glucoseverlagende effect, waarbij GLP1-receptoragonisten aangetoonde verlaging van het risico op hart- en vaatziekten en sterfte als voordeel hebben naast een goed glucoseverlagend effect en gunstige effecten op het gewicht. Bij patiënten met specifiek een zeer hoog risico op CVA, kan men laten meewegen dat uit de literatuuranalyse bleek dat GLP1-receptoragonisten een voordeel bieden ten opzichte van SGLT2-remmers voor niet-fatale beroertes (16-27 minder per 1000 personen).
De minderheid van de patiënten met DM type 2 en eerder bewezen hart- en vaatziekten en/of chronische nierschade zal nog niet medicamenteus worden behandeld met glucoseverlagende therapie. Start in deze groep, indien het HbA1c > 53 mmol/mol bedraagt, bij voorkeur behandeling met een SGLT2-remmer, tenzij er contra-indicaties bestaan. De richtlijncommissie heeft hier gekozen voor een SGLT2-remmer in plaats van metformine als eerste keus. De bewijslast van hoge kwaliteit van effecten op de relevante eindpunten zoals eindstadium nierfalen, en ziekenhuisopnames voor hartfalen is voor SGLT2-remmers voorhanden, maar er is weinig zekerheid dat metformine een verschil maakt op deze uitkomsten (Palmer, 2018). Hoewel 58-82% van de patiënten in de cardiovasculaire veiligheidsstudies met SGLT2-remmers en GLP1-receptoragonisten ook metformine gebruikte, suggereert een recente meta-analyse dat de gunstige effecten van beide middelen op cardiovasculaire sterfte, niet-fataal hartinfarct, en niet-fatale beroerte onafhankelijk zijn van het metforminegebruik (Zaccardi, 2021). Een ander recente meta-analyse (Neuen, 2021b) toont dit ook voor de renale uitkomsten. Bovendien zijn er inmiddels studies verschenen waarbij de gunstige effecten van SGLT2-remmers op totale sterfte, eindstadium nierfalen en hartfalen zijn aangetoond in mensen zonder diabetes (en dus ook zonder metforminegebruik; de DAPA-HF studie, McMurray, 2019; DAPA-CKD, Heerspink, 2020; EMPEROR, Packer, 2020). Bovendien kent de bewijsvoering over de gunstige effecten van metformine op het voorkomen van hart- en vaatziekten beperkingen. Het bewijs voor metformine in onderzoek verband is van veel lagere kwaliteit dan dat van de cardiovasculaire uitkomststudies van SGLT2-remmers en GLP1-receptoragonisten.UKPDS was een post-hoc geneste case-control analyse met een onderzoeksopzet zonder powerberekening op uitkomsten (UKPDS group, 1998). In een deelonderzoek van de UKPDS-trial waarin slechts 342 patiënten werden behandeld met metformine hadden patiënten met obesitas en DM type 2 een 32% lager risico op een aan diabetesgerelateerde (voornamelijk vasculaire) uitkomstmaat, vergeleken met een conventionele behandeling die voornamelijk bestond uit dieetaanpassingen. Het effect van metformine op afzonderlijke microvasculaire uitkomstmaten was niet statistisch significant. Het onderzoek was niet geblindeerd en cardiovasculair risicomanagement op het gebied van cholesterolverlaging (met statines) en bloeddrukregulatie (met ACE-remmers en angiotensine II-receptorantagonisten) was destijds nog ongebruikelijk.
Indien tijdens behandeling met de SGLT2-remmer de individuele HbA1c-streefwaarde niet wordt behaald, wordt in stap 2 geadviseerd metformine toe te voegen. De richtlijncommissie heeft hier voor metformine gekozen, omdat de meeste patiënten in de cardiovasculaire veiligheidsstudies eveneens metformine gebruikten, en GLP1-receptoragonisten veel duurder zijn dan metformine.
Indien deze combinatie onvoldoende effect heeft op de glucoseregulatie, overweeg dan in stap 3 toevoeging van een middel dat aantoonbaar het risico op hart- en vaatziekten verlaagt, zoals een GLP1-receptoragonist. Is er sprake van een zeer hoog risico alleen vanwege hartfalen, dan is er geen aangetoond voordeel van een GLP1-receptoragonist op harde eindpunten. De combinatie van SGLT2-remmers met GLP1-receptoragonisten is specifiek onderzocht in enkele klinische studies (onder andere DURATION 8, SUSTAIN 9 en AWARD 10; Frías,2016; Ludvik, 2018; Zinman, 2019). Effecten op HbA1c, gewicht en bloeddruk zijn additief. Afzonderlijk hebben GLP1-receptoragonisten en SGLT2-remmers positieve effecten op harde eindpunten (Palmer, 2021), maar de combinatie is niet speciaal onderzocht in cardiovasculaire veiligheidsstudies. Er is wel een speciale subgroepanalyse gedaan van de EXSCEL-trial (Clegg, 2019). Deze trial onderzocht gerandomiseerd het effect van exenatide, maar sommige patiënten kregen tijdens de trial een SGLT2-remmer erbij. Deze patiënten deden het beter dan de patiënten op monotherapie met exenatide. Het risico op MACE was 15% lager (statistisch niet significant), het risico op totale mortaliteit was 59% lager (p < 0,05). Deze analyse geeft wel wat richting over de mogelijke additieve waarde van combinatietherapie voor cardiovasculaire eindpunten. Een zeer recent observationeel onderzoek (Dave, 2021) geeft eveneens ondersteuning aan deze gedachte. Onder 12.584 propensity score-gematchte paren (gemiddelde [SD] leeftijd: 58,3 [10,9] jaar; 48,2% mannelijk), waren er 107 samengestelde MACE-eindpunten (incidentie per 1000 persoonsjaren: 9,9; 95%-BI 8,1-11,9]) onder SGLT2-remmer- + GLP1-receptoragonistgebruikers in vergelijking met 129 voorvallen (incidentie per 1000 persoonsjaren: 13,0; 95%-BI 10,9-15,3]) onder sulfonylureum- + GLP1-receptoragonistgebruikers, overeenkomend met een gepoolde HR van 0,76 (95%-BI 0,59-0,98); deze afname van samengesteld cardiovasculair eindpunt werd veroorzaakt door numerieke afnames van het risico op hartinfarct (HR 0,71; 95%-BI 0,51-1,003]) en totale sterfte (HR, 0,68; 95%-BI 0,40-1,14) maar niet van beroerte (HR 1,05; 95%-BI 0,62-1,79). Bovenstaande vindt de richtlijncommissie onvoldoende voor stap 2, maar voldoende voor stap 3. Voor alternatieve middelen is immers helemaal geen bewijs.
Indien deze stap 3 onvoldoende effect heeft op de glucoseregulatie, zie dan voor verdere mogelijkheden stap 4 voor de medicamenteuze adviezen voor laagrisicopatiënten in de NHG-Standaard (NHG, 2018). Toevoeging van een dipeptidylpeptidase-4-remmer (DPP4-remmer) aan een GLP1-receptoragonist wordt als niet doelmatig beschouwd.
Effectiviteit: klasse-effect versus specifieke middelen
Een gedegen onderbouwing is alleen mogelijk op groepsniveau (meta-analyse). Bij het maken van het stappenplan is met name gebruik gemaakt van een netwerk meta-analyse waarin de effecten van verschillende SGLT2-remmers en verschillende GLP1-receptoragonisten werden gecombineerd. Er is veel overlap in de aangetoonde voor- en nadelen van de individuele middelen binnen elke groep.
Alle SGLT2-remmers en GLP1-receptoragonisten verlagen het HbA1c en gewicht. Bij de GLP1-receptoragonisten zijn langwerkende preparaten (liraglutide, dulaglutide, semaglutide, en exenatide (verlengde werking)) effectiever in het verlagen van het HbA1c en gewicht dan de kortwerkende preparaten (lixisenatide, exenatide (tweemaal daags); Huthmacher, 2020).
De afzonderlijke cardiovasculaire en renale uitkomststudies laten statistisch significante effecten op harde eindpunten zien voor enkele individuele middelen. De SGLT2-remmers canagliflozine en empagliflozine hebben een aangetoond voordeel op ‘major adverse cardiovascular events’ (MACE; niet-fataal hartinfarct, niet-fatale beroerte, sterfte aan hart- en vaatziekten), hartfalen en nierfalen. Empagliflozine toont in de afzonderlijke uitkomststudie eveneens een voordeel op totale sterfte. Dapagliflozine heeft een aangetoond voordeel op hartfalen en nierfalen. Ertugliflozine heeft een aangetoond voordeel op hartfalen. De GLP1-receptoragonisten liraglutide, dulaglutide en semaglutide (subcutaan) hebben een aangetoond voordeel op MACE. Liraglutide en exenatide (verlengde werking) tonen in de afzonderlijke uitkomststudies eveneens een aangetoond voordeel op totale sterfte. De onderzoeksopzet verschilde tussen de aangehaalde studies. Ook waren er verschillen ten aanzien van onder andere de geïncludeerde patiëntenpopulatie en de duur van de studies. Dit zou de verschillende resultaten voor een deel kunnen verklaren. Oraal semaglutide is pas kort op de markt en de uitkomsten van de belangrijke cardiovasculaire uitkomststudie (SOUL; ClinicalTrials.gov NCT03914326) volgen over enkele jaren. Wellicht ten overvloede: in een meta-analyse is de grootte van de gunstige effecten op MACE en totale sterfte onderling vergelijkbaar voor de langwerkende GLP1-receptoragonisten bij mensen met reeds aangetoonde hart- en vaatziekten (Mannucci, 2020). Ook voor SGLT2-remmers is de grootte van de gunstige effecten op MACE, totale sterfte, hospitalisatie voor hartfalen en nieruitkomsten onderling vrij consistent in een recente meta-analyse (Salah, 2021).
Onderbouwing
Achtergrond
Het primaire doel van de behandeling van DM type 2 is het voorkomen van complicaties, zoals hart- en vaatziekten, nierfalen, blindheid en amputaties, met als resultaat een verbeterde kwaliteit van, en indien mogelijk, langer leven. Recente cardiovasculaire veiligheidsstudies geven aan dat glucoseverlaging met SGLT2-remmers en GLP1-receptoragonisten mogelijk voordelen bieden in het voorkomen van deze complicaties bij mensen met DM type 2 en een zeer hoog risico op hart- en vaatziekten volgens de CVRM-richtlijn (NHG/NIV/NVvC, 2019). De uitgangsvraag richt zich dan ook op de positie van SGLT2-remmers en GLP1-receptoragonisten in het stappenplan voor de medicamenteuze behandeling van patiënten met DM type 2 met een zeer hoog risico op hart- en vaatziekten.
Conclusies
See table 2-4 for summary of findings. Plain text conclusions are reproduced below.
Risk category: Adults with Diabetes mellitus type 2 and established CVD (but no CKD)
|
Moderate GRADE |
There probably is little or no difference in the risk of death between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Moderate GRADE |
There probably is little or no difference in the risk of cardiovascular death between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Moderate GRADE |
There probably is little or no difference in the risk of nonfatal myocardial infarction between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Moderate GRADE |
GLP-1 receptor agonists probably reduce the risk of nonfatal stroke compared with SGLT2 inhibitors. Sources: Palmer, 2021 |
|
High GRADE |
There is little or no difference in the risk of end-stage kidney disease between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
High GRADE |
SGLT2 inhibitors reduce the risk of hospital admission for heart failure compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
No GRADE |
We are uncertain of the effects of GLP-1 receptor agonists on MACE, acute kidney failure (sudden loss of kidney function requiring hospitalization) and composite renal outcome (40% reduction in eGFR relative to baseline, endstage kidney failure or death as a result of kidney failure) compared with standard care. These endpoints were not reported.
Sources: Palmer, 2021 |
|
Moderate GRADE |
SGLT2 inhibitors probably increase the risk of diabetic ketoacidosis slightly compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
High GRADE |
SGLT2 inhibitors increase the risk of genital infection compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Low GRADE |
GLP-1 receptor agonists may increase the risk of severe gastrointestinal events compared with SGLT2 inhibitors. Sources: Palmer, 2021 |
Risk category: Adults with Diabetes mellitus type 2 and chronic kidney disease (but no CVD)
|
Moderate GRADE |
There probably is little or no difference in the risk of death between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Moderate GRADE |
There probably is little or no difference in the risk of cardiovascular death between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Moderate GRADE |
There probably is little or no difference in the risk of nonfatal myocardial infarction between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Moderate GRADE |
GLP-1 receptor agonists probably reduce the risk of nonfatal stroke compared with SGLT2 inhibitors. Sources: Palmer, 2021 |
|
Low GRADE |
There may be little or no difference in the risk of end-stage kidney disease between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
High GRADE |
SGLT2 inhibitors reduce the risk of hospital admission for heart failure compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
No GRADE |
We are uncertain of the effects of GLP-1 receptor agonists on MACE, acute kidney failure (sudden loss of kidney function requiring hospitalization) and composite renal outcome (40% reduction in eGFR relative to baseline, endstage kidney failure or death as a result of kidney failure) compared with standard care. These endpoints were not reported.
Sources: Palmer, 2021 |
|
Moderate GRADE |
SGLT2 inhibitors probably increase the risk of diabetic ketoacidosis slightly compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
High GRADE |
SGLT2 inhibitors increase the risk of genital infection compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Low GRADE |
GLP-1 receptor agonists may increase the risk of severe gastrointestinal events compared with SGLT2 inhibitors. Sources: Palmer, 2021 |
Risk category: Adults with Diabetes mellitus type 2 and CVD and CKD
|
Low GRADE |
SGLT2 inhibitors may reduce the risk of death compared with GLP-1 receptor agonists.Sources: Palmer, 2021 |
|
Low GRADE |
There may be little or no difference in the risk of cardiovascular death between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Low GRADE |
There may be little or no difference in the risk of nonfatal myocardial infarction between SGLT2 inhibitors and GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Moderate GRADE |
GLP-1 receptor agonists probably reduce the risk of nonfatal stroke compared with SGLT2 inhibitors. Sources: Palmer, 2021 |
|
Low GRADE |
SGLT2 inhibitors may reduce the risk of end-stage kidney disease compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
High GRADE |
SGLT2 inhibitors reduce the risk of hospital admission for heart failure compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
No GRADE |
We are uncertain of the effects of GLP-1 receptor agonists on MACE, acute kidney failure (sudden loss of kidney function requiring hospitalization) and composite renal outcome (40% reduction in eGFR relative to baseline, endstage kidney failure or death as a result of kidney failure) compared with standard care. These endpoints were not reported.
Sources: Palmer, 2021 |
|
Moderate GRADE |
SGLT2 inhibitors probably increase the risk of diabetic ketoacidosis slightly compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
High GRADE |
SGLT2 inhibitors increase the risk of genital infection compared with GLP-1 receptor agonists. Sources: Palmer, 2021 |
|
Low GRADE |
GLP-1 receptor agonists may increase the risk of severe gastrointestinal events compared with SGLT2 inhibitors. Sources: Palmer, 2021 |
Samenvatting literatuur
Description of studies
Palmer (2021) performed a frequentist random effects network meta-analysis and used GRADE to assess evidence certainty. The network compares 11 glucose lowering drugs, placebo, or standard care (for network plot see Fig. 1). For details see the module SGLT-2-inhibitors, and the module GLP-1 receptor agonists.
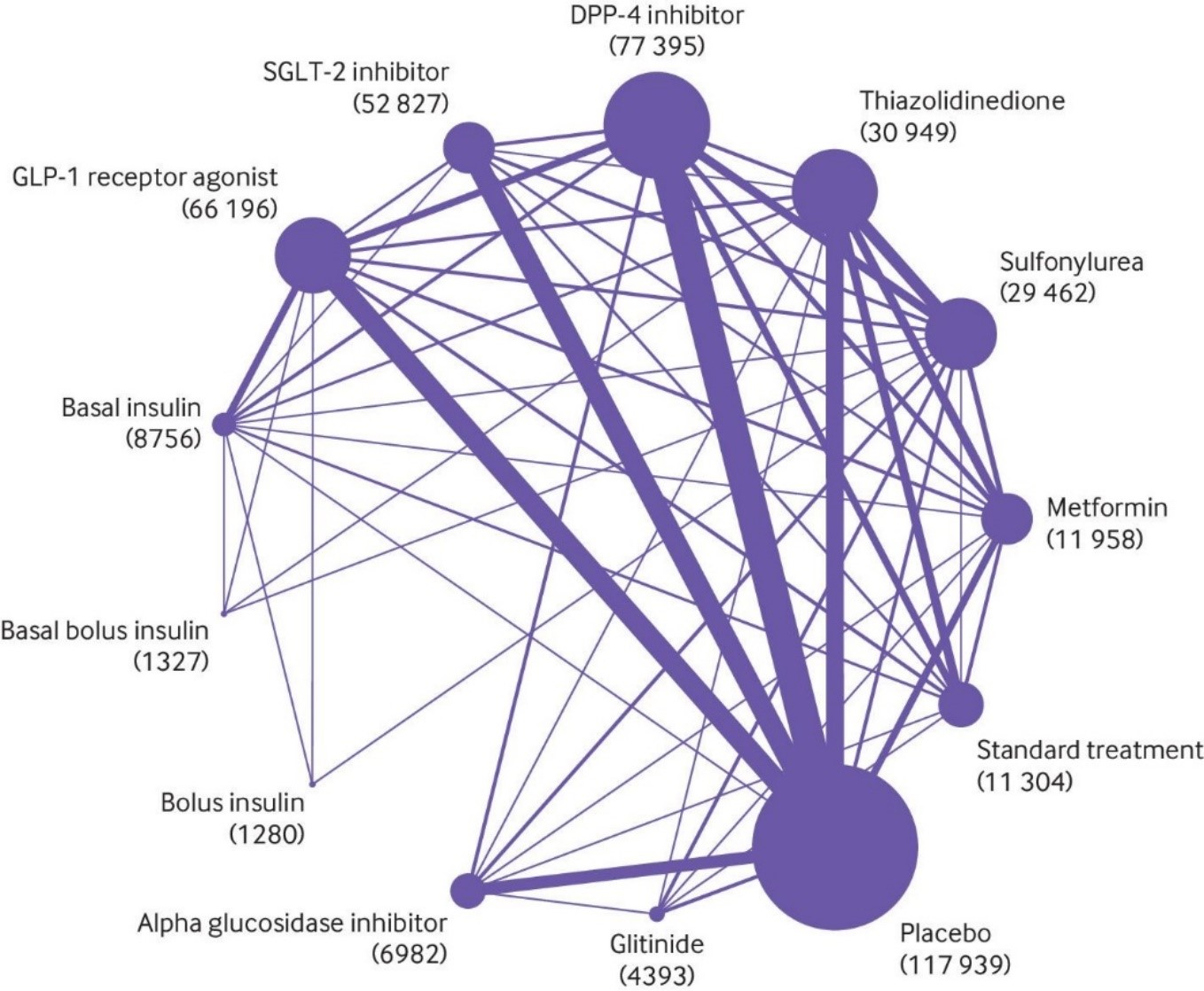
Figure 1 Network plot of trials evaluating glucose lowering treatments for Diabetes mellitus type 2 (reproduced from Palmer, 2021). The size of each circle is proportional to the number of randomly assigned participants in the treatment comparisons (sample size shown in brackets). Line widths are proportional to the number of trials comparing the corresponding pair of treatments.
Results (effects of interventions)
All results refer to the addition of SGLT2 inhibitors and GLP-1 receptor agonists to existing diabetes treatment. The authors developed evidence summaries and decision aids in MAGICapp, including an interactive decision support tool for multiple treatment choices.
The summary of findings tables below provide an overview of the relative and absolute effect estimates per risk category, together with a GRADE assessment of the certainty of the evidence. Most GRADE assessments are taken from Palmer (2021), in some instances the certainty of the evidence was (further) downgraded if an effect estimate overlapped with the decision threshold defined by the guideline development group (see the section Relevant outcome measures, earlier in the text). Note that a five year NNT 100 threshold (for potential benefits and mild side-effects) translates to a difference of 10 events per 1000 patients. A threshold at five year NNT 1000 (for serious harms) corresponds to a difference of 1 event per 1000 patients.
Table 2. Adults with Diabetes mellitus type 2 and established CVD (but no CKD)
Intervention: Sodium-Glucose Transport Protein 2 (SGLT2) inhibitors
Comparator: Glucagon-Like Peptide-1 (GLP-1) receptor agonists
|
Outcome Timeframe 5 yrs
|
Study results and measurements |
Absolute effect estimates |
Certainty of the Evidence |
Plain text summary |
|
|
GLP-1 receptor agonists |
SGLT2 inhibitors |
||||
|
Potential benefits |
|||||
|
All-cause mortality |
Odds Ratio 0.95 (CI 95% 0.86 – 1.06) |
107 per 1000 |
101 per 1000 |
Moderate Due to serious imprecision |
There probably is little or no difference in the risk of death between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 6 fewer per 1000 (CI 95% 17 fewer - 7 more) |
|||||
|
Cardiovascular mortality |
Odds Ratio 0.96 (CI 95% 0.84 - 1.09) |
70 per 1000 |
67 per 1000 |
Moderate Due to serious imprecision |
There probably is little or no difference in the risk of cardiovascular death between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 3 fewer per 1000 (CI 95% 11 fewer - 6 more) |
|||||
|
Nonfatal myocardial infarction |
Odds Ratio 0.95 (CI 95% 0.84 - 1.08) |
100 per 1000 |
95 per 1000 |
Moderate Due to serious imprecision |
There probably is little or no difference in the risk of nonfatal myocardial infarction between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 5 fewer per 1000 (CI 95% 15 fewer – 7 more) |
|||||
|
Nonfatal stroke |
Odds Ratio 1.2 (CI 95% 1.03 - 1.41) |
92 per 1000 |
108 per 1000 |
Moderate Due to serious imprecision |
GLP-1 receptor agonists probably reduce the risk of nonfatal stroke compared with SGLT2 inhibitors. |
|
Difference: 16 more per 1000 (CI 95% 2 more - 33 more) |
|||||
|
End-stage kidney disease |
Odds Ratio 0.91 (CI 95% 0.69 - 1.2) |
16 per 1000 |
15 per 1000 |
High |
There is little or no difference in the risk of end-stage kidney disease between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 1 fewer per 1000 CI 95% 5 fewer – 3 more) |
|||||
|
Hospital admission for heart failure |
Odds Ratio 0.74 (CI 95% 0.65 - 0.85) |
75 per 1000 |
57 per 1000 |
High
|
SGLT2 inhibitors reduce the risk of hospital admission for heart failure compared with GLP-1 receptor agonists. |
|
Difference: 18 fewer per 1000 (CI 95% 25 fewer - 11 fewer) |
|||||
|
Potential harms |
|||||
|
Diabetic ketoacidosis |
Odds Ratio 1.71 (CI 95% 0.79 - 3.69) |
1 per 1000 |
2 per 1000 |
Moderate
|
SGLT2 inhibitors probably increase the risk of diabetic ketoacidosis slightly compared with GLP-1 receptor agonists. |
|
Difference: 1 more per 1000 (CI 95% 0 fewer - 3 more) |
|||||
|
Genital infection |
Odds Ratio 5 (CI 95% 2.45 - 10.2) |
50 per 1000 |
208 per 1000 |
High |
SGLT2 inhibitors increase the risk of genital infection compared with GLP-1 receptor agonists. |
|
Difference: 158 more per 1000 (CI 95% 64 more –299 more) |
|||||
|
Severe gastro-intestinal events |
Odds Ratio 2.46 (CI 95% 1.22 - 4.97) |
102 per 1000 |
44 per 1000 |
Low Due to serious inconsistency, very serious imprecision |
GLP-1 receptor agonists may increase the risk of severe gastrointestinal events compared with SGLT2 inhibitors. |
|
Difference: 58 fewer per 1000 (CI 95% 9 more – 142 more) |
|||||
Table 3. Adults with Diabetes mellitus type 2 and chronic kidney disease (but no CVD)
Intervention: Sodium-Glucose Transport Protein 2 (SGLT2) inhibitors
Comparator: Glucagon-Like Peptide-1 (GLP-1) receptor agonists
|
Outcome Timeframe 5 yrs
|
Study results and measurements |
Absolute effect estimates |
Certainty of the Evidence |
Plain text summary |
|
|
GLP-1 receptor agonists |
SGLT2 inhibitors |
||||
|
Potential benefits |
|||||
|
All-cause mortality |
Odds Ratio 0.95 (CI 95% 0.86 – 1.06) |
153 per 1000 |
144 per 1000 |
Moderate Due to serious imprecision |
There probably is little or no difference in the risk of death between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 9 fewer per 1000 (CI 95% 24 fewer - 10 more) |
|||||
|
Cardiovascular mortality |
Odds Ratio 0.96 (CI 95% 0.84 - 1.09) |
100 per 1000 |
96 per 1000 |
Moderate Due to serious imprecision |
There probably is little or no difference in the risk of cardiovascular death between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 4 fewer per 1000 (CI 95% 15 fewer - 8 more) |
|||||
|
Nonfatal myocardial infarction |
Odds Ratio 0.95 (CI 95% 0.84 - 1.08) |
111 per 1000 |
106 per 1000 |
Moderate Due to serious imprecision |
There probably is little or no difference in the risk of nonfatal myocardial infarction between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 5 fewer per 1000 (CI 95% 16 fewer – 8 more) |
|||||
|
Nonfatal stroke |
Odds Ratio 1.2 (CI 95% 1.03 - 1.41) |
103 per 1000 |
121 per 1000 |
Moderate Due to serious imprecision |
GLP-1 receptor agonists probably reduce the risk of nonfatal stroke compared with SGLT2 inhibitors. |
|
Difference: 18 more per 1000 (CI 95% 3 more - 36 more) |
|||||
|
End-stage kidney disease |
Odds Ratio 0.91 (CI 95% 0.69 - 1.2) |
73 per 1000 |
67 per 1000 |
Low Due to very serious imprecision |
There may be little or no difference in the risk of end-stage kidney disease between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 6 fewer per 1000 CI 95% 21 fewer – 13 more) |
|||||
|
Hospital admission for heart failure |
Odds Ratio 0.74 (CI 95% 0.65 - 0.85) |
98 per 1000 |
74 per 1000 |
High
|
SGLT2 inhibitors reduce the risk of hospital admission for heart failure compared with GLP-1 receptor agonists. |
|
Difference: 24 fewer per 1000 (CI 95% 32 fewer - 13 fewer) |
|||||
|
Potential harms |
|||||
|
Diabetic ketoacidosis |
Odds Ratio 1.71 (CI 95% 0.79 - 3.69) |
1 per 1000 |
2 per 1000 |
Moderate
|
SGLT2 inhibitors probably increase the risk of diabetic ketoacidosis slightly compared with GLP-1 receptor agonists. |
|
Difference: 1 more per 1000 (CI 95% 0 fewer - 3 more) |
|||||
|
Genital infection |
Odds Ratio 5 (CI 95% 2.45 - 10.2) |
50 per 1000 |
208 per 1000 |
High |
SGLT2 inhibitors increase the risk of genital infection compared with GLP-1 receptor agonists. |
|
Difference: 158 more per 1000 (CI 95% 64 more –299 more) |
|||||
|
Severe gastro-intestinal events |
Odds Ratio 2.46 (CI 95% 1.22 - 4.97) |
102 per 1000 |
44 per 1000 |
Low Due to serious inconsistency, very serious imprecision |
GLP-1 receptor agonists may increase the risk of severe gastrointestinal events compared with SGLT2 inhibitors. |
|
Difference: 58 fewer per 1000 (CI 95% 9 more – 142 more) |
|||||
Table 4. Adults with Diabetes mellitus type 2 and CVD and CKD
Intervention: Sodium-Glucose Transport Protein 2 (SGLT2) inhibitors
Comparator: Glucagon-Like Peptide-1 (GLP-1) receptor agonists
|
Outcome Timeframe 5 yrs
|
Study results and measurements |
Absolute effect estimates |
Certainty of the Evidence |
Plain text summary |
|
|
GLP-1 receptor agonists |
SGLT2 inhibitors |
||||
|
Potential benefits |
|||||
|
All-cause mortality |
Odds Ratio 0.95 (CI 95% 0.86 – 1.06) |
241 per 1000 |
228 per 1000 |
Low Due to very serious imprecision |
SGLT2 inhibitors may reduce the risk of death compared with GLP-1 receptor agonists. |
|
Difference: 13 fewer per 1000 (CI 95% 37 fewer - 16 more) |
|||||
|
Cardiovascular mortality |
Odds Ratio 0.96 (CI 95% 0.84 - 1.09) |
157 per 1000 |
152 per 1000 |
Low Due to very serious imprecision |
There may be little or no difference in the risk of cardiovascular death between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 5 fewer per 1000 (CI 95% 22 fewer - 12 more) |
|||||
|
Nonfatal myocardial infarction |
Odds Ratio 0.95 (CI 95% 0.84 - 1.08) |
177 per 1000 |
170 per 1000 |
Low Due to very serious imprecision |
There may be little or no difference in the risk of nonfatal myocardial infarction between SGLT2 inhibitors and GLP-1 receptor agonists. |
|
Difference: 7 fewer per 1000 (CI 95% 24 fewer – 11 more) |
|||||
|
Nonfatal stroke |
Odds Ratio 1.2 (CI 95% 1.03 - 1.41) |
165 per 1000 |
192 per 1000 |
Moderate Due to serious imprecision |
GLP-1 receptor agonists probably reduce the risk of nonfatal stroke compared with SGLT2 inhibitors. |
|
Difference: 27 more per 1000 (CI 95% 4 more - 53 more) |
|||||
|
End-stage kidney disease |
Odds Ratio 0.91 (CI 95% 0.69 - 1.2) |
119 per 1000 |
109 per 1000 |
Low Due to very serious imprecision |
SGLT2 inhibitors may reduce the risk of end-stage kidney disease compared with GLP-1 receptor agonists. |
|
Difference: 10 fewer per 1000 CI 95% 34 fewer – 20 more) |
|||||
|
Hospital admission for heart failure |
Odds Ratio 0.74 (CI 95% 0.65 - 0.85) |
224 per 1000 |
176 per 1000 |
High
|
SGLT2 inhibitors reduce the risk of hospital admission for heart failure compared with GLP-1 receptor agonists. |
|
Difference: 48 fewer per 1000 (CI 95% 66 fewer - 27 fewer) |
|||||
|
Potential harms |
|||||
|
Diabetic ketoacidosis |
Odds Ratio 1.71 (CI 95% 0.79 - 3.69) |
1 per 1000 |
2 per 1000 |
Moderate
|
SGLT2 inhibitors probably increase the risk of diabetic ketoacidosis slightly compared with GLP-1 receptor agonists. |
|
Difference: 1 more per 1000 (CI 95% 0 fewer - 3 more) |
|||||
|
Genital infection |
Odds Ratio 5 (CI 95% 2.45 - 10.2) |
50 per 1000 |
208 per 1000 |
High |
SGLT2 inhibitors increase the risk of genital infection compared with GLP-1 receptor agonists. |
|
Difference: 158 more per 1000 (CI 95% 64 more –299 more) |
|||||
|
Severe gastro-intestinal events |
Odds Ratio 2.46 (CI 95% 1.22 - 4.97) |
102 per 1000 |
44 per 1000 |
Low Due to serious inconsistency, very serious imprecision |
GLP-1 receptor agonists may increase the risk of severe gastrointestinal events compared with SGLT2 inhibitors. |
|
Difference: 58 fewer per 1000 (CI 95% 9 more – 142 more) |
|||||
Level of evidence of the literature
The level (certainty) of evidence of the literature was assessed per outcome, using the GRADE methodology (see Tables 2-4). The evidence came from RCTs and therefore started at HIGH certainty. The level of evidence was downgraded to MODERATE, LOW or VERY LOW certainty, in case of risk of bias, inconsistency, indirectness, imprecision, or publication bias. Most GRADE assessments were reproduced from Palmer (2021), in some instances the certainty of the evidence was (further) downgraded if an effect estimate overlapped with the decision threshold defined by the guideline development group.
Zoeken en selecteren
The clinical question in the current module was answered based on the systematic reviews of the literature performed in the module SGLT-2-inhibitors, and the module GLP-1 receptor agonists.
Table 1. PICO (also see module SGLT-2-inhibitors, and module GLP-1 receptor agonists)
|
Patients |
Adult patients (18 years and older) with diabetes mellitus type 2 and very high cardiovascular risk according to the CVRM guideline (NHG/NIV/NVvC, 2019).* |
|
Intervention |
SGLT-2-inhibitors, monotherapy or added to metformin and/or any other combination of glucose-lowering medication. |
|
Control |
GLP-1 receptor agonists, monotherapy or added to metformin and/or any other combination of glucose-lowering medication. |
|
Outcomes |
Crucial outcomes: total mortality, cardiovascular mortality, non-fatal MI, non-fatal stroke, hospitalization for heart failure (as a marker for serious heart failure), MACE, endstage kidney failure (eGFR < 15 ml/min/1.73 m2 or start or renal replacement therapy), acute kidney failure (sudden loss of kidney function requiring hospitalisation), composite renal outcome (and individual components: 40% reduction in eGFR relative to baseline, endstage kidney failure or death as a result of kidney failure). Important outcomes: side-effects of medication (bone fractures, urinary tract infections, genital infections, ketoacidosis, amputations, Fournier’s syndrome; pancreatitis, pancreatic cancer, gallstone disease, serious gastrointestinal events). |
* Individuals with diabetes mellitus type 2 and overt cardiovascular disease; i.e. acute coronary syndrome, angina pectoris, coronary revascularisation, TIA or stroke, aorto-iliofemoral atherosclerosis, aorta-aneurysm, claudicatio intermittens or peripheral revascularisation; also atherosclerotic stenosis of ischemia based on imaging. In addition, individuals with diabetes mellitus type 2 and organ damage, e.g., chronic kidney damage, or in combination with an important risk factor such as smoking (despite smoking cessation advice), or serious hypercholesterolemia (TC > 8 mmol/l despite maximally attainable therapy) or serious hypertension (≥ 180 mmHg despite maximally attainable therapy). Chronic kidney damage: eGFR < 30 ml/min/1,73 m2; eGFR 30-59 ml/min/1,73 m2 met ACR > 3 mg/mmol; of eGFR ≥ 60 ml/min/1,73 m2 with ACR > 30 mg/mmol. ACR: albumin/creatinine ratio. The definition of individuals with Diabetes mellitus type 2 and CKD considered at very high cardiovascular risk in which SGLT-2-inhibitors should be considered is slightly modified as compared to the definitions used in the CVRM guideline (NHG/NIV/NVvC, 2019) and Diabetic nephropathy guideline (NIV, 2020).
Relevant outcome measures
The clinical question in the current module was answered based on the systematic reviews of the literature performed in the module SGLT-2-inhibitors, and the module GLP-1 receptor agonists, the reader is referred to these modules for more details.
The guideline development group considered a time horizon of five years and a number needed to treat (NNT) of 30 as an adequate threshold for clinical decision making for a composite outcome of all cardiovascular and renal endpoints together, because patients at high or very high cardiovascular risk may suffer any of the cardiovascular and renal endpoints during follow-up. These numbers needed to treat correspond to the thresholds used for broadly accepted treatments such as treatments with antihypertensive or cholesterol-lowering drugs, or treatment with anticoagulants after a stroke. For judgements on individual outcomes (such as total mortality, MI, stroke, heart failure and endstage kidney failure) the guideline development group considered a five-year number needed to treat of 100 as an adequate threshold. This threshold was mainly used to judge the GRADE domain imprecision per outcome measure. Importantly, the NNT 100 threshold for individual outcomes was not used in the overall judgement to determine whether a SGLT-2-inhibitor/GLP-1 receptor agonists should be recommended or not. For serious side-effects and complications such as ketoacidosis, amputations, pancreatitis and pancreatic cancer a five-year NNT (number needed to treat for an additional harmful outcome) of 1000 was used as a threshold because these outcomes are potential harms, instead of potential benefits, of a treatment with SGLT-2-inhibitors/GLP-1 receptor agonists. For judgements on less serious side-effects such as urinary tract infections and genital infections a five-year NNT of 100 was used.
Search and select (methods)
The clinical question in the current module was answered based on the systematic reviews of the literature performed in the module SGLT-2-inhibitors, and the module GLP-1 receptor agonists, the reader is referred to these modules for more details.
Results (search)
See the module SGLT-2-inhibitors, and the module GLP-1 receptor agonists: one systematic review and network meta-analysis (Palmer, 2021) was included which covers the literature up to 11 August 2020.
Referenties
- Basu S, Sussman JB, Berkowitz SA, Hayward RA, Yudkin JS. Development and validation of Risk Equations for Complications Of type 2 Diabetes (RECODe) using individual participant data from randomised trials. Lancet Diabetes Endocrin 2017;5:788-98.
- Basu S, Sussman JB, Berkowitz SA, et al. Validation of Risk Equations for Complications of Type 2 Diabetes (RECODe) using individual participant data from diverse longitudinal cohorts in the US. Diabetes care 2018;41:586-95.
- Bersoff-Matcha SJ, Chamberlain C, Cao C, Kortepeter C, Chong WH. Fournier gangrene associated with sodium–glucose cotransporter-2 inhibitors: a review of spontaneous postmarketing cases. Ann Intern Medicine 2019;170:764-9.
- Bonaca MP, Gutierrez JA, Cannon C, et al. Polyvascular disease, type 2 diabetes, and long-term vascular risk: a secondary analysis of the IMPROVE-IT trial. Lancet Diabetes Endocrin 2018;6:934-43.
- Bonaca MP, Wiviott SD, Zelniker TA, et al.. Dapagliflozin and cardiac, kidney, and limb outcomes in patients with and without peripheral artery disease in DECLARE-TIMI 58. Circulation 2020;142:734-47.
- Boonman-de Winter LJM, Rutten FH, Cramer MJM, et al. High prevalence of previously unknown heart failure and left ventricular dysfunction in patients with type 2 diabetes. Diabetologia 2012;55: 2154-62.
- CBG (2020). College ter Beoordeling Geneesmiddelen. Geneesmiddeleninformatiebank. https://www.geneesmiddeleninformatiebank.nl/nl/ (geraadpleegd 28 augustus 2020).
- CBG (2019). DHPC SGLT2-remmers. Risico op gangreen van Fournier bij gebruik van SGLT2-remmers. https://www.cbg-meb.nl/documenten/brieven/2019/01/21/dhpc-sglt2-remmers (geraadpleegd 9 september 2020).
- Cheng L, Li YY, Hu W, et al.. Risk of bone fracture associated with sodium–glucose cotransporter-2 inhibitor treatment: a meta-analysis of randomized controlled trials. Diabetes Metab 2019;45:436-45.
- Cheng HT, Xu X, Lim PS, Hung KY. Worldwide epidemiology of diabetes-related end-stage renal disease, 2000–2015. Diabetes Care 2021;44:89-97.
- Clegg LE, Penland RC, Bachina S, et al. Effects of exenatide and open-label SGLT2 inhibitor treatment, given in parallel or sequentially, on mortality and cardiovascular and renal outcomes in type 2 diabetes: insights from the EXSCEL trial. Cardiovasc Diabetol 2019;18:1-12.
- Dave CV, Kim SC, Goldfine AB, Glynn RJ, Tong A, Patorno E. Risk of cardiovascular outcomes in patients with type 2 diabetes after addition of SGLT2 inhibitors versus sulfonylureas to baseline GLP-1RA therapy. Circulation 2021;143:770-9.
- EMA (2017). European Medicines Agency. PRAC assessment report EMA/144426/2017. https://www.ema.europa.eu/en/documents/variation-report/invokana-h-a20-1442-c-2649-0018-epar-assessment-report-article-20_en.pdf (geraadpleegd 8 april 2021).
- Fox CS, Matsushita K, Woodward M, et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet 2012;380:1662-73.
- Frías JP, Guja C, Hardy E, et al. Exenatide once weekly plus dapagliflozin once daily versus exenatide or dapagliflozin alone in patients with type 2 diabetes inadequately controlled with metformin monotherapy (DURATION-8): a 28 week, multicentre, double-blind, phase 3, randomised controlled trial. Lancet Diabetes Endocrinol 2016;4:1004-16.
- Furukawa TA, Guyatt GH, Griffith LE. Can we individualize the ‘number needed to treat’? An empirical study of summary effect measures in meta-analyses. Int J of Epidemiol 2002;31:72-6.
- Gregg EW, Li Y, Wang J, et al. Changes in diabetes-related complications in the United States, 1990–2010. N Engl J of Med 2014;370:1514-23.
- Gregg EW, Hora I, Benoit SR. Resurgence in diabetes-related complications. JAMA 2019;321:1867-68.
- Hart HE, Ditzel K, Rutten GE, et al. De-intensification of blood glucose lowering medication in people identified as being over-treated: A mixed methods study. Patient preference and adherence 2019;13:1775.
- Hart HE, Rutten GE, Bontje KN, Vos RC. Overtreatment of older patients with type 2 diabetes mellitus in primary care. Diabetes, Obesity Metab 2018;20:1066-69.
- Heerspink HJ, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in patients with chronic kidney disease. N EnglJ Med 2020;383:1436-46.
- Heintjes EM, Houben E, Beekman-Hendriks WL, et al. Trends in mortality, cardiovascular complications, and risk factors in type 2 diabetes. Neth J Med 2019;77:317-29.
- Huthmacher JA, Meier JJ, Nauck MA Efficacy and safety of short-and long-acting glucagon-like peptide 1 receptor agonists on a background of basal insulin in type 2 diabetes: a meta-analysis. Diabetes Care 2020;43:2303-12.
- Laiteerapong N, Ham SA, Gao Y, et al. The legacy effect in type 2 diabetes: impact of early glycemic control on future complications (the Diabetes & Aging Study). Diabetes Care 2019;42:416-26.
- Lega IC, Bronskill SE, Campitelli MA, et al. Sodium glucose cotransporter 2 inhibitors and risk of genital mycotic and urinary tract infection: a population‐based study of older women and men with diabetes. Diabetes, Obesity Metabol 2019;21:2394-2404.
- Levin A, Perkovic V, Wheeler DC, et al. Empagliflozin and cardiovascular and kidney outcomes across KDIGO risk categories: Post hoc analysis of a randomized, double-blind, placebo-controlled, multinational trial. Clin J Am Soc Nephrol 2020;15:1433-44.
- Li S, Vandvik PO, Lytvyn L, et al. Risk-based treatment with SGLT-2 inhibitors or GLP -1 receptor agonists for adults with type 2 diabetes: a clinical practice guideline. BMJ 2021;373:n1091.DOI:10.1136/bmj.n109.
- Li S, Vandvik PO, Lytvyn L, et al. (2021). MAGICApp. https://app.magicapp.org/#/guideline/4288.
- Ludvik B, Frías JP, Tinahones FJ, et al. Dulaglutide as add-on therapy to SGLT2 inhibitors in patients with inadequately controlled type 2 diabetes (AWARD-10): a 24-week, randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol 2018;6:370-81.
- Mannucci E, Dicembrini I, Nreu B, Monami M. Glucagon‐like peptide‐1 receptor agonists and cardiovascular outcomes in patients with and without prior cardiovascular events: An updated meta‐analysis and subgroup analysis of randomized controlled trials. Diabetes Obesity Metabol 2020;22:203-11.
- Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016;375:311-22.
- Marso SP, Bain SC, Consoli A, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016;375:1834-44.
- Matsushita K, Jassal SK, Sang Y, et al.. Incorporating kidney disease measures into cardiovascular risk prediction: development and validation in 9 million adults from 72 datasets. EClinicalMedicine 2020;27:100552.
- McMurray JJ, Solomon SD, Inzucchi SE, et al.. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019;381:1995-2008.
- Nauck MA, Ghorbani MLM, Kreiner E, Saevereid HA, Buse JB. Effects of liraglutide compared with placebo on events of acute gallbladder or biliary disease in patients with type 2 diabetes at high risk for cardiovascular events in the LEADER randomized trial. Diabetes care 2019;42:1912-20.
- Neuen BL, Ohkuma T, Neal B, et al. Relative and absolute risk reductions in cardiovascular and kidney outcomes with canagliflozin across KDIGO risk categories: findings from the CANVAS Program. Am J Kidney Dis 2021;77:23-34.
- Neuen BL, Arnott C, Perkovic V, et al.. Sodium‐glucose co‐transporter‐2 inhibitors with and without metformin: A meta‐analysis of cardiovascular, kidney and mortality outcomes. Diabetes Obes and Metab 2021;23:382-90.
- NHG (2018). NHG-Standaard Diabetes mellitus type 2 (versie 5.3). https://richtlijnen.nhg.org/standaarden/diabetes-mellitus-type-2 (geraadpleegd 22 maart 2021).
- NHG/NIV/NVvC (2019). Cardiovasculair risicomanagement (CVRM). Richtlijnendatabase. https://richtlijnendatabase.nl/richtlijn/cardiovasculair_risicomanagement_cvrm/samenvatting_richtlijn_cvrm.html (geraadpleegd 16 maart 2021).
- Ninomiya T, Perkovic V, De Galan BE, et al. Albuminuria and kidney function independently predict cardiovascular and renal outcomes in diabetes. J Am Soc Nephrol 2009;20:1813-21.
- NIV (2020). Richtlijn Diabetische nefropathie. Richtlijnendatabase. https://richtlijnendatabase.nl/richtlijn/diabetische_nefropathie (geraadpleegd 22 maart 2021).
- NIV (2017). Richtlijn Diabetische retinopathie. Richtlijnendatabase. https://richtlijnendatabase.nl/richtlijn/diabetische_retinopathie/startpagina_diabetische_retinopathie.html (geraadpleegd 14 juli 2021).
- Nreu B, Dicembrini I, Tinti F, Mannucci E, Monami M (2020). Cholelithiasis in patients treated with Glucagon-Like Peptide-1 Receptor: An updated meta-analysis of randomized controlled trials. Diabetes Res Clin Prac 2020;161:108087.
- NVD, Artsenwijzer Diëtiek, Ondervoeding, http://www.artsenwijzer.info/site/?page=20&lg=nl (geraadpleegd op 23 juni 2021).
- Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413-24.
- Palmer SC, Mavridis D, Nicolucci A, et al. Comparison of clinical outcomes and adverse events associated with glucose-lowering drugs in patients with type 2 diabetes: a meta-analysis. JAMA 2016;316:313-24.
- Palmer SC, Strippoli GF. Metformin as first-line treatment for type 2 diabetes. Lancet 2018;392:120.
- Palmer SC, Tendal B, Mustafa RA, et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ 2021;372:m4573. DOI:10.1136/bmj.m4573.
- Rawshani A, Franzén S, Sattar N, et al. Risk factors, mortality, and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2018;379:633-44.
- Rawshani A, Franzén S, Eliasson B, et al. Mortality and cardiovascular disease in type 1 and type 2 diabetes. N Engl J Med 2017;376:1407-18.
- Ray KK, Seshasai SRK, Wijesuriya S, et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials. Lancet, 2009;373:1765-72.
- González-González JG, González-Colmenero AD, Millán-Alanís JM, et al. Values, preferences and burden of treatment for the initiation of GLP-1 receptor agonists and SGLT-2 inhibitors in adult patients with type 2 diabetes: a systematic review. BMJ open 2021;11:e049130.
- Salah HM, Al'Aref SJ, Khan MS, et al. Effect of sodium-glucose Cotransporter 2 inhibitors on cardiovascular and kidney outcomes–Systematic review and meta-analysis of randomized placebo-controlled trials. Am Heart J 2021;232:10-22.
- Seferović PM, Coats AJ, Ponikowski P, et al. European Society of Cardiology/Heart Failure Association position paper on the role and safety of new glucose‐lowering drugs in patients with heart failure. EurJ Heart Fail 2020;22:196-213.
- Siemieniuk RA, Agoritsas T, Macdonald H, Guyatt GH, Brandt L, Vandvik PO. Introduction to BMJ rapid recommendations. BMJ 2016;;354:i5191.
- Tsapas A, Avgerinos I, Karagiannis T, et al. Comparative effectiveness of glucose-lowering drugs for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med 2020;173:278-86.
- Turnbull FM, Abraira C, Anderson RJ, et al. Intensive glucose control and macrovascular outcomes in type 2 diabetes. Diabetologia 2009;52:88-2298.
- UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998;352:854-65.
- Vilsbøll T, Bain SC, Leiter LA, et al. Semaglutide, reduction in glycated haemoglobin and the risk of diabetic retinopathy. Diabetes, Obesity Metab 2018;20:889-97.
- Wermeling PR, Gorter KJ, Van Stel HF, Rutten GE. Both cardiovascular and non-cardiovascular comorbidity are related to health status in well-controlled type 2 diabetes patients: a cross-sectional analysis. Cardiovascular diabetology 2012’;11:1-8.
- Zaccardi F, Kloecker DE, Buse JB, Mathieu C, Khunti K, Davies MJ. Use of metformin and cardiovascular effects of new classes of glucose-lowering agents: a meta-analysis of cardiovascular outcome trials in type 2 diabetes. Diabetes Care 2021;44:e32-e34.
- Zelniker TA, Wiviott SD, Raz I, et al.. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet 2019;393:31-9.
- Zinman B, Bhosekar V, Busch R, et al. Semaglutide once weekly as add-on to SGLT-2 inhibitor therapy in type 2 diabetes (SUSTAIN 9): a randomised, placebo-controlled trial. Lancet Diabetes Endocrinol2019;7:356-67.
- Zwart K, Velthuis S, Polyukhovych YV, et al.. Sodium-glucose cotransporter 2 inhibitors: a practical guide for the Dutch cardiologist based on real-world experience. Neth Heart J 2021;29:490-9.
Evidence tabellen
Table of excluded studies (full text assessment)
See Palmer (2021), the systematic review on which the literature analysis was based.
Table of Patient and study characteristics and results
See Palmer (2021), the systematic review on which the literature analysis was based.
Table of Quality assessment (Risk of bias) of individual studies
See Palmer (2021), the systematic review on which the literature analysis was based.
Risk of bias table for systematic reviews
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: What is the optimal pharmacotherapy of adults with Diabetes mellitus type 2 and a very high risk of cardiovascular disease: supplementation of a SGLT-2-inhibitor?
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Palmer, 2021 |
Yes |
Yes |
Yes |
Yes |
not applicable |
Yes |
Yes |
Unclear1 |
Yes |
1risk of reporting bias was assessed, but potential risk of publication bias is not mentioned.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-11-2021
Laatst geautoriseerd : 15-11-2021
Geplande herbeoordeling :
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Stappenplan |
NIV en NHG |
2021 |
2022 |
Jaarlijks |
NIV en NHG |
Lopend onderzoek, toekomstige beschikbaarheid van nieuwe middelen |
Algemene gegevens
Autorisatie door de Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie is onder voorbehoud (officiële reactie volgt z.s.m.).
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en het NHG, en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Doel
Doel is het opstellen van een modulaire evidencebased richtlijn conform de huidige criteria (OMS 2011) naar aanleiding van feedback uit het veld en op basis van actuele wetenschappelijke gegevens. Dit moet leiden tot een nog gerichtere en uniformere behandelingsstrategie van volwassenen met DM type 2 die een zeer hoog risico op hart- en vaatziekten hebben. Daarnaast wordt patiënteninformatie ontwikkeld, die aansluit bij de informatie die al beschikbaar is op de publiekswebsite Thuisarts.nl.
In de voorbereidende fase zijn de volgende knelpunten geprioriteerd:
- Wat is de optimale medicamenteuze behandeling van volwassen personen met DM type 2 en een zeer hoog risico op hart- en vaatziekten: toevoeging van een SGLT2-remmer?
- Wat is de optimale medicamenteuze behandeling van volwassen personen met DM type 2 en een zeer hoog risico op hart- en vaatziekten: toevoeging van een GLP1-receptoragonist?
- Wat is de plaats van SGLT2-remmers en GLP1 receptoragonisten in het medicamenteuze stappenplan voor de behandeling van volwassen personen met DM type 2 en een zeer hoog risico op hart- en vaatziekten?
Doelgroep
Deze richtlijn is geschreven voor alle beroepsgroepen die betrokken zijn bij de zorg voor volwassenen met DM type 2. Daarnaast wordt patiënteninformatie ontwikkeld en gepubliceerd op de publiekswebsite Thuisarts.nl.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor volwassen personen met DM type 2.
Werkgroep DM2
- Dr. E.H. (Erik) Serné, internist-vasculaire geneeskunde/diabetologie, Amsterdam UMC, locatie VUmc, Amsterdam; Nederlandse Internisten Vereniging (voorzitter)
- Dr. Tj. (Tjerk) Wiersma, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap, Utrecht; Nederlands Huisartsen Genootschap (voorzitter)
- Dr. R.G. (Richard) Ijzerman, internist-endocrinoloog, Amsterdam UMC, locatie VUmc, Amsterdam; Nederlandse Internisten Vereniging
- Dr. H.E. (Bertien) Hart, kaderhuisarts diabetes, Leidsche Rijn Julius Gezondheidscentra, Utrecht; Nederlands Huisartsen Genootschap en Diabetes Huisartsen Advies Groep (DiHAG)
- Dr. P.G.H. (Paul) Janssen, huisarts, Huisartsenpraktijk Baambrugge, Baambrugge; Nederlands Huisartsen Genootschap en Diabetes Huisartsen Advies Groep (DiHAG)
- Dr. E.P. (Erwin) Klein Woolthuis, kaderhuisarts diabetes, Huisartsenpraktijk Uitvindersbuurt, Ede; Nederlands Huisartsen Genootschap en Diabetes Huisartsen Advies Groep (DiHAG)
- J.M. (Anne-Margreeth) Krijger-Dijkema, apotheker, Apotheek Stevenshof, Leiden; Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie en de Nederlandse Vereniging van Ziekenhuisapothekers
- (Angela) de Rooij, beleidsmedewerker Diabetesvereniging Nederland, Leusden; Diabetesvereniging Nederland, vanaf november 2020
Stuurgroep Modulair onderhoud diabetesrichtlijnen
- Dr. P.S. (Sytze) van Dam, internist niet-praktiserend, OLVG, locatie Oost, Amsterdam; Nederlandse Internisten Vereniging (overkoepelend voorzitter)
- Dr. E.H. (Erik) Serné, internist-vasculaire geneeskunde/diabetologie, Amsterdam UMC, locatie VUmc, Amsterdam; Nederlandse Internisten Vereniging
- Prof. dr B.E. (Bastiaan) de Galan, internist, hoogleraar interne geneeskunde-diabetologie, Maastricht UMC+; Nederlandse Internisten Vereniging
Met ondersteuning van
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior-adviseur; Kennisinstituut Federatie van Medisch Specialisten
- H. (Hanneke) Olthuis-van Essen, adviseur; Kennisinstituut Federatie van Medisch Specialisten
- M. (Matthijs) Oud, wetenschappelijk medewerker; Nederlands Huisartsen Genootschap
- N. (Natalia) Bullock, secretaresse; Kennisinstituut Federatie van Medisch Specialisten
Met dank aan
- Prof. dr P.O. Vandvik, Innlandet Hospital Trust-divisjon Gjøvik, Department of Medicine, Lytvyn, Lyubov (for sharing unpublished data on the clinical practice guideline ‘Risk-based treatment with SGLT-2 inhibitors or GLP-1-receptor agonists for adults with type 2 diabetes’ and the underlying systematic reviews)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste 3 jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Serné (vz) |
Internist-vasculaire geneeskunde binnen Amsterdam UMC, locatie VUmc
|
Clustervertegenwoordiger (NIV, NVK, NHG) binnen bestuur Nederlandse Diabetes Federatie (vacatiegelden), Lid van Rondetafel Diabeteszorg (onbetaald), Hoofdredacteur Nederlands Tijdschrift voor Diabetologie (betaald), Redactielid platform Diabetesgeneeskunde.nl (onafhankelijk niet-commercieel platform; betaald) |
Doelmatigheidsproject ZonMw betreffende behandeling patiënten met 'hypoglycemia unawareness' met 'stepped care' bestaande uit cursus HypoBewust en vervolgens eventueel continue glucosemonitoring (CGM) versus directe start CGM; Advisering binnen Rondetafel Diabeteszorg NDF-ZIN over doelmatige inzet nieuwe behandelingen. |
Geen |
|
Wiersma (vz) |
Senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap |
Geen |
Geen |
Geen |
|
IJzerman |
Internist-endocrinoloog, Amsterdam UMC, locatie VUmc, 0,8 fte, waarvan 0,33 fte gedetacheerd als klinisch beoordelaar bij het College ter Beoordeling van Geneesmiddelen (CBG), Utrecht
|
Geen |
Sinds 2016 lokale onderzoeker ‘Post-Authorisation Safety Study’ naar veiligheid insulines tijdens zwangerschap op verzoek van European Medicines Agency (Novo Nordisk). Sinds mei 2017 hoofdonderzoeker van mechanistisch onderzoek naar effecten dapagliflozin en exenatide op de hersenen (VU medisch centrum ontvangt subsidie van AstraZeneca). Vanaf april 2016 1 van de onderzoekers van Europees onderzoek naar ondervoeding bij ouderen (PROMISS; gesubsidieerd door EU Research and Innovation programme Horizon 2020). Hoofdonderzoeker van 2 epidemiologische onderzoeken waarvoor VU medisch centrum subsidie ontving van European Foundation for the Study of Diabetes en NWO. |
Geen |
|
Hart |
Huisarts Leidsche Rijn Julius Gezondheidscentra; lid Medische Ethische Toetsings Commissie, UMCU; coördinator NHG Kaderopleiding Diabetes, UMCU; Assistent Professor Julius Centrum, UMCU |
Voorzitter Diabetes Huisartsen Adviesgroep (DiHAG; vacatiegelden); vicevoorzitter en docent Stichting Langerhans (vacatiegelden); lid NHG- Standaardcommissie Diabetes (vacatiegelden); lid Commissie Preventieprogramma ZonMw (vacatiegelden); lid Commissie Opinie en Kennis Nederlandse Diabetesfederatie (NDF; vacatiegelden) |
Geen |
Geen |
|
Klein Woolthuis |
Huisarts, Huisartsenpraktijk Uitvindersbuurt, Ede |
Kaderhuisarts diabetes (advies, consultatie en onderwijs in/aan zorggroepen, deels betaald, als zzp'er); penningmeester bestuur Diabetes Huisartsen Advies Groep (DiHAG; vacatiegelden en onkostenvergoeding), lid Commissie Opinie en Kennis Nederlandse Diabetesfederatie (NDF; vacatiegelden) |
Geen |
Geen |
|
Janssen |
Huisarts, Huisartsenpraktijk Baambrugge (0,6 fte), Amsterdam UMC, locatie VUmc (0,4 fte) |
Kaderarts Diabetes (onbetaald); voorzitter Kwaliteitscommissie Diabetes, Amstelland Zorggroep (vacatievergoeding); SCEN-arts (betaling in geval van een uitgevoerde SCEN-consultatie) |
Geen |
Geen |
|
Krijger-Dijkema |
Apotheker, academische apotheek Stevenshof Leiden (5-8 uur per week); projectleider en onderzoeker bij Sir institute for Pharmacy Practice and Policy (onderzoeksinstituut, niet gesponsord door farmaceutische industrie; 20-23 uur per week) |
Lid Special interest group diabetes KNMP (vacatiegeld); voorzitter NDF ronde tafel leefstijlinterventies bij DM2 (vacatiegeld); lid Wetenschappelijke Adviesraad Diabetes Fonds (onbetaald); lid werkgroep herziening RL diabetische nefropathie (vacatiegeld) |
Geen |
Geen |
|
De Rooij - Peek |
Senior beleidsmedewerker Belangenbehartiging, Diabetesvereniging Nederland |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van de patiëntenvereniging (Diabetesvereniging Nederland) in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Diabetesvereniging Nederland, Nierpatiënten Vereniging Nederland en de Nierstichting (als stichting waarbinnen patiënten ook vaak hun stem laten horen). De aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de stuurgroep van het project Modulair onderhoud diabetesrichtlijnen en de werkgroep DM2 de knelpunten in de zorg voor volwassen personen met DM type 2. Het project Modulair onderhoud diabetesrichtlijnen is gestart met een brede algemene analyse van de knelpunten in de zorg voor personen met diabetes: een schriftelijke knelpuntenanalyse bij de NIV, V&VN, DVN en het NHG, aangevuld met een enquête tijdens de Internistendagen (24-26 april 2019, Maastricht) en een inventarisatie van de belangrijkste knelpunten (top 3) bij de genodigden voor de invitational conference. In de invitational conference zijn de uitkomsten van de schriftelijke knelpuntenanalyses besproken en waar nodig aangevuld, en is een eerste prioritering van de meest urgente revisies (bestaande modules) en aanvullingen (nieuwe modules) vastgesteld (zie het verslag van de invitational in de bijlage). De stuurgroep heeft de definitieve prioritering vastgesteld, waarna onderwerpen zijn geclusterd en afzonderlijke werkgroepen zijn samengesteld op basis van de benodigde expertise. Op basis van aanvullend overleg tussen de stuurgroep en de Diabetes Huisartsen Advies Groep (DiHAG) en het Nederlands Huisartsen Genootschap (NHG) is een werkgroep DM2 opgericht onder voorzitterschap van zowel de NIV als het NHG. Deze werkgroep heeft de knelpunten rondom farmacotherapie verder geanalyseerd en conceptuitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorend bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van 8 uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor het zoeken en selecteren van de literatuur en de beoordeling van de risk of bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ in de ‘Onderbouwing’. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van de bewijskracht per uitkomstmaat op basis van de 8 GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias; domeinen voor upgraden: dosis-effectrelatie, groot effect en residuele plausibele confounding).
GRADE onderscheidt 4 gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet een-op-een vergelijkbaar met het minimaal klinisch relevante verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming over de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk; ook factoren zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie worden meegewogen. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat; zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd, onder alle mogelijke omstandigheden en op elke individuele patiënt van toepassing zijn.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Indien relevant worden algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg behandeld in de module ‘Organisatie van zorg’.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T, Merglen A, Heen AF, et al.. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open 2017;7:e018593.
Alonso-Coello P, Schünemann HJ, Moberg J, et al.. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ 2016;353:i2016.
Alonso-Coello P, Oxman AD, Moberg J, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ 2016;353:i2089.
Brouwers MC, Kho, ME, Browman GP, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ 2010;182:E839-E842.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol 2017;87:4-13.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html.
Neumann I, Santesso N, Akl EA, et al.. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol 2016;72:45-55.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
