Venom immunotherapie (VIT) na hymenoptera steek bij mastocytose
Uitgangsvraag
Is venom immunotherapie (VIT) geïndiceerd bij mastocytose patiënten met anafylaxie als gevolg van een hymenoptera steek?
Aanbeveling
Start immunotherapie bij patiënten met een aangetoonde Hymenoptera allergie en een anafylactische reactie op een steek.
Blijf levenslang behandelen met immunotherapie in verband met het risico op recidief bij stoppen van de therapie.
Verhoog de onderhoudsdosering naar 150mg - 200mg per behandeling bij patiënten die na doorlopen van de eerste fase een recidief anafylaxie krijgen na een steek.
Overleg, indien gewenst, de behandelaanpak met één van de expertisecentra. Beslis in samenspraak met de patiënt waar de behandeling plaats moet vinden.
Overwegingen
Kwaliteit van bewijs
De conclusies zijn gebaseerd op observationele studies. De kwaliteit van de body of evidence zoals beoordeeld met GRADE is redelijk.
Een belangrijke notitie dient gemaakt te worden bij de conclusie dat VIT minder effectief is bij patiënten met mastocytose en/of een verhoogd tryptase. De oorzaak hiervan ligt deels in het aantal gevallen van recidief anafylaxie dat is gezien in de mastocytose groepen tijdens de onderhoudsfase van de behandeling. Ruëff et al. (2001; 2006) toonden aan dat het overgrote deel van alle patiënten beschermd is tegen nieuwe anafylaxie wanneer de onderhoudsdosis wordt verhoogd van 100 µg naar 150-200µg per behandeling. Het interval tussen behandelingen in de onderhoudsfase verschilt nationaal en internationaal per centrum maar is meestal tussen de vier en zes weken. Centra handelen hierin op basis van klinische ervaring en er is geen evidence over het meest veilige en effectieve interval voor mastocytosepatiënten. Hier is daarom een kennislancune te identificeren.
Experts benoemen dat er in het verleden meer bijwerkingen zijn gemeld bij VIT. Toch is de werkgroep van mening dat mits wordt voldaan aan de voorwaarden voor een veilige setting zoals beschreven in de EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy (Sturm et al., 2017) VIT veilig kan worden toegepast. Behandelaren kunnen indien gewenst laagdrempelig contact zoeken met één van de expertisecentra om advies in te winnen over het opstarten van VIT.
Professioneel perspectief
Er is nog onvoldoende bewijs om te bepalen wanneer immunotherapie gestopt kan worden. Omdat patiënten waarbij de immunotherapie niet slaagt na doorlopen van de initiële behandelperiode van 3-5 jaar, vaak mastocytose blijken te hebben en bekende mastocytose patiënten relatief vaak een recidief Hymenoptera gerelateerde anafylaxie krijgen na staken van VIT, adviseert de werkgroep in principe levenslang te blijven behandelen wanneer de onderhoudsfase is bereikt. Dit is inmiddels wereldwijd gebruikelijk in de expertisecentra voor mastocytose (Sturm et al., 2017).
Rationale van de aanbeveling
VIT is een effectieve behandeling bij mastocytose patiënten en kan veilig worden toegepast, met in acht name van een aantal voorwaarden voor de setting. Om recidieven te voorkomen wordt voortdurende onderhoudsbehandeling geadviseerd.
Onderbouwing
Achtergrond
Mestcel degranulatie bij mastocytose patiënten kan zich uiten in anafylaxie. Naar schatting maakt ongeveer de helft van alle mastocytose patiënten minimaal één keer in hun leven anafylaxie door (Brockow et al., 2008). Hymenoptera steken zijn de meest voorkomende oorzaak van anafylaxie bij mastocytose. Deze reacties kunnen zich bij mastocytose patiënten atypisch presenteren en verlopen vaak ernstiger dan bij patiënten zonder mastocytose. Venom immunotherapie (VIT) is een gevestigde en effectieve behandeling voor patiënten met hymenoptera allergieën zoals wespen- of bijenallergie. Echter is het onduidelijk of VIT ook effectief is bij patiënten met mastocytose gerelateerde anafylaxie of een verdenking op mastocytose, bijvoorbeeld door verhoogd serum tryptase. Effectiviteit kan hier worden gedefinieerd als het uitblijven van systemische of anafylactische reactie op een herhaalde steek door het insect waar men eerder wel een reactie op kreeg.
Er is in de literatuur gezocht naar uitkomstmaten die iets zeggen over het effect van VIT op het ontstaan van nieuwe anafylactische episoden bij mastocytosepatiënten, zoals de beschermingsratio (PR) of het relatief risico (RR) op anafylaxie na VIT.
Conclusies
|
Kwaliteit van Bewijs: Redelijk |
Het is aannemelijk dat met VIT bij patiënten met mastocytose en/of een verhoogd tryptase een klinisch relevant effect bereikt kan worden.
Referentie: Kranert (2019), Ruëff (2014); Ruëff (2001) |
|
Kwaliteit van Bewijs: Redelijk |
Het is aannemelijk dat VIT met de gemiddelde onderhoudsdosering van 100 µg iets minder effectief is bij patiënten met mastocytose en/of een verhoogd tryptase, dan bij patiënten zonder mastocytose en/of verhoogd tryptase
Referentie: Kranert (2019), Ruëff (2014); Ruëff (2001) |
Samenvatting literatuur
Onder de gevonden resultaten bevonden zich twee grote cohortstudies (Ruëff et al, 2014; Kranert et al, 2019). Beide studies onderzochten een cohort met zowel mastocytose- als niet mastocytosepatiënten waarbij de data voor de groep mastocytose patiënten apart werd geanalyseerd. In beide studies is het behandeleffect van VIT gemeten door het vastleggen van het aantal anafylactische reacties bij een Hymenoptera proefsteek in ziekenhuissetting, na afloop van de VIT en uitgedrukt als protection rate (PR).
Kranert et al (2019) onderzochten retrospectief een cohort van patiënten dat behandeld is met VIT (n = 1.258). Van alle patiënten was 8% (n = 105) gediagnosticeerd met mastocytose. Bij de mastocytosepatiënten werd aangeraden de onderhoudsdosis te verhogen van 100 µg naar 200µg, 96 patiënten volgden dit advies op. Een proefsteek werd uitgevoerd bij 85 mastocytose patiënten in de onderhoudsfase van de behandeling en minimaal 12 maanden na de eerste dosis. Opvallend genoeg bleek geen één van de patiënten nog een systemische reactie te vertonen na de proefsteek tijdens de onderhoudsfase, ongeacht dosering (PR 100%).
In de studie van Ruëff et al. (2014) werden de dossiers van patiënten met hymenoptera gif allergie (n = 1.609) geanalyseerd. In het gehele cohort werd bij 6.5% van de patiënten anafylactische reacties waargenomen bij de proefsteek (PR 93.5%). Wanneer de mastocytose patiënten apart werden geanalyseerd, bleek mastocytose in de huid en/of serum tryptase waarden van >20 µg/L tryptase een risico te vormen voor therapieresistentie met een PR 88.7% en OR 2.74 [95%CI 1.37;5.22].
In 2001 vergeleken Ruëff et al. ook al de effectiviteit van VIT bij mastocytose patiënten met Hymenoptera gif allergie, met die bij patiënten zonder mastocytose. Na bereiken van de onderhoudsfase van VIT werd een proefsteek uitgevoerd bij mastocytose patiënten (n = 33) en bij niet mastocytose patiënten (n = 468). In deze studie was de PR bij mastocytose lager dan in de niet-mastocytose groep, maar nog altijd vrij hoog (PR 78.4% respectievelijk PR 90.7%).
Alle overige gevonden resultaten over de effectiviteit van VIT bij patiënten met mastocytose én Hymenoptera gif allergie zijn gevonden in niet-vergelijkende observationele studies. De resultaten uit deze studies zijn eerder samengevoegd in een systematische review en consensus review door de Olano et al. (2011), zie tabel 1.
Tabel 1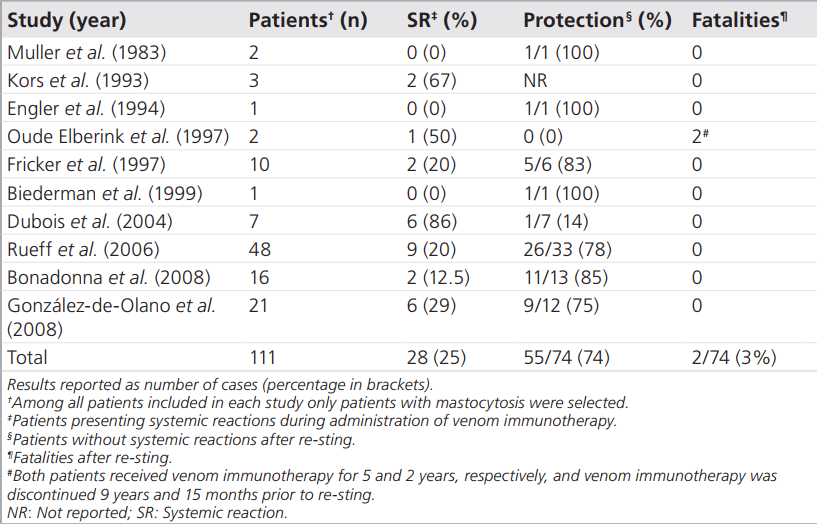
Ref: González-de-Olano, D., Álvarez-Twose, I., Vega, A., Orfao, A., & Escribano, L. (2011). Venom immunotherapy in patients with mastocytosis and hymenoptera venom anaphylaxis. Immunotherapy, 3(5), 637-651.
Zoeken en selecteren
Voor deze richtlijn is systematisch literatuuronderzoek verricht. De volledige zoekstrategie wordt gerapporteerd in de appendix ‘Systematisch literatuuronderzoek’ en de zoekmethode is beschreven in de module ‘Methode’.
|
Inclusie en exclusiecriteria |
|
|
Type studies |
|
|
Type patiënten |
|
|
Onderwerp |
|
|
Exclusiecriteria |
|
Van alle op basis van titel/abstract geïncludeerde resultaten zijn er (n = 16) gelabeld als relevant voor deze vraag. Na full tekst beoordeling zijn (n = 2) artikelen alsnog geëxcludeerd wegens ontbreken van full tekst (n = 1), onjuiste diagnostische criteria voor mastocytose (n = 1) en sample size <10 patiënten (n = 1).
Referenties
- Kranert, P., Forchhammer, S., Volc, S., Stenger, F., Schaller, M., & Fischer, J. (2020). Safety and Effectiveness of a 3-Day Rush Insect Venom Immunotherapy Protocol. International archives of allergy and immunology, 181(2), 111-118.
- González-de-Olano, D., Álvarez-Twose, I., Vega, A., Orfao, A., & Escribano, L. (2011). Venom immunotherapy in patients with mastocytosis and hymenoptera venom anaphylaxis. Immunotherapy, 3(5), 637-651.
- Rueff, F., Vos, B., Oude Elberink, J., Bender, A., Chatelain, R., Dugas‐Breit, S.,... & Flaig, M. (2014). Predictors of clinical effectiveness of H ymenoptera venom immunotherapy. Clinical & Experimental Allergy: Clinical Allergy, 44(5), 736-746.
- Ruëff, F., Wenderoth, A., & Przybilla, B. (2001). Patients reacting still to a sting challenge while receiving Hymenoptera venom immunotherapy are protected by increased venom doses. J Allergy Clin Immunol, 108, 1027-32.
- Sturm, G. J., Varga, E. M., Roberts, G., Mosbech, H., Bilo, M. B., Akdis, C. A.,... & Muraro, A. (2017). EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy, 73(4), 744-764.
Evidence tabellen
|
Studie/ jaartal
|
Design |
Doel studie |
Aantal patiënten, Inclusiecriteria, follow-up en uitval |
Interventie
|
Relevante uitkomstmaten |
Resultaten
|
Bijwerkingen
|
Opmerkingen |
|
Kranert, 2020 |
Cohort |
Onderzoeken indicatie en effect VIT |
Patienten met hymenoptera venom allergie (n = 1258), waarvan (n = 105 (8%))met verhoogd tryptase en/of mastocytose |
Rush protocol VIT honingbij of wesp venom |
Effect uitgedrukt in protection rate % |
N= 64 mastocytose /verhoogd tryptase patiënten kregen hogere dosis VIT. Bij geen van hen werd bij sting challenge anafylaxie geconstateerd (100% bescherming). n = 21 patiënten met mastocytose/verhoogd tryptase die geen toestemming gaven voor verhoogde VIT doses waren bij sting challange na doorlopen van VIT 100% beschermd.
Over het gehele cohort werd bij 76.9% (n = 968) een sting challange uitgevoerd en was de effectiviteit 98.5% (failure 1.5%). Bij aparte analyse bleek de effectiviteit iets hoger te liggen in de groep met wesp venom sensibilisatie (99,6%) dan in de groep met bijen venom sensibilisatie (95.4%) |
|
Significant meer effect dan in Ruëff (2014) (OR 0.22, CI 0.13–0.38, |
|
Ruëff, 2014 |
Cohort |
Onderzoeken indicatie en effect VIT |
Patienten met hymenoptera venom allergie (n = 1609), waarvan (n=106) patiënten mastocyotose in de huid en/of >20 ug/L tryptase hadden
Patiënten warden geïncludeerd uit een database als ze: (a) eens een anafylactische reactive hadden (a) allergie diagnostiek inconsistent was (b) ze meerdere sensibilisaties hadden of deze niet kon worden toegeschreven aan een specifiek insect (c) er vastgestelde contraindicaties waren voor sting challange (d) als de sting challenge met het verkeerde insect was uitgevoerd |
VIT honingbij of wesp venom. Opgestarty in rush of conventioneel protocol SC uitgevoerd in onderhoudsfase (100µg/6weken)
|
Effect uitgedrukt in protection rate% |
Effectiviteit totaal cohort: 6.5% ontiwikkelde een systemische objectieve systemische reactie. Van de (n=106) patiënten met tryptase >20 en/of mastocytose in de huid trad failure op bij 11.3% (12 patiënten) |
|
. |
|
Ruëff, 2001 |
Cohort |
Evaluatie van risico factoren voor treatment faillure VIT |
Patienten met hymenoptera venom allergie en Mastocytose volgens WHO (n=33) en controle groep zonder mastocytoose (alleen allergie) Mastocytose volgens WHO, sting challenge waarvan data beschikbaar |
VIT |
Effect uitgedrukt in protection rate% |
Mastocytose PR: 78.4% niet-mastocytose PR: 90.7%. significant beter bij niet-mastocytose (p=0.05) |
Milde systemische bijwerkingen en lokale zwelling op plek van injectie bij 18.8% van de mastocytose patiënten (9.3% van de niet masto patiënten) |
|
|
Heaberli (2003) |
Cohort |
analyse van Hymenoptera-gif-allergische patiënten met betrekking tot basale tryptase in relatie tot veiligheid en werkzaamheid van immunotherapie voor gif |
Patiënten met hymenoptera venom allergie en verhoogd tryptase (n= 10) versus een groep met alleen hymenoptera venom allergie (n = 151)
Voorgeschiedenis van systemische reactie op een hymenoptera steek, aantoonbaar verhoogd specifiek IgE |
VIT ultrarush, rush of conventioneel protocol SC in onderhoudsfase (100µg/6weken) |
Effect uitgedrukt in protection rate% |
PR 60% bij patiënten met tryptase >13.5µg/L PR 72.8% bij patiënten met tryptase <13.5µg/L |
|
|
|
De Olano, 2017 |
Concensus review |
Aanbevelingen doen tbv toepassen immunotherapie bij mastocytose pt. |
Pt. Met mastocytose, exacte inclusie niet expliciet gemaakt. |
VIT in verschillende protocollen (rush, cluster etc) |
Effectiviteit uitgedrukt in PR |
Resultaat over 10 studies (n = 111) 74% effectief. Hierin werden niet alle pt doorbehandeld en waren doses en onderhoudsdoses verschillend. |
Wanneer over meerdere beschreven resultaten gekeken wordt komen systemische bijwerkingen voor bij 25% |
|
Risk of bias tabel - Newcastle-Ottawa Scale (NOS)
|
|
Selection |
Comparability |
Exposure |
|
Kranert, 2020
|
1. Representativeness of exposed |
1. Controls for most |
1. Outcome assessment ⍟ |
|
2. selection the non-exposed cohort ⍟ |
2.Controls for additional |
2.Follow up length ⍟ |
|
|
3. Ascertainment of |
|
3.Adequacy of follow-up ⍟ |
|
|
4.Control definition ⍟ |
|
|
|
|
|
|||
|
Ruëff, 2014
|
1. Representativeness of exposed |
1. Controls for most |
1. Outcome assessment ⍟ |
|
2. selection the non-exposed cohort ⍟ |
2.Controls for additional |
2.Follow up length ⍟ |
|
|
3. Ascertainment of |
|
3.Adequacy of follow-up ⍟ |
|
|
4.Control definition ⍟ |
|
|
|
|
|
|||
|
Ruëff, 2001
|
1.Case definition ⍟ |
1. Controls for most ⍟ |
1.Ascertainment of ⍟ |
|
2.Representetiveness ⍟ |
2.Controls for additional factors ⍟ |
2.Same ascertainment |
|
|
3.Control selection ⍟ |
|
3.Non-response rate or |
|
|
4.Control definition ⍟ |
|
|
|
|
|
|||
|
Heaberli (2003)
|
1. Representativeness of exposed |
1. Controls for most |
1. Outcome assessment ⍟ |
|
2. selection the non-exposed cohort ⍟ |
2.Controls for additional |
2.Follow up length ⍟ |
|
|
3. Ascertainment of |
|
3.Adequacy of follow-up ⍟ |
|
|
4.Control definition ⍟ |
|
|
|
|
|
|||
|
De olano, 2011 |
De Olano, 2011 is een consensus review waarvan een beschrijvende samenvatting van andere publicaties die onderzoek deden naar VIT bij mastocytose patiënten gebruikt is. Een risk of bias beoordeling is daarom niet van toepassing. |
||
Evidence profielen - Kwaliteitsbeoordeling volgens GRADE van referenties: Ruëff (2001; 2006), Haeberli (2003) en Kranert (2019)
|
Quality assessment |
Summary of findings |
Quality |
Importance |
||||||||
|
No of patients |
Effect |
||||||||||
|
No. of studies |
Design
|
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other |
VIT bij mastocytosepatiënten |
VIT bij allergiepatiënten |
|||
|
Uitkomstmaat: Protection Rate na VIT (follow up: median 2 years; assessed with: geen systemische reactie bij sting-challenge of re-sting) |
|||||||||||
|
4 |
Observationele studies |
Niet serieus |
Niet serieus |
Niet serieus |
Niet serieus |
Sterke associatie tussen VIT en uitblijven systemische reactie |
N = 232 |
N = 3054 |
209/232 (90.1%) vs. 2864/3054 (93.8%) |
Redelijk |
8 |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 17-02-2022
Laatst geautoriseerd : 05-01-2022
Geplande herbeoordeling : 17-02-2022
Uiterlijk in 2026 bepaalt het bestuur van de NVvAKI of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NvvAKI is als houder van deze richtlijn(module) de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door Qualicura en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het uiteindelijke doel is het geven van hoog kwalitatieve en gepersonaliseerde zorg voor patiënten met mastocytose. Hiervoor wordt in dit project een richtlijn ontwikkeld waarin indicatiestelling, diagnostiek, behandeling, symptoombestrijding, follow-up, werkverdeling en adviezen aan de patiënt bij mastocytose uniform belicht worden.
Doelgroep
Medisch specialisten en andere zorgverleners die te maken hebben met patiënten met mastocytose.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit:
- Dr. J. (Hanneke) Oude Elberink, Internist-allergoloog, UMCG, Groningen, Nederlandse Vereniging voor Allergologie en Klinische Immunologie (NVvAKI)
- Dr. M. (Maud) Hermans, internist-allergoloog/immunoloog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Allergologie en Klinische Immunologie (NVvAKI)
- Dr. P. (Paul) van Daele, internist-allergoloog/immunoloog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Allergologie en Klinische Immunologie (NVvAKI)
- Dr. G. (Gerben) Ferwerda, internist-allergoloog/immunoloog, DC Klinieken & Radboud UMC, Nijmegen, Nederlandse Vereniging voor Allergologie en Klinische Immunologie (NVvAKI)
- Dr. F. (Floor) Heubels-Moenen, internist-hematoloog, MUMC, Maastricht, Nederlandse Verenging voor Haematologie (NVvH)
- Dr. B. (Bart) Span, internist-hematoloog, UMCG, Groningen, Nederlandse Verenging voor Haematologie (NVvH)
- Dr. P. (Peter) te Boekhorst, internist-hematoloog, Erasmus MC, Rotterdam, Nederlandse Verenging voor Haematologie (NVvH)
- Dr. R. (Rob) Fijnheer, internist-hematoloog, Meander ziekenhuis, Amersfoort, Nederlandse Verenging voor Haematologie (NVvH)
- Dr. A. (Aline) Sprikkelman, kinderarts-allergoloog, UMCG, Groningen, Nederlandse Vereniging voor Kindergeneeskunde (NVK), sectie Kinderallergologie (SKA)
- Dr. I (Inge) Bocca, kinderarts, UMCG, Groningen, Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- Dr. N. (Nicolette) Arends, kinderarts-allergoloog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Kindergeneeskunde (NVK), sectie Kinderallergologie (SKA)
- Dr. E. (Elise) Huismans, Kinderarts-hematoloog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- Dr. A. (André) Mulder, Arts Klinische Chemie/Laboratoriumspecialist Klinische Chemie, UMCG, Groningen, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC)
- Dr. V. (Vincent) van der Velden, Medisch Immunoloog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Immunologie (NVVI) en Nederlandse vereniging voor cytologie (NVC)
- Prof. Dr. S. (Suzanne) Pasmans, Dermatoloog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
- Dr. M. (Marja) Oldhoff, Dermatoloog, UMCG, Groningen, Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
- Dr. J. (Jeffrey) Damman, Dermato-Patholoog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Pathologie (NVVP)
- Dr. A. (Arjan) Diepstra, Hemato-Patholoog, UMCG, Groningen, Nederlandse Vereniging voor Pathologie (NVVP)
- Dr. G. (Gilles) Diercks, Patholoog, UMCG, Groningen, Nederlandse Vereniging voor Pathologie (NVVP)
- Dr. J. (Joop) Lefrandt, Internist-Endocrinoloog, UMCG, Groningen, Nederlandse Internisten Vereniging (NIV)
De werkgroep is geadviseerd door twee patiëntvertegenwoordigers vanuit de Mastocytose Vereniging Nederland, namelijk:
- Drs. B. (Brigit) Fokkinga, Patiëntvertegenwoordiger, Mastocytose Vereniging Nederland
- Mw. G. (Ghislaine) van de Zande, Patiëntvertegenwoordiger, Mastocytose Vereniging Nederland
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van de NvvAKI.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee patiëntvertegenwoordigers te includeren als leesgroep en uit te nodigen in de discussie voor de overwegingen.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijn is opgesteld in overeenstemming met de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Met de voorzitter (Dr. J.N.G. Oude Elberink, internist-allergoloog), vice-voorzitter (Dr. M.A.W. Hermans, internist-allergoloog/immunoloog) en een werkgroep van verschillende specialisten is een eerste inventarisatie van bestaande knelpunten gedaan. Vervolgens is in een schriftelijke invitational conference het conceptraamwerk met knelpunten voorgelegd aan alle betrokken wetenschappelijke verenigingen. Reacties en aanvullingen op de knelpunten uit deze inventarisatie zijn meegenomen in de definitieve knelpunten die uitgangspunt vormen voor deze richtlijn.
Uitgangsvragen en uitkomstmaten
Een methodologisch adviseur heeft de werkgroep begeleid in het formuleren van uitgangsvragen en uitkomstmaten. De vastgestelde knelpunten zijn hiervoor als startpunt gebruikt zodanig dat de aanbeveling die volgt uit de uitgangsvraag, handvatten biedt voor de specialist om met het knelpunt om te gaan. De uitgangsvragen zijn vervolgens vertaald in zoekvragen voor literatuuronderzoek. Bij de zoekvragen zijn relevante uitkomstmaten gezocht om zo tot vragen in een PICO - format te komen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in samenvattingstabellen (summary of findings). De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur die per module is uitgewerkt.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirect bewijs, imprecisie, en publicatiebias).
C) Voor bewijs uit niet-vergelijkend onderzoek.
Mastocytose is een zeldzaam ziektebeeld. Hierdoor was er voor sommige onderwerpen in de richtlijn een gebrek aan kwalitatief bewijs uit vergelijkende studies. In dit geval is de evidence-based approach toegepast door op zoek te gaan naar het best beschikbare bewijs. Voor een aantal onderwerpen zijn er daarom niet-vergelijkende studies geïncludeerd. Deze studies kunnen niet met GRADE beoordeeld worden, conclusies zijn in dit geval aangeduid met ‘kwaliteit van bewijs: - ‘. Bij de beoordeling van deze studies is wel vanuit een soortgelijk gedachtegoed gehandeld. Zo is er gekeken naar de methodologische kwaliteit (risk of bias), de heterogeniteit (inconsistentie) en de effectgrootte (imprecisie). Ook is er gescreend op tekenen van publicatiebias en is gekeken in hoeverre de data overeenkomstig is met de opgestelde vraag (indirect bewijs).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep leden maakten de balans op van elke uitgangsvraag (overall conclusie). De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroep leden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Hierbij zijn ook per uitgangsvraag gedefinieerd welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Patiëntenparticipatie
De Mastocytose Vereniging Nederland participeert in de werkgroep om de conceptrichtlijn te schrijven. Daarnaast is een vertegenwoordiger bij iedere vergadering aanwezig, net als de andere werkgroepleden. Ook wordt de conceptrichtlijn geaccordeerd door de Mastocytose Vereniging Nederland. Tevens wordt een patiënten samenvatting van de richtlijn via de website van de vereniging aangeboden aan patiënten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
