Algemene indicatiestelling bij chirurgische behandeling van obesitas
Uitgangsvraag
Wat zijn de indicaties voor chirurgische behandeling van ernstige obesitas?
Aanbeveling
Aanbeveling 1
Overweeg samen met de patiënt en een multidisciplinair behandelteam metabole chirurgie bij een BMI ≥ 40 kg/m2, waarbij de patiënt wordt ingelicht over het behandeltraject, de prognose en de risico’s die verbonden zijn aan de behandeling.
Maak eerst een inschatting van algemene gezondheid- en voedingsstatus:
- Probeer pathologische oorzaken van obesitas te achterhalen (bijvoorbeeld monogenetische of syndromale oorzaak, hormonale afwijkingen of eetpathologie). Alarmsymptomen voor monogenetische oorzaak zijn onder andere obesitas en/ of hyperfagie vanaf jonge kinderleeftijd.
- Inventariseer bijdragende factoren als medicatie met gewichtsverhogende bijwerking, slaaptekort en stress.
- Sluit contra-indicaties uit.
- Optimaliseer de behandeling van eventuele co-morbiditeiten.
- Inventariseer de recente pogingen tot leefstijlverandering (met professionele begeleiding).
Verricht geen metabole chirurgie bij:
- Onvoldoende kennis over gezonde voeding, beweging en slaap.
- Onvoldoende bereidheid tot gedragsverandering en een persisterende ongezonde leefstijl.
- Eetstoornissen.
- Bij vermoeden van een endocriene stoornis, genetische of syndromale oorzaak. Hier moet eerst verder onderzoek naar gedaan worden. Verwijs dan naar een gespecialiseerd centrum voor aanvullend onderzoek. Na gespecialiseerde diagnostiek kan - afhankelijk van de aandoening - alsnog besloten worden tot metabole chirurgie.
- Verdenking op psychopathologie die naar beoordeling van het behandelteam de behandelresultaten in belangrijke mate kan verstoren, bijvoorbeeld:
- Chronische psychiatrische psychopathologie, zoals een bipolaire stoornis of psychotische episodes waarbij de patiënt niet stabiel is.
- Een onvoldoende uitgebreid sociaal netwerk (extra alertheid bij aanwezige psychosociale problematiek of bij een laag IQ).
Neem contact op met de eerdere of huidige behandelaar bij twijfel over bovenstaande aspecten.
Verzamel voorafgaand aan de screening schriftelijk alle relevante rapportages en verslagen ter onderbouwing van de indicatiecriteria en neem deze op in het patiëntendossier.
Aanbeveling 2
Overweeg samen met een patiënt met een Aziatische of Hindoestaanse achtergrond metabole chirurgie bij een BMI ≥ 35 kg/m2, waarbij de patiënt wordt ingelicht over het behandeltraject, de prognose en de risico’s die verbonden zijn aan de behandeling.
Overwegingen
De onderstaande overwegingen gelden in principe voor het overgrote deel van de patiëntenpopulatie waarop de uitgangsvraag betrekking heeft. De indicatiestelling voor patiënten met co-morbiditeiten, oudere patiënten of vrouwen met een kinderwens staat in aparte modules beschreven. Patiënten met een Aziatische of Hindoestaanse achtergrond zijn wel als subgroep in deze module beschreven.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De resultaten voor de preoperatief gewichtsverlies als voorspeller voor postoperatief gewichtsverlies zijn zeer heterogeen. Er is geen eenduidige richting aan het resultaat te geven. Een aantal studies laten zien dat preoperatief gewichtsverlies postoperatief gewichtsverlies voorspelt, maar weer andere studies vinden geen correlatie. Bovendien is de follow-up in de gevonden studies erg kort, meestal niet langer dan een jaar, terwijl het maximale gewichtsresultaat vaak pas na twee jaar wordt bereikt. Daarnaast zijn voor de gezondheid van patiënten uiteindelijk vooral de lange termijn resultaten van belang. Er zijn geen studies die aantonen dat preoperatief gewichtsverlies op termijn helpt om gewichtstoename te voorkomen.
Preoperatief gewichtsverlies verlaagt mogelijk wel de kans op complicaties. Het is hierbij wel de vraag of dit door preoperatief gewichtsverlies komt of doordat patiënten met een lager BMI minder kans heeft op complicaties. Hierbij wordt verder aangetekend dat de complicatie percentages in de genoemde studies aanzienlijk hoger zijn dan wat in deze tijd in Nederland gebruikelijk is. Nederland kent uitsluitend hoog volume centra met uitgebreide ervaring en het is daarom goed voorstelbaar dat de hoogte van de BMI hier een geringere rol speelt op de prevalentie van complicaties.
De overal bewijskracht is zeer laag. Dit wordt veroorzaak doordat de studies heterogeen zijn en risico op bias hebben. De studies verschillen met betrekking tot design, follow-up duur, selectie van de patiënten, hoe er (veelal niet) wordt omgegaan met confounding en hoe preoperatief- en postoperatief gewichtsverlies gerapporteerd wordt. Het zijn veelal retrospectieve studies, waarbij het vaak onduidelijk is welke patiënten uiteindelijk geselecteerd zijn. Slechts een paar studies presenteerden een multivariaat model op basis van vooraf vastgestelde variabelen in plaats van een data gedreven model. Daarnaast werden patiënten met missende data soms geëxcludeerd of werd er niet beschreven hoe met de missende data werd omgegaan. Gewichtsverlies werd ook op verschillende manieren gerapporteerd, zo werd het % EWL, TWL, aan kilogram gewichtsverlies of afname in BMI vermeld. Sommige studies deelden de patiënten in categorieën in, de afkapwaardes voor deze categorieën varieerden tussen de studies. Daarnaast rapporteerden sommige studies preoperatief een andere manier dan postoperatief gewichtsverlies.
Preoperatief gewichtsverlies is in de search genomen als cruciale uitkomstmaat voor de rol van preoperatief dieetadvies op gewichtsuitkomsten na een metabole operatie. Op basis van de huidige literatuur is het onduidelijk of hier een verband tussen bestaat. De werkgroep is daarom van mening dat preoperatief gewichtsverlies daarmee geen voorwaarde hoeft te zijn voor de patiënt om metabole chirurgie te mogen ondergaan. Het wordt wel aangeraden preoperatief een inschatting te maken van de leefgewoontes (dieet, beweeg, slaap- en eetgedrag) en het kennisniveau van potentiële kandidaten. De volgende criteria kunnen daarbij helpen maar zijn geen voorwaarde:
- Een afvalpoging onder begeleiding van een deskundige (minimaal huisarts of diëtist) (een verslag of brief van die poging is behulpzaam).
- Een serieuze dieetpoging.
- De obesitas bestaat minimaal vijf jaar.
De werkgroep sluit zich aan bij het bestaande (inter)nationale criterium voor indicatiestelling, namelijk het hebben van een BMI van ≥ 40 kg/m2 waarbij:
- Het BMI criterium de huidige BMI mag zijn of een eerdere gedocumenteerde BMI van deze omvang.
- Gewichtsverlies als gevolg van een intensieve behandeling voorafgaand aan chirurgie (bij patiënten die een gewicht bereiken onder de minimale BMI indicatie voor chirurgie) is daarmee geen contra-indicatie voor metabole chirurgie.
Er is ook een indicatie voor metabole chirurgie bij een BMI van ≥ 35 kg/m2 als deze gepaard gaat met co-morbiditeit. Dit wordt verder uitgewerkt in de module ‘Indicatiestelling patiënten met co-morbiditeiten’. Bij een patiënt met diabetes en een BMI > 30 kg/m2 dient metabole chirurgie te worden overwogen. Dit wordt in de module 'Indicatiestelling patiënten met diabetes mellitus type 2' uitgewerkt.
Naast de BMI grens, is motivatie lang gehanteerd als onderscheidend criterium voor in- of exclusie. Die motivatie zou moet blijken uit:
- Voldoende begrip ten aanzien van operatief ingrijpen.
- Bereidheid de leefstijl (eet- en leefpatroon) te veranderen en inzien dat de operatie hierbij een hulpmiddel is.
- Bereidheid om tot tenminste vijf jaar na de operatie onder medische controle te blijven.
- Bereidheid om levenslang dagelijks vitaminepreparaten te slikken.
De motivatie blijkt lastig meetbaar en de voorspellende waarde voor de uitkomsten van metabole chirurgie is niet duidelijk. De werkgroep meent dan ook dat het niet juist is om dit criterium als strikt exclusiecriterium voor de indicatiestelling te gebruiken. Wel zijn er een aantal andere exclusiecriteria voor metabole chirurgie, namelijk:
1. Vastgestelde eetpathologie
Voor een vastgestelde eetpathologie moet eerst een behandeling door een diëtiste en/of psycholoog ingezet worden.
2. Psychiatrische en psychosociale variabelen
a. Bij verdenking op de volgende psychopathologie moet eerst nadere diagnostiek en eventueel eerst een behandeling door psycholoog ingezet worden:
- Ernstige depressie met vitale kenmerken en/of suïcidale ideatie.
- Ernstig angststoornis die het dagelijks functioneren beperkt en reeds zes maanden aanhoudt.
- Acute PTSS met voortdurende herbeleving die langer dan één maand aanhoudt.
- (Alcohol) verslaving op dit moment aanwezig of korter dan één jaar geleden.
- Bij een patiënt die langer dan één jaar aantoonbaar verslavingsvrij is bestaat geen contra-indicatie.
b. Bij chronische psychiatrische psychopathologie, zoals een bipolaire stoornis of psychotische episodes, die onvoldoende behandeld is en op het moment niet stabiel is. Hetzelfde geldt voor persoonlijkheidsproblematiek waarbij onvoldoende stabiliteit bestaat. Bij twijfel moet er contact zijn met de eerdere of huidige behandelaar. Het verslag met conclusie(s) wordt opgenomen in patiëntendossier.
c. Een onvoldoende uitgebreid sociaal netwerk (extra alertheid bij aanwezige psychosociale problematiek of bij een laag IQ). Bij vermoeden van een laag verstandelijke beperking is het raadzaam om het sociaal netwerk te betrekken om een inschatting te maken of iemand in staat is gedrag zelfstandig te veranderen.
Hierbij moeten alle relevante rapportages en verslagen ter onderbouwing van bovenstaande criteria schriftelijk en voorafgaand aan de screening verzameld en opgenomen zijn in het patiëntendossier.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor patiënten is een juiste indicatiestelling van belang omdat het de beste garantie geeft op goede uitkomsten voor wat betreft bestendig gewichtsverlies, vermindering van co-morbiditeit en betere kwaliteit van leven. Voor een advies op maat moet preoperatief het multidisciplinaire behandel team een inschatting kunnen maken van de vaardigheden en behoeften per patiënt. Waar nodig kunnen per patiënt aanpassingen worden gedaan.
Het verplicht stellen van preoperatief gewichtsverlies is daarbij waarschijnlijk niet bijdragend en genereert onnodig kosten. Voor patiënten heeft het uitstellen van een metabole operatie voor het eerst volgen van een dieettraject alleen zin als sprake is van gebrekkige kennis omtrent gezond eten of een eetstoornis.
Kosten (middelenbeslag)
De indicatiestelling voor metabole chirurgie gebeurt onveranderd op basis van BMI. In die zin verandert er weinig in de huidige richtlijn.
Aanvaardbaarheid voor de overige relevante stakeholders
Geadviseerd wordt alle patiënten voor een metabole operatie te evalueren wat betreft eetgedrag en beweegpatroon en zo nodig te adviseren in verbetering daarvan. Preoperatief gewichtsverlies of meerdere pogingen daartoe is geen voorwaarde voor het mogen ondergaan van een operatie.
Haalbaarheid en implementatie
De criteria voor het ondergaan van metabole chirurgie veranderen niet wezenlijk door preoperatief gewichtsverlies en de pogingen daartoe niet verplicht te stellen. Weglaten van een pre operatie dieet traject voor patiënten die daar niet duidelijk van profiteren betekent een logistieke besparing die mogelijk de gemiddelde doorlooptijd van de behandeling zal laten toenemen.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Aanbeveling-1
Het streven moet zijn om succesvol afvallen te bereiken door een combinatie van behandelingen volgens het ‘matched care’ principe. Hierbij kan uitdrukkelijk zowel voor opschaling als voor afschaling van een behandeling worden gekozen, afhankelijk van de ernst van de situatie.
Metabole chirurgie is een effectieve behandeling voor ernstig overgewicht en niet een ‘last resort’ behandeling die pas in zich komt nadat andere lifestyle interventies gefaald hebben. Een grondige inventarisatie van leefstijlfactoren en de noodzaak van begeleiding gericht op gedragsverandering blijft waardevol voor alle kandidaten voor metabole chirurgie, ook na de operatie. Dieet-, beweeg- en andere lifestyle adviezen en medicatie zijn daarbij complementair aan een operatie en sluiten elkaar niet uit.
Geslaagd preoperatief gewichtsverlies zou mogelijk iets kunnen helpen in het voorkómen van complicaties, maar het effect is onvoldoende groot om alle patiënten daarvoor een preoperatief dieet te laten volgen.
Aanbeveling-2-subgroep Patiënten met een Aziatische of Hindoestaanse achtergrond met obesitas
Voor patiënten met een Aziatische achtergrond of Hindoestaanse gelden andere grenzen, omdat een andere vetverdeling al hogere gezondheidsrisico’s met zich meebrengt bij lagere BMI. Bij mensen met een Aziatische of Hindoestaanse achtergrond is bij een BMI > 27,5 kg/m2 sprake van obesitas (Stegenga, 2014; WHO Expert Consultation, 2004). De grenzen bij patiënten met een Aziatische achtergrond zijn daarom een BMI > 35 kg/m2 of BMI > 32 kg/m2 en ernstige co-morbiditeit.
Onderbouwing
Achtergrond
Obesitas komt steeds vaker voor en is geassocieerd met verschillende co-morbiditeiten wat resulteert in stijgende medische kosten. Een zeer effectieve behandeling van ernstige obesitas is metabole chirurgie. Voor de indicatiestelling van metabole chirurgie voor (ernstige) obesitas worden internationaal een aantal vaste in- en exclusiecriteria gehanteerd. Hoewel BMI een beperkte maat vormt voor de ernst van de ziekte geldt dit nog steeds als richting gevend criterium. De selectie van patiënten voor metabole chirurgie is complex omdat het onwenselijk is dat de chirurgische behandeling in de plaats komt van inspanningen die mensen zelf moeten leveren voor een gezondere leefstijl. Daar staat tegenover dat obesitas gezien wordt als chronische ziekte die, net als andere aandoeningen, de meest effectieve behandeling verdient. Beide argumenten moeten voldoende worden meegewogen in de selectieprocedure.
Metabole chirurgie is een zeer effectieve behandeling voor ernstig overgewicht en niet een ‘last resort’ (laatste redmiddel als al het andere gefaald heeft). Deze effecten zijn wetenschappelijk aantoonbaar bij patiënten met obesitas (BMI 30 kg/m2 of hoger). Toch heeft chirurgie ook nadelen en beperkingen en is het het meest effectief als het mensen helpt op weg naar een gezondere leefstijl. Het is dus belangrijk dat kandidaten weloverwogen kiezen voor een operatie en daarbij optimaal ondersteund worden in het maken van gezondere keuzes. Een zekere motivatie voor verandering en basale vaardigheden en kennis over goede en slechte gewoontes wordt daarbij belangrijk geacht.
De screening/ selectie moet er dan ook mede op gericht zijn te onderzoeken in hoeverre patiënten gemotiveerd en bekwaam zijn om hun levensstijl duurzaam te veranderen. Daarvoor is begrip van leefgewoontes waaronder: dieet, bewegen en slaap noodzakelijk. Eerdere afvalpogingen onder begeleiding van een professional kunnen helpen om te bepalen of kandidaten de noodzakelijke kennis al aangeboden hebben gekregen, maar ze zijn niet leidend. De meeste patiënten worstelen al vele jaren met hun gewicht en hebben meestal meerdere afvalpogingen ondernomen al dan niet onder professionele begeleiding. Bij een groot aantal bestaat al de nodige kennis omtrent een gezondere leefstijl. Hen ‘verplicht’ opnieuw een dieet te laten volgen om te kwalificeren voor een operatie is meestal niet bijdragend. Een preoperatieve evaluatie van eetgedrag en leefgewoonten en advies over aanpassingen is dat wel.
Soms wordt preoperatief gewichtsverlies gebruikt als een selectiemiddel omdat preoperatief gewichtsverlies een maat zou kunnen zijn voor motivatie en daardoor mogelijk bijdraagt aan betere uitkomsten na metabole chirurgie. Volgens die selectie moeten patiënten eerst een bepaald percentage gewicht verliezen (bijvoorbeeld 5%) alvorens ze in aanmerking komen voor metabole chirurgie. De richtlijnwerkgroep vond het van belang dit selectiecriterium apart te onderzoeken in een zoekvraag.
Bij een eerdere richtlijn werden dieet- en gewicht historie gebruikt voor de indicatiestelling van metabole chirurgie. Hierbij moesten patiënten met een BMI < 50 kg/m2 kunnen aantonen dat zij in de afgelopen vijf jaar:
- Een afvalpoging onder begeleiding van een deskundige (minimaal huisarts of diëtist) hadden ondernomen (een verslag of brief moest overhandigd kunnen worden).
- Een dieetpoging minimaal vier maanden te hebben volgehouden.
- Minimaal vijf jaar obesitas te hebben gehad.
- Bij patiënten met een BMI ≥ 50 kg/m2 vervielen deze criteria en bestaat er direct een indicatie voor chirurgische behandeling.
Deze criteria gingen er van uit dat patiënten die onderwezen waren in de principes van gezonder eten een meer bestendig resultaat zouden behalen na metabole chirurgie. Wetenschappelijk gezien bestaat daarvoor echter weinig ondersteuning. Het is dan ook de vraag of er uit de literatuur is op te maken of preoperatieve begeleiding (dieet en gewichtsverlies) invloed heeft op de uitkomsten na metabole chirurgie. Waardoor dit mogelijk als hulpmiddel voor de indicatiestelling en selectie van de patiënten kan worden gebruikt.
Conclusies
Uitkomstmaat 1. Gewichtsverlies (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of preoperatief gewichtsverlies een voorspeller is voor gewichtsverlies na metabole chirurgie.
Bronnen: (Al-Khyatt, 2017; Blackledge, 2016; Eisenberg, 2010; Gerben, 2016; Giordano, 2014; Hutcheon, 2018; Kraus, 2018; Livhits, 2009; McNickle, 2019; Parmar, 2018; Parri, 2015; Ruiz-Tovar, 2015; Sherman, 2015; Steinbeisser, 2017) |
Uitkomstmaat 2. Complicaties (belangrijk)
|
Laag GRADE |
Preoperatief gewichtsverlies verlaagt mogelijk de kans op complicaties na metabole chirurgie.
Bronnen: (Anderin,2015; Benotti, 2009; Blackledge, 2016; Giordano, 2014; Livhits, 2009) |
Samenvatting literatuur
Beschrijving studies
Het review van Livhits (2009) includeerde studies met patiënten die metabole chirurgie hadden ondergaan en zowel pre- als postoperatief gewichtsverlies rapporteerden. Het review includeerde vijftien studies, waarvan twaalf studies voldeden aan de PICO voor deze literatuuranalyse. Twee studies voldeden niet, omdat > 10% van de patiënten een maagbandje hadden gekregen. Eén studie ging over gewichtsverlies, voordat er besloten werd tot operatie, waarbij het onduidelijk was of het gewichtsverlies ook behouden was op het moment van de chirurgische ingreep. Er werden totaal 3,032 patiënten geïncludeerd in de twaalf overgebleven studies. Hiervan waren de studiedesigns als volgt: één RCT (Alami, 2007), drie prospectieve cohort studies (Alger-Mayer, 2008; Martin, 1995; Still, 2007) en 8 retrospectieve cohort studies. In alle studies kregen patiënten een open of laparoscopische Roux-en-Y gastric bypass (RYGB). De follow-up varieerde van 6 maanden tot 48 maanden.
Van de 19 aanvullende studies rapporteerde Solomon (2009) de 12 maanden follow-up van de RCT van Alami (2007). Drie studies was prospectieve cohortstudies en de overige vijftien studies waren retrospectieve cohortstudies. Benotti (2009) rapporteerde de complicaties van de populatie uit Still (2007) en Anderin (2015) rapporteerde over complicaties, waarbij een deel van de populatie van Anderin (2015) werd geïncludeerd. Acht studies includeerden patiënten met een RYGB, twee studies met een gastric bypass, vijf studies met een sleeve gastrectomie en vier studies includeerden verschillende operatietechnieken. De meeste studies hadden een follow-up van 1 jaar.
De meeste studies corrigeerden niet voor confounding of beschreven niet wat de follow-up duur was, hoeveel patiënten niet voldeden aan de inclusie, lost to follow-up waren of incomplete data hadden. Patiënten met incomplete data werden in een aantal studies geëxcludeerd.
Resultaten
Uitkomstmaat 1. Gewichtsverlies (cruciaal)
Zes studies rapporteerden het ongecorrigeerde gemiddelde postoperatieve percentage excess weight loss (% EWL) in een groep patiënten met preoperatief gewichtsverlies (n=510) versus patiënten zonder preoperatief gewichtsverlies (n=560). Het gepoolde gemiddelde verschil was 2,84% EWL (95% BI -1,73 tot 7,41) in het voordeel van patiënten met preoperatief gewichtsverlies (figuur 1).
Figuur 1 Postoperatief percentage excess weight loss tussen patiënten met preoperatief gewichtsverlies en zonder/ gering postoperatief gewichtsverlies
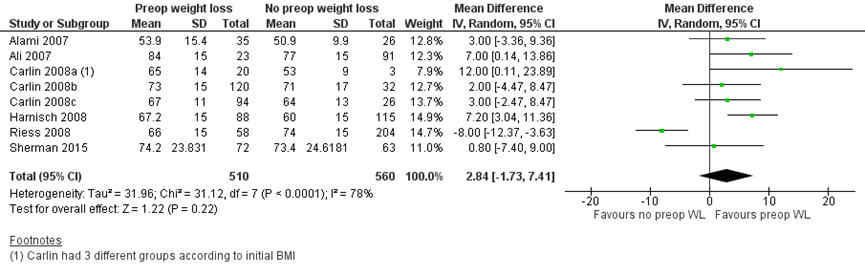
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Daarnaast rapporteerden andere studies op verschillende manieren over postoperatief gewichtsverlies, waardoor deze data niet te poolen was. Daarnaast hadden de studies verschillende follow-ups. Twaalf van deze studies rapporteerden een positieve associatie , 9 studies vonden geen associatie en 1 studie vond een negatieve associaties tussen preoperatief en postoperatief gewichtsverlies. Hieronder worden de resultaten van deze studies kort samengevat.
Positieve associatie:
Alvarado (2005) rapporteerde dat 1% meer preoperatief EWL gecorreleerd was met 1,8% extra postoperatief EWL na 1 jaar (n=90).
Huerta (2008) rapporteerde een gewichtsverlies na 2 jaar van 57% van het totale lichaamsgewicht in de groep zonder preoperatief gewichtsverlies (n=25) versus 62% in de groep met preoperatief gewichtsverlies (gemiddeld 8,3% van het totale lichaamsgewicht) (n=15).
Still (2007) rapporteerde de gecorrigeerde hazard ratio (HR) voor de kans op > 70% EWL bij 884 patiënten na 3 jaar follow-up. Preoperatief gewichtsverlies werd ingedeeld in 5 categorieën, waarbij 0 tot 5% excess body weight (EBW) verlies de referentie categorie was. De groep met > 10% EBW de hoogste kans had op meer dan 70% EWL. De HR van de categorieën waren als volgt; preoperatief > 5 EBW toename 1,16 (95% BI 0,68 tot 1,95), preoperatief 0 tot 5% EBW toename 1,08 (95% BI 0,67 tot 1,73), preoperatief 5 tot 10% EBW afname 1,20 (95% BI 0,79 tot 1,81), preoperatief >10 EBW afname 2,12 (95% 1,50 tot 3,01).
Fujioka (2008) gaf het gemiddelde % EWL van 121 patiënten weer in een grafiek. Na 1 jaar was het verschil in % EWL tussen een groep met gewichtstoename en gewichtsafname ongeveer 2% in het voordeel van de gewichtsafname groep, na 2 jaar was dit ongeveer 4%.
Alger-Mayer (2008) rapporteerde EBW afname bij 150 patiënten. Na drie jaar was dit gemiddeld 55,1% (SD 20,2%). Er was een correlatie tussen preoperatief EBW afname en postoperatief EBW afname na 3 jaar (r=0,225; p=0,006).
In de studie van Al-Khyatt (2017) was preoperatief EWL een voorspeller voor EWL een jaar na de operatie (regressie coëfficiënt 5,0; 95% BI 2,5 tot 7,5) (n=227).
Steinbeisser (2017) vond een verschil in gecorrigeerd % EWL tussen patiënten met < 5% preoperatief % EWL (gemiddeld 50,2% SE 1,6) en ≥ 5% EWL (gemiddeld 57,0 SE 0,9) bij 204 patiënten.
Hutcheon (2018) rapporteerde dat de odds op postoperatief % EWL na 12 maanden 7,557 maal hoger was in de groep patiënten die preoperatief na aan low calorie dieet ≥ 8 % EWL hadden vergeleken met patiënten die na dit dieet < 8% EWL hadden (n=355).
Kraus (2018) vond een associatie tussen preoperatief gewichtsverlies en postoperatief gewichtsverlies, met name 4 tot 6 maanden na de operatie bij 239 patiënten. Na 1 jaar had een patiënt met 10 kg gewichtsverlies 3,9% EWL extra vergeleken met patiënten zonder preoperatief gewichtsverlies. Na 2 jaar lijkt deze associatie te verdwijnen.
Gerben (2016) rapporteerde dat gewichtsverlies voorafgaand aan metabole chirurgie was geassocieerd met postoperatief gewichtsverlies. 9570 patiënten werden ingedeeld in percentielen op basis van relatief preoperatief gewichtsverlies. Hoe hoger het percentiel, hoe hoger de odds ratio (OR 1,88; 95% BI 1,66 tot 2,12 in 75e percentiel vergeleken met 25e percentiel, 2 jaar postoperatief).
De studie van Giordano (2014) vond dat patiënten met > 10% EWL preoperatief meer gewichtsverlies postoperatief hadden na 1 jaar follow-up, maar na 2 jaar was dit verschil verdwenen (n=548).
Ruiz-Tovar (2015) rapporteerde een correlatie tussen preoperatief EWL en postoperatief EWL na 1 (Pearson 0,848, p=0,043) en 2 jaar (Pearson 0,822; p=0,012) (n=50).
Geen associatie:
Jantz (2008) vond geen correlatie tussen maximaal preoperatief gewichtsverlies en postoperatief % EWL na 1 (R2=0,005), 2 (R2=0,004) en 4 jaar (R2=0,105).
Martin (1995) rapporteerde dat er geen verschil was tussen de groepen, maar rapporteerde geen getallen.
Parmar (2018) rapporteerde dat er geen significante associatie was tussen preoperatief gewichtsverlies en postoperatief gewichtsverlies na 1 jaar bij 192 patiënten, maar rapporteerde alleen een p-waarde van 0,44.
Eisenberg (2010) rapporteerde dat verandering in preoperatief BMI niet gecorreleerd was met verandering in postoperatieve BMI na 1 jaar. Alleen de p-waarde werd gerapporteerd (p=0,09) (n=256).
McNickle (2019) vond geen correlatie tussen preoperatief % EWL en % EWL na de operatie (n=127).
Parri (2015) vond geen associatie tussen pre- en postoperatief % EWL bij 118 patiënten na 1,2, 3 en 4 jaar. De regressiecoëfficiënt na 4 jaar was -0,2 (95% BI -0,6 tot 0,2).
Sherman (2015) schreef dat preoperatief gewichtsverlies geen betrouwbare voorspeller is voor postoperatief gewichtsverlies. Na 1 jaar was het percentage overtollig BMI verlies 74,2% (95% BI 68,7 tot 79,8) in de groep patiënten met preoperatief gewichtsverlies versus 73,4% (95% BI 67,2 tot 79,6) (n=141).
Krimpuri (2018) onderzocht of preoperatieve verandering in BMI geassocieerd was met postoperatieve verandering in BMI bij 218 patiënten. De regressiecoëfficiënt van preoperatieve verandering in BMI was 0,078 (p=0,647) na 1 jaar. De auteurs gaven aan dat preoperatief gewichtsverlies geen goede voorspeller voor postoperatief gewichtsverlies is.
Blackledge (2016) vond een gemiddeld % EWL na 1 jaar van 62,55% (95% BI 58,5 tot 66,6) de groep patiënten die preoperatief ≥ 5% EWL aankwam versus 65,4 (60,0 tot 70,7) in de groep patiënten die preoperatief ≥ 5% EWL verlies had (n=300). Na 2 jaar was dit respectievelijk 68,7% (61,1 tot 76,3) en 69,4% (57,9 tot 80,9).
Negatieve associatie:
Watanabe (2017) rapporteerde het percentage totaal gewichtsverlies (TWL) bij 247 patiënten. Het % TWL na 1 jaar leek lager in de groep met een hoger preoperatief % TWL. Dit was gemiddeld 27,1% (SD 10,2) in de groep met preoperatief > 5,1 %TWL versus 33,1% (SD 10,8) in de groep met preoperatieve gewichtstoename.
Uitkomstmaat 2. Complicaties (belangrijk)
Acht studies rapporteerden het aantal complicaties en werden gepoold. Patiënten met preoperatief gewichtsverlies hadden 57 complicaties (9,4%) versus 82 (12,5%) patiënten zonder preoperatief gewichtsverlies (n=654). Dit zijn ongecorrigeerde getallen. De gepoolde risk ratio (RR) was 0,88 (95% BI 0,65 tot 1,20) in het voordeel van patiënten met preoperatief gewichtsverlies (figuur 2).
Figuur 2 Complicaties bij patiënten met preoperatief gewichtsverlies en zonder/ gering postoperatief gewichtsverlies
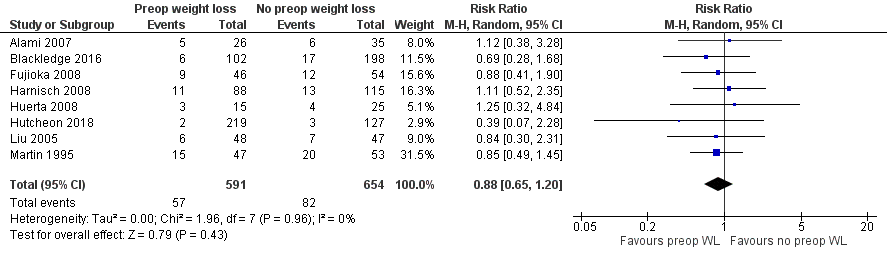
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Daarnaast rapporteerden vijf andere studies op verschillende manieren over het effect van preoperatief gewichtsverlies op complicaties.
Alvarado (2005) geïncludeerd in het review van Livhits (2009) gaf aan dat er geen correlatie was, maar rapporteerde geen getallen.
Benotti (2009) rapporteerde complicaties bij 881 patiënten die werden ingedeeld op basis van preoperatief gewichtsverlies in 5 categorieën, waarbij > 10% EBW de referentiecategorie was. Patiënten met preoperatief gewichtsverlies hadden een lagere kans op complicaties (aangekomen > 5% EBW: OR 1,95; 95% BI 1,06 tot 3,60; aangekomen 0 tot 5% EBW OR 1,18; 95% BI 1,05 tot 3,14; afgevallen 0 tot 5% EBW: OR 1,34; 95% BI 0,83 tot 2,17; afgevallen 6 tot 10% EWL 0,70; 95% BI 0,42 tot 1,16).
Anderin (2015) rapporteerde totaal 2,007 complicaties bij 22,327 patiënten die werden ingedeeld in percentielen op basis van relatief preoperatief gewichtsverlies. Het 25e percentiel was de referentiecategorie. De gecorrigeerde OR voor het 50e percentiel was 0,82 (95% CI 0,73 tot 0,93) en voor het 75e percentiel 0,87 (95% CI 0,82 tot 0,94). Patiënten met meer preoperatief gewichtsverlies hadden, dus een lagere kans op complicaties.
Giordano (2014) deelde 548 patiënten in 3 categorieën in; < 5% EWL, > 5 tot 10% EWL en 10% EWL. In de groepen hadden respectievelijk 44 van de 166 (26,5%), 40 van de 239 (16,7%) en 15 van de 143 (10,5%) patiënten complicaties.
Blackledge (2016) deelde 300 patiënten in op basis van preoperatief % EBW, namelijk ≥ 5% aankomen, 0 tot 4,99% aankomen, 0 tot 4,99% afvallen en ≥ 5% afvallen. Het percentage complicaties in de verschillende groepen was 12,5%, 5,9%, 6,7% en 4,8%, respectievelijk.
Bewijskracht van de literatuur
De bewijskracht is gebaseerd op observationeel onderzoek voor een prognostische vraag en start derhalve hoog (zie Werkwijze op het tabblad Verantwoording). De bewijskracht voor de uitkomstmaat is met drie niveaus verlaagd, één niveau gezien beperkingen in de onderzoeksopzet, zoals het niet rapporteren van patiënten lost to follow-up, het niet corrigeren voor confounding en het gebruik van retrospectieve data (risk of bias) en twee niveaus vanwege zowel klinische als statistische heterogeniteit (inconsistentie).
De bewijskracht is gebaseerd op observationeel onderzoek voor een prognostische vraag en start derhalve hoog (zie Werkwijze op het tabblad Verantwoording). De bewijskracht voor de uitkomstmaat gewichtsverlies is met twee niveaus verlaagd, één niveau gezien beperkingen in de onderzoeksopzet, zoals het niet rapporteren van patiënten lost to follow-up, het niet corrigeren voor confounding en het gebruik van retrospectieve data (risk of bias) en één niveau vanwege gering brede betrouwbaarheidsintervallen die zowel een klinisch relevant als geen verschil omvatten (inconsistentie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Is preoperatief gewichtsverlies een voorspeller voor betere postoperatieve resultaten bij/ na metabole chirurgie?
P: patiënten die metabole chirurgie ondergaan;
I: preoperatief gewichtsverlies (prognostisch);
C: -;
O: postoperatief gewichtsverlies en complicaties.
Relevante uitkomstmaten
De werkgroep achtte postoperatief gewichtsverlies een voor de besluitvorming cruciale uitkomstmaat en complicaties een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen. We hanteerden daarom, indien van toepassing, de onderstaande grenzen voor klinische relevantie en vergeleken de resultaten met deze grenzen: RR < 0,75 of > 1,25) (GRADE-recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). De interpretatie van continue uitkomstmaten is sterk context gebonden en hiervoor werden a priori geen grenzen voor klinische relevantie benoemd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 23 december 2018 met relevante zoektermen gezocht naar vergelijkende studies die postoperatief gewichtsverlies of complicaties vergeleken tussen patiënten met en zonder preoperatief gewichtsverlies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 2160 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Vergelijkende studies.
- Rapporteren van preoperatief gewichtsverlies en postoperatief gewichtsverlies en/ of complicaties.
Studies met > 10% patiënten met maagbanden zijn geëxcludeerd.
Op basis van titel en abstract werden in eerste instantie 42 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 22 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en één systematisch review en 19 aanvullende studies definitief geselecteerd.
Resultaten
Eén systematisch review met twaalf studies die voldeden aan de PICO en 19 aanvullende studies zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Al-Khyatt W, Ryall R, Leeder P, Ahmed J, Awad S. Predictors of Inadequate Weight Loss After Laparoscopic Gastric Bypass for Morbid Obesity. Obes Surg. 2017 Jun;27(6):1446-1452. doi: 10.1007/s11695-016-2500-x. PubMed PMID: 27943095.
- Anderin C, Gustafsson UO, Heijbel N, Thorell A. Weight loss before bariatric surgery and postoperative complications: data from the Scandinavian Obesity Registry (SOReg). Ann Surg. 2015 May;261(5):909-13. doi: 10.1097/SLA.0000000000000839. PubMed PMID: 25211265.
- Benotti PN, Still CD, Wood GC, Akmal Y, King H, El Arousy H, Dancea H, Gerhard GS, Petrick A, Strodel W. Preoperative weight loss before bariatric surgery. Arch Surg. 2009 Dec;144(12):1150-5. doi: 10.1001/archsurg.2009.209. PubMed PMID: 20026834; PubMed Central PMCID: PMC4139063.
- Blackledge C, Graham LA, Gullick AA, Richman J, Stahl R, Grams J. Outcomes associated with preoperative weight loss after laparoscopic Roux-en-Y gastric bypass. Surg Endosc. 2016 Nov;30(11):5077-5083. Epub 2016 Mar 11. PubMed PMID: 26969666; PubMed Central PMCID: PMC5119630.
- Eisenberg D, Duffy AJ, Bell RL. Does Preoperative Weight Change Predict Postoperative Weight Loss after Laparoscopic Roux-en-Y Gastric Bypass in the Short Term? J Obes. 2010;2010. pii: 907097. doi: 10.1155/2010/907097. Epub 2009 Aug 31. PubMed PMID: 20798850; PubMed Central PMCID: PMC2925384.
- Gerber P, Anderin C, Gustafsson UO, Thorell A. Weight loss before gastric bypass and postoperative weight change: data from the Scandinavian Obesity Registry (SOReg). Surg Obes Relat Dis. 2016 Mar-Apr;12(3):556-562. doi: 10.1016/j.soard.2015.08.519. Epub 2015 Sep 2. PubMed PMID: 26922166.
- Giordano S, Victorzon M. The impact of preoperative weight loss before laparoscopic gastric bypass. Obes Surg. 2014 May;24(5):669-74. doi: 10.1007/s11695-013-1165-y. PubMed PMID: 24357128.
- Hutcheon DA, Hale AL, Ewing JA, Miller M, Couto F, Bour ES, Cobb WS 4th, Scott JD. Short-Term Preoperative Weight Loss and Postoperative Outcomes in Bariatric Surgery. J Am Coll Surg. 2018 Apr;226(4):514-524. doi: 10.1016/j.jamcollsurg.2017.12.032. Epub 2018 Feb 2. PubMed PMID: 29402531.
- Kraus R, Stekhoven DJ, Leupold U, Marti WR. Linear Mixed Effects Analysis Reveals the Significant Impact of Preoperative Diet Success on Postoperative Weight Loss in Gastric Bypass Surgery. Obes Surg. 2018 Aug;28(8):2473-2480. doi: 10.1007/s11695-018-3189-9. PubMed PMID: 29623589.
- Krimpuri RD, Yokley JM, Seeholzer EL, Horwath EL, Thomas CL, Bardaro SJ. Qualifying for bariatric surgery: is preoperative weight loss a reliable predictor of postoperative weight loss? Surg Obes Relat Dis. 2018 Jan;14(1):60-64. doi: 10.1016/j.soard.2017.07.012. Epub 2017 Jul 15. PubMed PMID: 29287756.
- Livhits M, Mercado C, Yermilov I, Parikh JA, Dutson E, Mehran A, Ko CY, Gibbons MM. Does weight loss immediately before bariatric surgery improve outcomes: a systematic review. Surg Obes Relat Dis. 2009 Nov-Dec;5(6):713-21. doi: 10.1016/j.soard.2009.08.014. Epub 2009 Sep 10. Review. PubMed PMID: 19879814.
- McNickle AG, Bonomo SR. Predictability of first-year weight loss in laparoscopic sleeve gastrectomy. Surg Endosc. 2017 Oct;31(10):4145-4149. doi: 10.1007/s00464-017-5467-3. Epub 2017 Mar 9. PubMed PMID: 28281113.
- Parmar AD, et al. Impact of Preoperative Weight Loss on Postoperative Weight Loss After Sleeve Gastrectomy. Bariatric Surgical Practice and Patient Care, 2018, 13.2: 69-74.
- Parri A, Benaiges D, Schröder H, Izquierdo-Pulido M, Ramón J, Villatoro M, Flores-Le Roux J, Goday A. Preoperative predictors of weight loss at 4 years following bariatric surgery. Nutr Clin Pract. 2015 Jun;30(3):420-4. doi: 10.1177/0884533614568154. Epub 2015 Jan 28. PubMed PMID: 25631913.
- Ruiz-Tovar J, Boix E, Bonete JM, Martínez R, Zubiaga L, Díez M, Calpena R; Group OBELCHE. Effect of preoperative eating patterns and preoperative weight loss on the short- and mid-term weight loss results of sleeve gastrectomy. Cir Esp. 2015 Apr;93(4):241-7. doi: 10.1016/j.ciresp.2014.04.010. Epub 2014 Oct 22. English, Spanish. PubMed PMID: 25438772.
- Sherman WE, Lane AE, Mangieri CW, Choi YU, Faler BJ. Does Preoperative Weight Change Predict Postoperative Weight Loss After Laparoscopic Sleeve Gastrectomy? Bariatr Surg Pract Patient Care. 2015 Sep 1;10(3):126-129. PubMed PMID: 26421248; PubMed Central PMCID: PMC4575532.
- Solomon H, Liu GY, Alami R, Morton J, Curet MJ. Benefits to patients choosing preoperative weight loss in gastric bypass surgery: new results of a randomized trial. J Am Coll Surg. 2009 Feb;208(2):241-5. doi: 10.1016/j.jamcollsurg.2008.09.028. Epub 2008 Dec 4. PubMed PMID: 19228536.
- Stegenga H, Haines A, Jones K, Wilding J; Guideline Development Group. Identification, assessment, and management of overweight and obesity: summary of updated NICE guidance. BMJ. 2014 Nov 27;349:g6608. doi: 10.1136/bmj.g6608. PubMed PMID: 25430558.
- Steinbeisser M, McCracken J, Kharbutli B. Laparoscopic Sleeve Gastrectomy:Preoperative Weight Loss and Other Factors as Predictors of Postoperative Success. Obes Surg. 2017 Jun;27(6):1508-1513. doi: 10.1007/s11695-016-2520-6. PubMed PMID: 28050788.
- Watanabe A, Seki Y, Haruta H, Kikkawa E, Kasama K. Preoperative Weight Loss and Operative Outcome After Laparoscopic Sleeve Gastrectomy. Obes Surg. 2017 Oct;27(10):2515-2521. doi: 10.1007/s11695-017-2697-3. Erratum in: Obes Surg. 2019 Feb 11;:. PubMed PMID: 28478582.
- WHO Expert Consultation. Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies. Lancet. 2004 Jan 10;363(9403):157-63. Review. Erratum in: Lancet. 2004 Mar 13;363(9412):902. PubMed PMID: 14726171.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Livhits 2009 |
Yes |
Yes |
Included: yes, excluded: no |
Yes |
Unclear |
Yes |
Yes |
No |
SR: yes, individual studies: unclear |
Table of quality assessment - prognostic factor (PF) studies
Based on: QUIPSA (Haydn, 2006; Haydn 2013)
|
Study reference
(first author, year of publication) |
Study participation
Study sample represents the population of interest on key characteristics?
(high/moderate/low risk of selection bias) |
Study Attrition
Loss to follow-up not associated with key characteristics (i.e., the study data adequately represent the sample)?
(high/moderate/low risk of attrition bias) |
Prognostic factor measurement
Was the PF of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to PF) |
Outcome measurement
Was the outcome of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to outcome) |
Study confounding
Important potential confounders are appropriately accounted for?
(high/moderate/low risk of bias due to confounding) |
Statistical Analysis and Reporting
Statistical analysis appropriate for the design of the study?
(high/moderate/low risk of bias due to statistical analysis) |
|
Eisenberg 2010 |
Moderate |
High |
Moderate |
Moderate |
High |
High |
|
Solomon 2009 |
Low |
High |
Moderate |
Moderate |
Low |
Low |
|
Benotti 2009 |
Low |
Moderate |
Moderate |
Low |
Low |
Low |
|
Liu 2005 |
High |
High |
Moderate |
Low |
High |
High |
|
Al-Khyatt 2017 |
Low |
High |
Moderate |
Moderate |
Moderate |
Moderate |
|
McNickle 2017 |
Moderate |
High |
Moderate |
Moderate |
High |
High |
|
Steinbeisser 2017 |
Moderate |
High |
Moderate |
Moderate |
Moderate |
Moderate |
|
Watanabe 2017 |
Moderate |
Low |
Moderate |
Moderate |
Moderate |
Moderate |
|
Hutcheon 2018 |
Low |
High |
High |
Moderate |
Moderate |
Moderate |
|
Parmar 2018 |
High |
High |
High |
High |
Low |
Low |
|
Kraus 2018 |
Moderate |
Moderate |
Moderate |
Moderate |
Low |
Low |
|
Gerber 2016 |
Moderate |
High |
High |
Moderate |
Moderate |
Moderate |
|
Sherman 2015 |
Moderate |
High |
Moderate |
Moderate |
High |
High |
|
Anderin 2015 |
Moderate |
High |
High |
Low |
Moderate |
Moderate |
|
Giordano 2014 |
Moderate |
Low |
Moderate |
Moderate |
High |
High |
|
Parri 2015 |
Low |
Moderate |
Moderate |
Moderate |
Moderate |
Moderate |
|
Ruiz-Tovar 2015 |
Low |
Low |
Moderate |
Moderate |
High |
High |
|
Krimpuri 2018 |
Moderate |
High |
Moderate |
Moderate |
Moderate |
Moderate |
|
Blackledge 2016 |
Moderate |
High |
Moderate |
Moderate |
Low |
Low |
Evidence table for systematic review of RCTs and observational studies
|
Study reference |
Study characteristics |
Patient characteristics |
Prognostic factor |
Follow-up |
Estimates of prognostic effect |
Comments |
|
Livhits, 2009
PS., study characteristics and results are extracted from the SR (unless marked with *) |
SR and meta-analysis of RCTs and cohort studies)
Literature search up to January 2009
A: Alvarado 2005 B: Alami 2007 C: Ali 2007 D: Harnisch 2008 E: Carlin 2008 F: Jantz 2008 G: Riess 2008 H: Martin 1995 I: Huerta 2008 J: Still 2007
Study design: A: retrospective cohort B: RCT C: retrospective cohort D: retrospective cohort E: retrospective cohort F: retrospective cohort G: retrospective cohort H: prospective cohort I:retrospective cohort J: prospective cohort K:retrospective cohort L: prospective cohort
Setting and Country: Department of Surgery, University of California, Los Angeles, David Geffen School of Medicine, USA
Source of funding and conflicts of interest: The authors have no commercial associations that might be a conflict of interest in relation to this article. Funding not reported. |
Inclusion criteria SR: The selection criteria included studies published in English with patients ≥18 years old (studies with patients both >18 and <18 years old were accepted) who had undergone bariatric surgery (i.e., open or laparoscopic gastric bypass, laparoscopic gastric banding, biliopancreatic diversion, vertical banded gastroplasty, or gastric sleeve). Accepted study designs included case series/cohort, case control, and randomized control trials.
Exclusion criteria SR: studies with a sample size of <10 patients. Studies that did not report the preoperative and postoperative weight loss were excluded.
15 studies included in de SR, 12 studies included for this literature summary.
Important patient characteristics at baseline:
Number of patients A: 90 B: 35/ 26 C: 351 D: 115/ 88 E: 295 F: 384 G: 279/ 74 H: 53/ 47 I: 25/ 15 J: 884 K:121 L: 150
Mean age A: 42 B: 44.9 SD 7.8/ 42.4 SD 10.5 C: 42.7 D: 41.4/ 44 E: 45 SD 10 F: 43.3 SD 9.3 G: 42.7 SD 9.5/ 43.3 SD 9.2 H: 38.8 SD 9.2/ 40.2 SD 8.3 I: 50 SD 1.3 J: 45 SD 10 K: 48 L: 45.3 SD 8.9
Sex, woman (%): A: 90 B: 83.6 C: 92 D: 84.7 E: 89 F: 82.6 G: 70 H: 84 I: 30 J: 78 K:83 L: 80
Baseline BMI A: 48.1 B: 49.3 SD 6.4/ 48.7 SD 6.6 C: 46.7 D: Not reported E: 51 SD 7 F: 48 SD 5.9 G: 47 SD 5.7/ 54.2 SD 6.7 H: 53.0 SD 7.2/ 58.4 SD 11.6 I: 49 SD 1.0 J: 49.2 K:52 SD 10 L: 43.5 SD 5.18
Operation type A: LRYGB B: LRYGB C: LRYGB D: LRYGB E: LRYGB F: LRYGB G: LRYGB H: ORYBG I: ORYGB J: ORYGB and LRYGB K:ORYGB and LRYGB L: RYGB
|
Preoperative weight loss |
End-point of follow-up: Months A: 12 B: 6 C: 36 D: 24 E: 12 F: 48 G: 12 H: 48 I: 24 J: 36 K:24 L: 36
For how many participants were no complete outcome data available? A: N/A B: 39 (available data for 61 of the 100 patients) C: Of the 351 patients who underwent LRYGB, follow-up data were available for 302 (86%) at 6 months, 246 (70.1%) at 12 months, 167 (47.6%) at 24 months, and 71 (20.2%) at 36 months. D: N/A E: N/A F: The postoperative year 2 data were complete for 184 patients. At postoperative year 4, the data were complete for 42 patients. G: Riess 2008 H: Martin 1995 I: Huerta 2008 J: Still 2007 K:Fujioka 2008 L: Alger-Mayer 2008
|
Outcome measure-1 Postoperative weight loss* Defined as %EWL, unless stated otherwise A: An increase of 1% of preoperative weight loss correlated with an increase of 1.8% of postoperative EWL at 1 year (P<0.05)
Preoperative weight loss correlated significantly with postoperative EWL even after accounting for age, gender and co-morbid factors.
B: WL: 53.9 SD 15.4 No WL: 50.9 SD 9.9
C: 1 year WL: 74.6% No WL:76%
2 years WL: 69.7% No WL:79%
3 years WL: 69.2.6% No WL: 69%
D: 1 year WG: 63.5% WL: 63.9% P=0.82
2 years WG: 66.9% WL: 64.4 P=0.51
E: BMI<50 5 lb WL: 70 SD 16 No 5 lb WL: 70 SD 17
BMI 50-60 5% WL: 63 SD 1 No 5% WL: 61 SD 3
BMI ≥60 10% WL: 58 SD 17 No 10% WL: 47 SD 9
F: OR (95% CI) maximum preop weight loss versus no maximum preop weight loss adjusted for gender Excess weight loss goal of ≥50% 1 year: 0.98 (0.87–1.10) 2 years: 1.72 (0.83–3.55) 4 years: 0.45 (0.19–1.08) G: No WL (<10 lb): 74% SD 15 WL (>10 lb): 66% SD 15 P=0.01 H: “No difference”
I: No TWL: 57% of total body weight loss TWL (mean 8.3%): 62% of total body weight loss J: Adjusted HR (95% CI) for chance of >70% EWL
>5 EBW gain: 1.16 (0.68-1.98) 0-5 EBW gain: 1.08 (0.67-1.73) 0-5 EBW loss: ref 5-10 EBW loss: 1.20 (0.79-1.81) >10 EBW loss: 2.12 (1.50-3.01)
Adjusted for age, sex, and presence of comorbidities K: 1 year WG >0 lb (mean 2.6%): 60 WL >0 lb (mean 3.9%): 58
2 years WG >0 lb (mean 2.6%): 70 WL >0 lb (mean 3.9%): 66
Results abstracted from graph L: 3 year WL: >0≤5 47.6 SD 22.1 >5≤10 56.2 SD 19 >10≤15 54.8 SD 22.6 >15≤25 60.3 SD 14.3 >25 61.4 SD 16.6
No WL: 49.4% SD 23.9
Outcome measure-2 Complications* A: “No correlation” B: No WL: n=6 of the 35 10% EWL: n=5 of the 26 C: NR D: WG ≥10 lb (5.45%): 13 of the 115 WL ≥10 lb (5.41%): 11 of the 88 E: NR F: NR G: NR H: No WL: 20 of the 53 WL ≥7.5kg: 15 of the 47 I: No TWL: 4 of the 25 TWL (mean 8.3%): 3 of the 15 J: NR K: WG>0 ln (mean 2.6%: 12 of the 54 WL>0 lb (mean 3.9%): 9 of the 46 L: NR
|
Author’s conclusion Preoperative weight loss before bariatric surgery appears to be associated with greater weight loss postoperatively and might help to identify patients who would have better compliance after surgery. |
%EWL: percentage excess weight loss; LRYGB: laparoscopic Roux-en-Y gastric bypass; N/A: not applicable; NR: not reported; ORYGB: open RYGB, WG: weight gain; WL: weight loss
Evidence table for prognostic factor studies
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Cassie 2011 |
Review heeft een bredere PICO, zoekdatum is niet gerapporteerd, daarom Livits (2009) als uitganspunt genomen |
|
Kuwada 2011 |
Voldoet niet aan PICO: vergelijk mandated medical program versus geen program |
|
Antoniou 2017 |
Geen SR of origineel artikel |
|
Howitz 2016 |
>10% maagbanden |
|
Kim 2017 |
Geen SR of origineel artikel |
|
Tewksbury 2017 |
Geen SR of origineel artikel |
|
Gerber 2015 |
Review heeft smallere PICO, daarom Livits (2009) als uitganspunt genomen |
|
Ochner 2012 |
Livits (2009) als uitganspunt genomen |
|
Kadeli 2012 |
>10% maagbanden |
|
Mrad 2018 |
>10% maagbanden |
|
Adams 2013 |
Geen SR of origineel artikel |
|
Stewart 2016 |
Voldoet niet aan PICO: effect van leefstijlinterventies |
|
Schneider 2018 |
Voldoet niet aan PICO: vergelijk mandated medical program versus geen program |
|
Livhits 2012 |
Bredere PICO, daarom Livits (2009) als uitganspunt genomen |
|
Rothwell 2014 |
>10% maagbanden |
|
Mahawar 2015 |
Geen SR of origineel artikel |
|
Conaty 2016 |
Onduidelijk hoeveel maagbanden geïncludeerd zijn |
|
Dambrauskas 2013 |
Conference abstract |
|
Brown 2013 |
>10% maagbanden |
|
Ochner 2010 |
>10% maagbanden |
|
Binda 2016 |
Geeft geen postoperatief gewichtsverlies, alleen BMI waarde na de operatie in patiënten met en zonder preoperatief gewichtsverlies |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 28-10-2020
Laatst geautoriseerd : 28-10-2020
Geplande herbeoordeling :
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Algemene indicatiestelling |
NVvH |
2020 |
2025 |
1x per 5 jaar |
NVvH |
|
|
[1] Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om tot een richtlijn te komen waarin de meest recente kennis omtrent de chirurgische zorg voor patiënten met obesitas is vastgelegd.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstige obesitas (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. F.J. Berends, chirurg, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Dr. I.F. Faneyte, chirurg, ZiekenhuisGroep Twente, Almelo/Hengelo, Nederlandse Vereniging voor Heelkunde
- Dr. R. Schouten, chirurg, Flevoziekenhuis, Almere, Nederlandse Vereniging voor Heelkunde
- Dr. F.M.H. van Dielen, chirurg, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. van Heurn, hoogleraar kinderchirurgie, chirurg, Amsterdam UMC locatie AMC, Amsterdam, plaats, Nederlandse Vereniging voor Heelkunde
- Dr. S. Bouma- de Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.C.E. Vreugdenhil, kinderarts, MUMC+, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.P. van Beek, internist, UMCG, Groningen, Nederlandse Internisten Vereniging
- Dr. J.S. Burgerhart, internist i.o., Erasmus MC, Rotterdam tot 31 december 2019, vanaf 1 januari 2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk, Nederlandse Internisten Vereniging
- Dr. M.J.M. Groenen, MDL-arts, Rijnstate, Arnhem, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. S.V. Koenen, gynaecoloog, Elisabeth-TweeSteden-Ziekenhuis, Tilburg, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. M.S.Q. Kortenhorst, gynaecoloog i.o. UMC Utrecht, Utrecht, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. R.C. Painter, gynaecoloog, Amsterdam UMC, locatie AMC, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J.O.E.H. van Laar, gynaecoloog, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
- Dr. C. Hinnen, klinisch psycholoog, LUMC, Leiden, Nederlands Instituut van Psychologen
- E. Govers BSc., diëtist, Amstelring, Amsterdam, Nederlandse Vereniging van Diëtisten
Klankbordgroep
- Prof. dr. E.F.C. van Rossum, internist, Erasmus MC, Rotterdam, Nederlandse Internisten Vereniging
Met ondersteuning van
- Dr. A. Bijlsma, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot oktober 2018)
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Drs. A.A. Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- J.C.F. Ket, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- I. van Dusseldorp, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- E. Delvaux, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam WG-lid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie (voorstel) |
|
Berends (voorzitter) |
Freelance chirurg |
Consultant Johnson & Johnson tot september 2018 (betaald) |
De firma Johnson & Johnson heeft een "baratric and metabolic board" waarvan ik lid ben. (Betaald) |
geen |
geen |
|
geen |
24-11-2017 |
Geen. Er staan geen producten van Johnson in deze richtlijn. |
|
Hinnen |
Oncologisch centrum, LUMC, afdeling medische psychologie en ziekenhuis-psychiatrie, MC Slotervaart |
Bestuur Nederlandse Behavioral Medicine Federatie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
31-10-2017 |
Geen |
|
Schouten |
Chirurg, Flevoziekenhuis te Almere |
geen |
geen |
geen |
geen |
geen |
geen |
8-11-2017 |
Geen |
|
Groenen |
Maag Darm Leverarts, werkzaam in Rijnstate Ziekenhuis te Arnhem |
Concilium Gastroenterolgicum, onbetaald |
geen |
geen |
Betrokken bij onderzoek betreffende Chronische darmontsteking (Crohn en Colitis Ulcerosa) waarbij ondersteuning door industrie. |
geen |
geen |
9-11-2017 |
Geen, gefinancierde onderzoeken/ training gaan niet over obesitas |
|
Faneyte |
Chirurg 75% ZiekenhuisgroepTwente |
geen |
geen persoonlijke financiële belangen behoudens eigen werk als vrijgevestigd bariatrisch chirurg |
geen |
geen |
geen |
geen |
9-11-2017 |
Geen |
|
Govers |
Diëtist, Stichting Amstelring (inmiddels niet meer werkzaam) |
Voorzitter Kenniscentrum Diëtisten Overgewicht en Obesitas, Amsterdam, |
geen |
geen |
geen |
geen |
- |
26-11-2017 |
Geen |
|
Van Laar |
gynaecoloog |
Assistant professor TU/e |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Koenen |
Gynaecoloog, UMC Utrecht (vanaf 1 januari 2018 ETZ, Tilburg) 1,0 FTE werkzaam |
Voorzitter Werkgroep Otterlo NVOG (werkgroep die verantwoordelijk is voor richtlijnen over de Verloskunde). Onbetaald |
geen |
geen |
geen |
geen |
nee |
12-12-2017 |
Geen |
|
Painter |
Gynaecoloog, Afdeling Verloskunde, AMC, Amsterdam 0,9 FTE |
• Affiliatie: Gynaecoloog Amsterdam UMC • lid van de werkgroep modulaire richtlijn Zwangerschap en Obesitas (NVOG). • vice voorzitter van de NVOG Pijler FMG Wetenschapscommissie • voorzitter SIG NVOG Diabetes, Obesitas en Zwangerschap • lid van de Koepel Wetenschap NVOG • lid van de RIVM Commissie Programma Nationale Hielprik Screening (namens de NVOG) • lid stuurgroep James Lind Alliance PSP 'Hyperemesis Gravidarum' |
geen |
geen |
CVON/ Nederlandse Hartstichting, WOMB project (hoofdaanvrager prof Roseboom) AMC-VuMc Alliantie OiO (mede aanvrager dr AE Budding) |
Lid Wetenschappelijke Advies Raad Stichting ZEHG (Hyperemesis Gravidarum patiënten vereniging) |
geen |
29-11-2017 |
Geen, de onderzoeken betreffen onderwerpen die buiten de afbakening van de richtlijn vallen. |
|
Kortenhorst |
Gynaecoloog-in-opleiding Wilhelmina Kinderziekenhuis |
geen |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Cnossen |
Ervaringsdeskundige werkgroep bariatrie van de Nederlandse stichting Over Gewicht -(Onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
19-1-2018 |
Geen |
|
Burgerhart |
internist- vasculair geneeskundig i.o. in opleiding Erasmus MC Rotterdam t/m 31-12-2019. Vanaf 1-1-2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk |
geen |
geen |
geen |
geen |
geen |
geen |
18-5-2018 |
Geen |
|
Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
geen |
geen |
geen |
geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische |
geen |
28-2-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
|
Beek |
internist-endocrinoloog (100%) in het UMC Groningen. |
geen |
geen |
geen |
Select studie. Effecten op cardiovasculaire uitkomsten bij patiënten met overgewicht of obesitas (Novo Nordisk). Het betreft een multicenter trial waarbij in totaal 17500 patiënten worden geïncludeerd. Mijn centrum zal 25 patiënten includeren en NL in totaal 250. Ik ben National Leader in deze studie die is gestart 24-10-2018. Uitkomsten worden verwacht in 2023. Geen belangen verstrengeling zowel inhoudelijk (resultaten nog niet bekend) als financieel. |
geen |
geen |
13-7-2018 |
Geen
Uitkomsten van de studie worden verwacht in 2023. Redelijkerwijs zal deze studie dus geen belangenverstrengeling opleveren omdat er geen uitkomsten nog van de studie zijn. |
|
Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
geen |
geen |
geen |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). Voorlopige startdatum 1 september 2018 |
geen |
6-3-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Stichting Over Gewicht (voorheen Nederlandse Obesitas Vereniging) plaats te laten nemen in de werkgroep. De volgende patiëntenorganisaties zijn uitgenodigd voor de Invitational conference: Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht. Een verslag van deze bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie (uitgevoerd op 18 december 2017) werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende stakeholders tijdens een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (GIN-database), systematische reviews, literatuur over patiëntvoorkeuren en patiëntrelevante uitkomstmaten (Medline, Comet-initiative en COSMIN database). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens is aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in het aanverwante product Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Kennisinstituut. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. 2015
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
