Perioperatief en postoperatief management bij rAAA
Uitgangsvraag
Wat is in de postoperatieve periode na behandeling van een rAAA de optimale strategie voor het opsporen en behandelen van het abdominaal compartimentsyndroom en darmischemie?
Deze uitgangsvraag omvat de volgende deelvragen:
- Wat is het beleid met betrekking tot het abdominaal compartimentsyndroom bij patiënten die geopereerd zijn voor een rAAA?
- Wat is het beleid met betrekking tot darmischemie bij patiënten die geopereerd zijn voor een rAAA?
Aanbeveling
Voer geen routinematige coloscopie uit in de postoperatieve periode van een patiënt die behandeld is voor een rAAA om darmischemie op te sporen.
Bepaal zowel na open als na endovasculaire behandeling van een rAAA regelmatig de intra-abdominale druk om tijdig het abdominaal compartimentsyndroom op te sporen.
(ESVS - Aanbeveling 71)
Verricht bij een abdominaal compartimentsyndroom na behandeling voor een rAAA een decomprimerende laparotomie.
(ESVS - Aanbeveling 72)
Overweeg sluiting middels vacuüm therapie na een open buikbehandeling voor het behandelen van het abdominaal compartimentsyndroom na behandeling voor een rAAA.
(ESVS - Aanbeveling 73)
Overwegingen
Deelvraag 1. Wat is het beleid ter preventie en behandeling van abdominaal compartimentsyndroom?
Verhoogde intra-abdominale druk komt regelmatig voor na zowel open als endovasculaire behandeling van een rAAA. Een intra-abdominale druk van meer dan 12 mmHg is verhoogd. Indien de druk langdurig > 20 mmHg is en er tekenen zijn van abdominale eindorgaan schade, spreekt men van een abdominaal compartimentsyndroom.
Risicofactoren voor een abdominaal compartimentsyndroom na EVAR zijn onder andere:
- gebruik van een Aorta Occlusie Ballon (AOB);
- ernstige stollingsstoornissen;
- massale transfusie behoefte;
- preoperatief verlies van bewustzijn;
- preoperatief lage bloeddruk;
- spoed conversie van een bifurcatie naar een aorta-uniiliacale endoprothese.
De werkgroep gaat ervan uit dat de risicofactoren 1 tot en met 5 ook voor open behandeling gelden, alhoewel dit niet als zodanig in de ESVS richtlijn 2019 beschreven staat. Het abdominaal compartimentsyndroom is sterk geassocieerd met ernstige en vaak langdurige complicaties en tevens met mortaliteit. Daarom moet bij alle patiënten die chirurgisch behandeld zijn voor een rAAA regelmatig de intra-abdominale druk bepaald worden en verder worden gehandeld conform onderstaand algoritme dat afkomstig is uit de ESVS-richtlijn (2019).
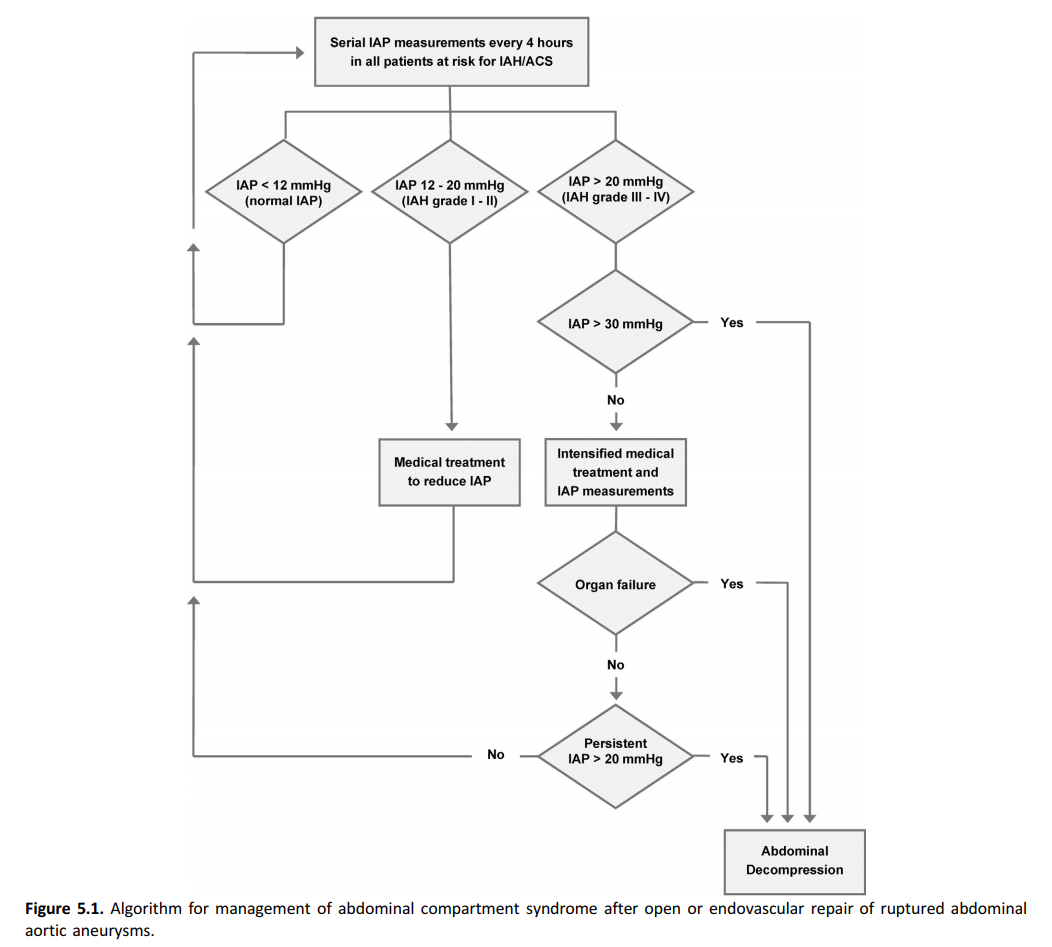
Deelvraag 2. Wat is het beleid ter preventie van darmischemie na geruptureerd AAA?
Het is onbekend wat het effect is van routinematige coloscopie na een geruptureerd AAA ten aanzien van mortaliteit, vergeleken met coloscopie op indicatie. De systematische review van Von Meijenfeldt (2018) beschreef een positief voorspellende waarde van 73% en een negatief voorspellende waarde van 92% bij patiënten die zijn behandeld voor een geruptureerd AAA. Dit betekent dat men kan verwachten dat 73% van deze patiënten met een positieve coloscopie ook inderdaad een darmischemie graad III heeft. Verder kan men verwachten 92% van de patiënten met een negatieve coloscopie geen darmischemie heeft. De bewijskracht van de studies waar deze gegevens op zijn gebaseerd is echter zeer laag. De kans is groot dat de positief en negatief voorspellende waarde in de dagelijkse praktijk substantieel anders zijn dan die gerapporteerd in de studies geïncludeerd in deze systematische review.
Waarden en voorkeuren van patiënten
De module “Informatievoorziening en besluitvorming” beschrijft wat patiënten met een AAA belangrijk vinden in de informatievoorziening en besluitvorming.
Rationale/ balans tussen de bovenstaande argumenten
Uit de beschikbare literatuur blijkt dat routinematige screening middels coloscopie om darmischemie/abdominaal compartimentsyndroom op te sporen in de postoperatieve periode na rAAA niet zinvol is. Wel is regelmatige bepaling van de intra-abdominale druk aangewezen om vroegtijdig een abdominaal compartimentsyndroom op te sporen. Indien een abdominaal compartimentsyndroom optreedt moet dit met een decomprimerende laparotomie behandeld worden. Indien hierna een open buikbehandeling volgt, verdient het aanbeveling om voor de sluiting vacuüm assistentie te overwegen (ESVS-richtlijn, 2019).
Onderbouwing
Achtergrond
Patiënten die vanwege een rAAA geopereerd zijn, zowel open als endovasculair, hebben een verhoogde kans op het abdominaal compartimentsyndroom en darmischemie.
Conclusies
|
- GRADE |
Het abdominaal compartimentsyndroom komt frequent voor na zowel open als endovasculaire behandeling van het rAAA. Aangezien het abdominaal compartimentsyndroom sterk geassocieerd is met morbiditeit en mortaliteit wordt intensieve monitoring van de intra-abdominale druk aangeraden voor alle patiënten die aan een rAAA geopereerd zijn.
Bronnen: (ESVS-richtlijn, 2019) |
|
- GRADE |
Een chirurgische decompressie is de behandeling van keuze wanneer een abdominaal compartimentsyndroom optreedt en medicamenteuze therapie onvoldoende is.
Bronnen: (ESVS-richtlijn, 2019) |
|
- GRADE |
Wij vonden geen (gerandomiseerde) studies waarin het effect van routinematige postoperatieve coloscopie op mortaliteit, morbiditeit, kosteneffectiviteit en patiënttevredenheid werd onderzocht bij patiënten met een geruptureerd AAA. |
|
Zeer laag GRADE |
De diagnostische accuratesse van routinematige coloscopie voor het detecteren van graad III darmischemie bij patiënten met een geruptureerd AAA is onduidelijk met een positieve en negatieve voorspellende waarde van respectievelijk 73% en 92%.
Bronnen: (von Meijenfeldt, 2018) |
Samenvatting literatuur
Description of studies
Most of the studies in the systematic review were observational non-comparative studies. Included were: 10 prospective cohort studies, 1 analysis of retrospective registry data and 1 study which retrospectively analyzed data of a randomized controlled trial (initially set up for an evaluation of an outcome unrelated to the PICO). The study size was between 34 and 107 participants. The studies varied in terms of outcome measures. Ten studies reported the incidence of colonic ischemia (Grade I-III), 5 studies additionally described the mortality rate and 2 studies determined the sensitivity and specificity of routine colonoscopy after rAAA repair. Grade I colonic ischemia was defined as mucosal ischemia, Grade II was defined as mucosal ischemia and involvement of the muscularis layers, and Grade III was defined as transmural ischemia, gangrene, and perforations. The pooled sensitivity and specificity of routine colonoscopy and diagnostic odds ratios were calculated for Grade III colonic ischemia by the authors of the systematic review.
The outcomes in the study by Jalalzadeh (2018) were the prevalence of colonic ischemia, bowel perforation, bowel resection, stoma placement, and abdominal compartment syndrome; combined 30-day or in-hospital death rate, and positive predictive value of sigmoidoscopy for detection of transmural colonic ischemia (when performed based on clinical suspicion of colonic ischemia).
Results
Patient populations of the 12 studies in the systematic review were similar, however some of these studies included patients with occlusive disease and patients with non-ruptured AAA (von Meijenfeldt, 2018). The results of the 4 studies in patients with rAAA are presented per outcome measure.
Mortality rate (crucial)
None of the studies assessed the effect of routine colonoscopy on mortality rate as compared to colonoscopy performed in case of clinical suspicion of colonic ischemia.
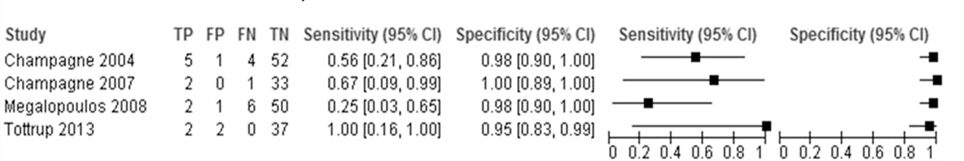
In the study by Champagne (2004), the mortality rate from Grade III colonic ischemia was 55.5 % (5 of 9 patients). Mortality was not reported in the study by the same author in 2007 (Champagne, 2007). In the study by Megalopoulos (2008) transmural ischemia developed in 13 patients (22% of the study population), of whom 7 died. Tøttrup (2013) found some degree of colonic ischemia in 22% of their study population (9 out of 41 patients) and reported the 30-day mortality to be 44.4% (4 out of 9 patients) among patients with ischemia versus 12.5% (4 out of 32 patients) in patients who had normal findings at sigmoidoscopy.
Morbidity (important)
No studies assessed the effect of routine colonoscopy on morbidity as compared to colonoscopy performed in case of clinical suspicion of colonic ischemia.
Cost-effectiveness (important)
None of the studies assessed the effect of routine colonoscopy on cost-effectiveness as compared to colonoscopy performed in case of clinical suspicion of colonic ischemia.
Patient satisfaction (important)
None of the studies assessed the effect of routine colonoscopy on patient satisfaction as compared to colonoscopy performed in case of clinical suspicion of colonic ischemia.
Diagnostic accuracy of colonoscopy (important)
Sensitivity and specificity
The pooled sensitivity of routine colonoscopy for detection of Grade III colonic ischemia across the four studies in patients with rAAA included in the meta-analysis was 50% (95% CI: 28 to 72), and the pooled specificity was 97% (95% CI: 92 to 99) (Von Meijenfeldt, 2018). The sensitivity and specificity for individual studies can be found in Figure 1.
Figure 1 Sensitivity and specificity of routine colonoscopy confirmed at positive laparotomy or postmortem confirmation of colonic ischemia
True positives, true negatives, false positives, false negatives (important)
Table 1 depicts the number of true positives, true negatives, false positives and false negatives per 1000 patients undergoing routine colonoscopy, estimated form the pooled sensitivity and specificity for Grade III colonic ischemia reported by Von Meijenfeldt (2018). The prevalence of colonic ischemia in patients with rAAA was extracted from a systematic review by Jalalzadeh (2019).
Table 1 The number of true positives, true negatives, false positives and false negatives per 1000 patients tested
|
Test result |
Number of results per 1.000 patients tested (95% CI) |
Number of partici-pants |
Certainty of the Evidence (GRADE) |
Comments |
||
|
|
Prevalence 10% Typically seen in average rAAA patients |
Prevalence 6% Typically seen after EVAR in rAAA patients |
Prevalence 11% Typically seen after open repair in rAAA patients |
|
|
|
|
True positives |
50 (28 to 72) |
30 (17 to 43) |
55 (31 to 79) |
198 (4) |
⨁◯◯◯ |
Grade III colonic ischemia will be correctly diagnosed in 50 out of 1000 patients with rAAA undergoing routine colonoscopy (30 in case of EVAR and 55 in case of open repair). |
|
False negatives |
50 (28 to 72) |
30 (17 to 43) |
55 (31 to 79) |
Grade III colonic ischemia will be missed in 50 out of 1000 patients with rAAA undergoing routine colonoscopy (30 in case of EVAR and 55 in case of open repair). |
||
|
True negatives |
873 (828 to 891) |
912 (865 to 931) |
863 (819 to 881) |
198 (4) |
⨁◯◯◯ |
Out of 1000 patients with rAAA routinely undergoing colonoscopy, 873 patients will be correctly diagnosed as not having Grade III colonic ischemia (912 in case of EVAR and 863 in case of open repair). |
|
False positives |
27 (9 to 72) |
28 (9 to 75) |
27 (9 to 71) |
Out of 1000 patients with rAAA routinely undergoing colonoscopy, 27 patients will be wrongly diagnosed with Grade III colonic ischemia (28 in case of EVAR and 27 in case of open repair). |
||
CI: Confidence interval; EVAR: endovascular aneurysm repair; rAAA: ruptured aneurysm of the abdominal aorta.
a. The studies in patients with rAAA included in the meta-analysis were not designed to assess the diagnostic accuracy of routine colonoscopy.
b. The intervention was not the same in all studies (sigmoidoscopy versus colonoscopy).
c. Small patient groups in individual studies included in the meta-analysis and wide confidence intervals. Limited number of studies.
d. The risk of publication bias was estimated as high (according to the funnel plot) by the authors of the meta-analysis.
Positive and negative predictive values
The positive predictive value of routine colonoscopy for the detection of Grade III colonic ischemia in patients with rAAA reported in the systematic review by von Meijenfeldt (2018) was 73% (95% CI: 49 to 89), while the negative predictive value was 92% (95% CI: 88 to 94). This means that 73% of patients with a positive colonoscopy will indeed have Grade III colonic ischemia, and 92% of patients with a negative colonoscopy will not have Grade III colonic ischemia.
Level of evidence of the literature
The reporting of crucial outcome measures was limited. The assessment of level of evidence for the outcomes mortality, morbidity, cost-effectiveness and patient satisfaction was not possible due to the absence of relevant literature.
The level of evidence for the outcome diagnostic accuracy was downgraded by three levels due to limitations in the study design (risk of bias), differences in the intervention (indirectness), small patient numbers and a limited number of studies (imprecision), and the risk of publication bias, resulting in a very low level of evidence. We have very little confidence in the effect estimate: the true effect is likely to be substantially different from the estimate of effect.
Conclusions
|
- GRADE |
We found no (randomized) studies in which the effect of routine postoperative colonoscopy on mortality, morbidity, cost effectiveness and patient satisfaction was studied in patients with a rAAA. |
|
Very low GRADE |
The diagnostic accuracy of routine colonoscopy for detecting Grade III bowel ischaemia in patients treated for a rAAA is unclear with a positive and negative predictive value of, respectively, 73% and 92%.
Bronnen: (von Meijenfeldt, 2018) |
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the value of routine colonoscopy for the detection of colonic ischemia in patients with a ruptured aneurysm of the abdominal aorta (rAAA)?
PICO
P: (patients) patients with a rAAA;
I: (intervention) routine colonoscopy;
C: (control) colonoscopy performed based on clinical suspicion of colonic ischemia;
O: (outcome measure) mortality, morbidity, cost-effectiveness, patient satisfaction, diagnostic accuracy of colonoscopy (sensitivity, specificity, positive and negative predictive values, true positives, true negatives, false positives and false negatives).
Relevant outcome measures
The guideline development group considered mortality as a crucial outcome measure for decision making; and morbidity, cost-effectiveness, patient satisfaction, diagnostic accuracy of colonoscopy (sensitivity, specificity, positive and negative predictive values (PPV, NPV), true positives, true negatives, false positives and false negatives) as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. The working group did not define a minimal clinically (patient) important difference for the outcome mortality, but used the number needed to treat/number needed to harm to weigh the impact for patients.
Search and select (Methods)
In an orienting search, the systematic review by Von Meijenfeldt (2018) was found. The authors of this review searched PubMed and Embase databases until March 1, 2017 for prospective studies describing the use of routine colonoscopy in patients operated for an aneurysm of the abdominal aorta (AAA). In order to retrieve relevant studies published after the search date of Von Meijenfeldt (2018), we searched the databases Medline (via OVID) and Embase (via Embase.com) with relevant search terms from the 1st of January 2017 up to the 8th of May 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 20 hits. Studies were selected based on the following criteria: the study design was a systematic review, randomised controlled trial or comparative observational study, the patient population consisted of patients with rAAA and the study compared routine colonoscopy with colonoscopy performed in case of clinical suspicion of colonic ischemia. Twenty studies were initially selected based on title and abstract screening. After reading the full text, 18 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 2 studies were included.
Results
A systematic review and meta-analysis of diagnostic accuracy of routine colonoscopy by von Meijenfeldt (2018) forms the basis of this module. Data were extracted to calculate the sensitivity, specificity, PPV and NPV. The confirmation of colonic ischemia by a positive laparotomy or a post-mortem examination was used as the reference standard for comparison with colonoscopy. The systematic review included 12 studies with in total 845 participants, of whom routine postoperative colonoscopy for the diagnosis of colonic ischemia was performed in 718 patients. In 158 of 718 patients it was not reported whether they had a ruptured or a non-ruptured AAA. Of the remaining 560 patients, 312 (56%) had undergone a rAAA repair. Routine colonoscopy (or sigmoidoscopy) was performed in 282 (90.4%) study participants with rAAA.
The second study in the literature analysis only partly answered the PICO, because in this study colonoscopy was not performed routinely (Jalalzadeh, 2019). It included 407 participants undergoing rAAA repair, of whom 46 patients had sigmoidoscopy based on clinical suspicion of colonic ischemia.
Important study characteristics and results of the included studies are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Jalalzadeh, H., van Schaik, T. G., Duin, J. J., Indrakusuma, R., van Beek, S. C., Vahl, A. C., Wisselink, W., Balm, R., & Koelemay, M. (2019). The Value of Sigmoidoscopy to Detect Colonic Ischaemia After Ruptured Abdominal Aortic Aneurysm Repair. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 57(2), 229–237. https://doi.org/10.1016/j.ejvs.2018.08.041
- von Meijenfeldt, G., Vainas, T., Mistriotis, G. A., Gans, S. L., Zeebregts, C. J., & van der Laan, M. J. (2018). Accuracy of Routine Endoscopy Diagnosing Colonic Ischaemia After Abdominal Aortic Aneurysm Repair: A Meta-analysis. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 56(1), 22–30. https://doi.org/10.1016/j.ejvs.2018.02.008
- Wanhainen, A., Verzini, F., Van Herzeele, I., Allaire, E., Bown, M., Cohnert, T., Dick, F., van Herwaarden, J., Karkos, C., Koelemay, M., Kölbel, T., Loftus, I., Mani, K., Melissano, G., Powell, J., Szeberin, Z., Esvs Guidelines Committee, de Borst, G. J., Chakfe, N., Debus, S., … Verhagen, H. (2019). Editor's Choice - European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 57(1), 8–93. https://doi.org/10.1016/j.ejvs.2018.09.020 (ESVS-richtlijn 2019).
Evidence tabellen
Evidence table for systematic reviews of RCTs and observational studies
Research question: What is the value of routine colonoscopy for the detection of colonic ischemia in patients with a ruptured aneurysm of the abdominal aorta (rAAA)?
*study used data form RCT: Senekowitsch C, Assadian A, Assadian O, et al. Replanting the inferior mesentery artery during infrarenal aortic aneurysmrepair—influence on postoperative colon ischemia. J Vasc Surg 2006;43:689–94.
**extracted from the original article (Champagne, 2004)
Evidence table for intervention studies
Research question: What is the value of routine colonoscopy for the detection of colonic ischemia in patients with a ruptured aneurysm of the abdominal aorta (rAAA)?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Jalalzadeh 2019 |
Type of study: Retrospective analysis of a multicentre cohort data
Setting and country: Amsterdam Acute Aneurysm (AJAX) cohort, The Netherlands
Funding and conflicts of interest: None |
Inclusion criteria: all AJAX cohort** patients who underwent ruptured AAA repair and survived more than 6 h after transfer to ICU.
Exclusion criteria: patients with colonic ischemia at the moment of operation for ruptured AAA; patients with ischemia of the small intestines.
N total at baseline: N=407 patients with rAAA undergoing repair
N included in the analysis: N=345
Intervention: N=62 (sigmoidoscopy n=46 (13.3%); immediate laparotomy n=16 (4.5%))
Important prognostic factors: age±SD: 74±8.4 yrs Sex: 81.8 % Male |
Describe intervention (treatment/procedure/test):
Sigmoidoscopy: it wasn’t routine, performed based on the clinical judgment of the treating surgeons or intensive care staff.
Immediate laparotomy: in case of high clinical suspicion of colonic ischemia. |
Describe control (treatment/procedure/test):
Not applicable |
Length of follow-up: Not applicable
Loss-to-follow-up: Not applicable
Incomplete outcome data: n=56, reasons: death; exclusion criteria; n=6, reasons: missing data;
|
Outcome measures: *colonic ischemia *prevalence of bowel perforation, bowel resection, stoma placement, abdominal compartment syndrome; *combined 30-day or in-hospital death rate *diagnostic value of sigmoidoscopy for detection of transmural colonic ischemia: PPV=73% (95% CI 43 - 90%) (“moderate to severe colonic ischemia”); PPV=11% (95% CI 2.9-31%) (“mild colonic ischemia”). NPV=100% (95% CI 78-100%).
Effect size (include 95%CI and p-value if available): factors associated with transmural colonic ischemia -cardiac comorbidity OR 3.1 (95% CI 1.19-7.97); -first Hb OR 0.6 (95% CI 0.47-0.87); -high vasopressor administration OR 9.4 (95% CI 1.99-44.46). |
-author’s conclusions: “diagnostic value of sigmoidoscopy to detect colonic ischemia after RAAA repair is high in patients with a clinically moderate suspicion of colonic ischemia” “when doubts exist about the presence of colonic ischemia, the probability of identifying a patient with transmural ischemia increases from 22%-73% when moderate to severe colonic ischemia is detected at sigmoidoscopy” “some 13% of patients underwent sigmoidoscopy for suspicion of colonic ischemia after RAAA repair. Sigmoidoscopy increases the likelihood of correctly identifying the presence or absence of transmural CI, especially in patients with a moderate clinical suspicion for CI after ruptured AAA repair”
|
*ICU, intensive care unit. **Reimerink JJ, Hoornweg LL, Vahl AC, Wisselink W, van den Broek TA, Legemate DA, et al. Endovascular repair versus open repair of ruptured abdominal aortic aneurysms: a multicenter randomized controlled trial. Ann Surg 2013;258:248e56.
Notes: It was not mentioned which confounders were used for adjustment in the analysis of risk factors of colonic ischemia. Laparotomy was performed in 29 patients with suspicion of ischemia, 13 of them have had a sigmoidoscopy by the time of laparotomy.
Table of quality assessment for systematic reviews of RCTs and observational studies
Research question: What is the value of routine colonoscopy for the detection of colonic ischemia in patients with a ruptured aneurysm of the abdominal aorta (rAAA)?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
von Meijenfeldt, 2018 |
yes |
yes |
yes |
yes |
Not applicable |
Yes, uisng QUADAS-2 |
No, different types of intervention (sigmoidoscopy and colonoscopy) were combined |
Yes, using a funnel plot |
Noa |
Risk of bias assessment diagnostic accuracy studies (QUADAS II, 2011)
Research question: What is the value of routine colonoscopy for the detection of colonic ischemia in patients with a ruptured aneurysm of the abdominal aorta (rAAA)?
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Champagne et al., 2004 (retrospective chart review) |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yesa
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Champagne et al., 2007 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yesa
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Megalopoulos et al., 2008 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Nob
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias? RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Tøttrup et al., 2013 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yesa
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
a laparotomy
b compared patients with colonic ischemia versus. patients without colonic ischemia to determine perioperative risk factors predictive of ischemia
Table of excluded studies
Research question: What is the value of routine colonoscopy for the detection of colonic ischemia in patients with a ruptured aneurysm of the abdominal aorta (rAAA)?
|
First author, year |
Reason for exclusion |
|
Boyle, 2019 |
Invited commentary |
|
Berchiolli, 2019 |
Doesn’t fit the PICO: not reporting on routine colonoscopy |
|
Iida, 2018 |
Case report |
|
Hofmann, 2018 |
Trial reporting 1-year follow-up study results of a new stent graft |
|
Hagihara, 2018 |
Case report |
|
Desikan, 2018 |
Doesn’t fit the PICO: not reporting on routine colonoscopy |
|
Björck, 2018 |
Invited commentary |
|
Björck, 2018 |
Invited commentary |
|
Berchiolli, 2018 |
Case report |
|
Abidali, 2018 |
Case report |
|
Spanos, 2017 |
Doesn’t fit the PICO: does not report on routine colonoscopy |
|
Oikonomou, 2017 |
Doesn’t fit the PICO: does not report on routine colonoscopy |
|
Koutsias, 2017 |
Doesn’t fit the PICO: does not report on routine colonoscopy |
|
Hynes, 2017 |
Doesn’t fit the PICO: does not report on routine colonoscopy |
|
Gallitto, 2017 |
Doesn’t fit the PICO: does not report on routine colonoscopy |
|
Changal, 2017 |
Doesn’t fit the PICO: does not report on routine colonoscopy |
|
Badger, 2017 |
Doesn’t fit the PICO: does not report on routine colonoscopy |
|
Jalalzadeh, 2018 |
Doesn’t fir the PICO: systematic review of prevalence of bowel ischemia |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-04-2021
Laatst geautoriseerd : 01-04-2021
Geplande herbeoordeling : 01-01-2027
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2026 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde (NVvH) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven (zie tabel). Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling zou moeten plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten, zoals bijvoorbeeld een herziening van de richtlijn van de European Society of Vascular Surgery (ESVS).
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Onderhoudsplan richtlijn AAA
|
Module |
Geautoriseerd in |
Geplande herbeoordeling |
|
Algemene inleiding en organisatie van zorg |
2021 |
2026 |
|
Diagnostiek en screening van het infrarenaal AAA |
2021 |
2026 |
|
Het kleine AAA |
2021 |
2026 |
|
Electieve behandeling van het infrarenaal AAA |
2021 |
2026 |
|
Behandeling van het geruptureerde AAA |
2021 |
2026 |
|
Lange termijn uitkomsten en follow up na herstel |
2021 |
2026 |
|
Behandeling van het juxtarenaal AAA |
2021 |
2026 |
|
Behandeling van het iliacaal AAA |
2021 |
2026 |
|
Overige AAA gerelateerde problemen |
2021 |
2026 |
Algemene gegevens
Het Kennisinstituut van de Federatie Medisch Specialisten ondersteunde de richtlijnontwikkeling en de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) financierde de ontwikkeling. Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financiers hebben geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn richt zich op wat volgens de huidige maatstaven de beste zorg is voor het vaststellen en behandelen van het AAA in Nederland. Het doel van de richtlijn is om de zorg voor patiënten met (verdenking op) een AAA te standaardiseren en af stemmen op hun wensen. Deze richtlijn betreft een adaptatie van de richtlijn van de European Society of Vascular Surgeons (2019).
Doelgroep
Deze richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de zorg voor patiënten met een AAA in de tweede lijn in Nederland.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een AAA.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. M.M.P.J. (Michel) Reijnen, vaatchirurg, Rijnstate, Arnhem, NVvH (voorzitter)
- Dr. A.P.M. (Bart) Boll, vaatchirurg, Canisius-Wilhelmina Ziekenhuis Nijmegen, Nijmegen, NVvH
- Dr. B.M.E. (Barend) Mees, vaatchirurg, Maastricht UMC+, Maastricht, NVvH
- Dr. A.A.M. (Adrienne) Zandbergen, internist-vasculair geneeskundige, Erasmus MC, Rotterdam, NIV
- H.H. (Erik) Scholten, (cardio)-anesthesioloog, Amsterdam UMC Locatie AMC, Amsterdam, NVA
- Dr. J.A. (Jan Albert) Vos, interventieradioloog, St. Antonius Ziekenhuis, Nieuwegein, NVVR
- Dr. C.S.P. (Carla) van Rijswijk, interventieradioloog, LUMC, Leiden, NVVR
- Drs. J. (Jeroen) Nieuwenhuizen, intensivist-transplantatiechirurg, LUMC, Leiden, NVIC
- C.P.A. (Koen) van Hees, M ANP, verpleegkundig specialist, Elisabeth-TweeSteden Ziekenhuis, Tilburg, V&VN VS
- Drs. A.M.H.J. (Annemarie) Auwerda, beleidsadviseur Harteraad, Den Haag (patiëntvertegenwoordiger)
Klankbordgroep
- Dr. M.J.W. (Mark) Koelemay, Amsterdam UMC Locatie AMC, Amsterdam
- Dr. J.A. (Joost) van Herwaarden, UMC Utrecht, Utrecht
Beiden lid van de richtlijn commissie: “Abdominal Aorto-iliac Artery Aneurysms” (2019) van de ESVS
Ondersteuning van
- Dr. J. (Julitta) Boschman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. D. (Dagmar) Nieboer, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Overzicht van functies, nevenfuncties, eventuele belangen en ondernomen acties
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen Aandelen |
Gemelde belangen Consultancy (contracten, namen) |
Gemelde belangen Wetenschap/ wetenschapsfunding |
Gemelde belangen Speakers fees |
Ondernomen actie |
|
Auwerda |
Beleidsadviseur Harteraad, Den Haag |
Geen |
Geen. 1-5-2018 |
Geen. 1-5-2018 |
Geen. 1-5-2018 |
Geen. 1-5-2018 |
Geen |
|
Boll |
- (vaat)chirurg CWZ: 0,5 fte - Voorzitter bestuur Jonkerbosch Medisch Specialistisch Bedrijf Nijmegen: 0,4 fte - Vicevoorzitter bestuur Vereniging Medische Staf CWZ: 0,1 fte |
Medisch Adviseur, onbezoldigd, Aorta stichting |
Geen. 4-6-2018
|
Geen. 4-6-2018
|
Intellectueel en reputatiebelang t.a.v. screening (onderwerp van promotieonderzoek). 4-6-2018
|
Geen. 4-6-2018
|
Geen, het gemelde belang is verjaard. |
|
Hees, van |
Verpleegkundig specialist intensieve zorg bij somatische aandoeningen, aandachtsgebied vaatchirurgie. Elisabeth Tweesteden Ziekenhuis (ETZ) Tilburg |
- Lid dagelijks bestuur vakgroep verpleegkundig specialisten ETZ, onbetaald - Voorzitter landelijk netwerk verpleegkundig specialisten vaatchirurgie Nederland (VSVN), onbetaald |
Geen. 13-6-2018 |
Geen. 13-6-2018 |
Geen. 13-6-2018 |
Geen. 13-6-2018 |
Geen |
|
Mees |
Vaatchirurg Mumc, Maastricht |
- Secretaris Nederlandse Vereniging van Vaatchirurgie (onbetaald) - Course Director I-meet (onbetaald) - Co-director EVC (onbetaald) - Adviesgroep Marfan Patientenvereniging (onbetaald)" |
Geen. 4-6-2018
|
Geen. 4-6-2018
|
XS-graft (InsCite) onderzoek naar nieuwe graft voor vaattoegang. Financier: DSM, MUMC, TUE, Provincie Limburg. 15-5-2018 |
Geen. 4-6-2018
|
Geen. Onderzoek niet gerelateerd aan richtlijnonderwerpen.
|
|
Nieuwenhuizen |
- Intensivist, Intensive Care volwassenen: LUMC, 50% - Transplantatiechirurg, afdeling Heelkunde: LUMC, 50% |
- Richtlijn commissie Acuut leverfalen, onbetaald - Werkgroep portale hypertensie, onbetaald |
Geen. 1-6-2018 |
Geen. 1-6-2018 |
Geen. 1-6-2018 |
Geen. 1-6-2018 |
Geen. |
|
Reijnen |
Vaatchirurg, Rijnstate, Arnhem |
Parttime hoogleraar (0,2 FTE) Aan de Universiteit van Twente, Multi-Modality Medical Imaging group (onbezoldigd) |
Geen. 18-9-2018 |
Consultancy activiteiten bij diverse bedrijven; W.L. Gore and Associates, Medtronic, Endologix, Terumo Aortic, Bentley. 9-8-2019 |
Research funding van diverse bedrijven. Participatie aan meerdere industry-initiated studies. W.L. Gore and Associates, Medtronic, Endologix, Terumo Aortic, Bentley, Triplemed. 9-8-2019 |
W.L. Gore and Associates, Medtronic, Endologix, Terumo Aortic, Bentley. 9-8-2019 |
Exclusie participatie bij het opstellen van aanbevelingen die niet geadapteerd worden uit de ESVS-richtlijn 2019. In de richtlijn worden géén uitspraken gedaan over specifieke prothesen. |
|
Rijswijk, van |
Interventieradioloog, LUMC Leiden (sectiehoofd Interventie Radiologie) |
Geen. (Overig: partner onderdeel van writing committee van ESVS-richtlijn 2019)
|
Geen. 23-5-2018 |
Geen. 23-5-2018 |
Geen. 23-5-2018 |
Geen. 23-5-2018 |
Geen, deze onbetaalde activiteit van de partner werd niet als belang beschouwd. |
|
Scholten |
(Cardio)-anesthesioloog, AMC, Amsterdam |
|
Geen. 2-8-2018 |
Geen. 2-8-2018 |
Geen. 2-8-2018 |
Geen. 2-8-2018 |
Geen.
|
|
Vos |
Interventieradioloog in vrije vestiging St. Antonius Ziekenhuis Utrecht/Nieuwegein/Woerden |
- Consulent Peripheral Arterial Disease Medtronic - Consulent Pulmonary Embolism BTG - Consulent Intra Arterial Stroke Treatment Stryker Allen betaald |
Geen. 25-5-2018 |
Consultancy onderwerpen niet gerelateerd aan richtlijnonderwerpen. |
Geen. 25-5-2018 |
Geen. 25-5-2018 |
Geen. |
|
Zandbergen |
- Internist - vasculair geneeskundige - Hoofdopleider Interne Geneeskunde Erasmus MC Rotterdam" |
|
Geen. 28-4-2018 |
Geen. 28-4-2018 |
Geen. 28-4-2018 Onderzoek niet gerelateerd aan richtlijnonderwerpen.
|
Geen. 28-4-2018 |
Geen. |
Inbreng patiëntenperspectief
Een patiëntvertegenwoordiger participeerde (namens Harteraad) in de werkgroep om aandacht voor het patiëntenperspectief te borgen. In de ESVS-richtlijn bleek de aandacht voor het patiëntenperspectief summier en bovendien niet zondermeer te vertalen naar de situatie voor de Nederlandse patiënt. Daarom zette Harteraad een digitale enquête uit tussen 18 april 2019 en 2 mei 2019 over de zorg voor mensen met een AAA. Het doel van de enquête was om inzicht te krijgen in de behoeften die patiënten hebben ten aanzien van de zorg en inzicht krijgen in de knelpunten die er bestaan in de zorgverlening aan mensen met een AAA. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Harteraad.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, verwijzen wij u naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase maakte de werkgroep gebruik van de knelpunteninventarisatie op basis van een invitational conference ‘Aneurysma Aorta Abdominalis’ in januari 2016. De werkgroep plande een invitational conference in 2018 om aanvullende knelpunten op te halen, maar hier bleek geen interesse voor vanuit de relevante partijen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
De werkgroep ontwikkelde geen interne kwaliteitsindicatoren om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Kennislacunes
Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De werkgroep legde de conceptrichtlijn voor aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties ter commentaar. De werkgroep besprak de commentaren en paste de conceptrichtlijn aan of onderbouwde waarom aanpassingen niet nodig, relevant of wenselijk waren. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Werkwijze voorbereiding adaptatie ESVS-richtlijn
Tijdens de voorbereidende fase bleek de richtlijn van de European Society for Vascular Surgery (ESVS) (“Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms”) in herziening (Wanhainen, 2019). De werkgroep heeft publicatie van deze richtlijn (in januari 2019) afgewacht en besloten om deze richtlijn te adapteren conform het Adviesrapport Adapteren van internationale richtlijnen naar de Nederlandse praktijk (2016). Dit mede gezien het feit dat elk lid van de Nederlandse Vereniging voor Vaatchirurgie tevens lid is van de ESVS. De werkgroep heeft het stappenplan van het adaptatieproces gebruikt om de ESVS-richtlijn aan te passen voor de Nederlandse situatie. De werkgroep heeft dr. Mark Koelemay en dr. Joost van Herwaarden, medeauteur van de ESVS-richtlijn, gevraagd inzicht te verschaffen in het richtlijnontwikkelingsproces van de ESVS. Mede op basis daarvan is de werkgroep gekomen tot een adaptatieplan.
Onafhankelijkheid
De werkgroep had er vertrouwen in dat de ESVS-richtlijn op een zo onafhankelijk mogelijke wijze is opgesteld. De werkgroep vond geen aanwijzingen dat de internationale richtlijn werd beïnvloed door conflicterende belangen van de leden van de werkgroep of door de opvattingen of belangen van een financierende instantie.
Methodologie
De ESVS-richtlijnmethodiek was op enkele punten anders dan de richtlijnmethodiek Medisch Specialistische Richtlijnen 2.0. Een samenvatting van de werkwijze van de ESVS-werkgroep vindt u onder de paragraaf “Werkwijze richtlijnwerkgroep ESVS-richtlijn 2019”.
De werkgroep constateerde dat:
- literatuurzoekacties recent zijn en in samenwerking met medisch informatiespecialisten zijn uitgevoerd, maar dat deze niet gedocumenteerd zijn;
- het literatuurselectieproces is beschreven, maar niet per uitgangsvraag/PICO;
- de gradering van de bewijskracht is uitgevoerd volgens de systematiek van de European Society of Cardiology (ESC).
Ondanks deze beperkingen had de werkgroep voldoende vertrouwen in de kwaliteit van de ESVS-richtlijn. Voor sommige onderwerpen is namelijk nauwelijks of geen hoogwaardig bewijs beschikbaar. De werkgroep meende dat voor dergelijke onderwerpen er op dit moment geen reden was voor een nieuwe systematische literatuurzoekactie en -analyse.
De werkgroep besloot na het bestuderen van alle ESVS-hoofdstukken om zelf zeven (aanvullende) vragen volledig uit te werken, en zo de bevindingen van de ESVS-werkgroep te controleren en onvoldoende beantwoorde knelpunten uit te diepen.
- Kan medicamenteuze behandeling groei van het AAA vertragen?
- Wat is de optimale electieve behandeling van patiënten met een AAA?
- Wat is de optimale behandeling van patiënten met een geruptureerd AAA?
- Is routinematige coloscopie na een geruptureerd AAA geïndiceerd?
- Wanneer is er een behandelindicatie voor het type II endoleak?
- Wanneer is er een behandelindicatie bij het groeiend AAA?
- Wat is het ideale follow-up schema na EVAR?
Werkwijze adaptatie conclusies, aanbevelingen en overwegingen
Conclusies
Voor alle ESVS-hoofdstukken maakte de werkgroep van de relevante interventies de balans op van de gunstige en ongunstige effecten voor de patiënt en verifieerden of hun conclusie overeenkwam met de ESVS-richtlijn. Eventuele discrepanties werden benoemd en mogelijke redenen inzichtelijk gemaakt in de overwegingen.
Van bewijs naar aanbeveling
De werkgroep controleerde en bediscussieerde alle ESVS-aanbevelingen. Om te komen tot een Nederlandse richtlijnaanbeveling woog de werkgroep (de kwaliteit van) het wetenschappelijke bewijs en andere aspecten, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken.
Werkwijze aanvullende vragen danwel vragen ter controle
Uitkomsten
De werkgroep inventariseerde per vraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de zeven aanvullende vragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5. De adviseur schreef de literatuursamenvatting in het Engels om (in de toekomst) de bevindingen internationaal te kunnen delen.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Werkwijze richtlijnwerkgroep ESVS-richtlijn 2019
Proces op hoofdlijnen
De ESVS selecteerde 16 inhoudsdeskundigen voor de richtlijnwerkgroep. Alle leden verstrekten informatie over potentiële belangen. De ESVS bewaart deze belangenverklaringen op haar hoofdkantoor en kunnen worden opgevraagd.
Alle werkgroepleden hebben het definitieve document goedgekeurd. De richtlijn onderging verder een formeel beoordelingsproces door externe deskundigen. In totaal hebben 23 recensenten, waaronder de 11 leden van werkgroep en 12 externe reviewers uit Europa, Amerika, Azië en Australië de richtlijn beoordeeld en de definitieve versie goedgekeurd.
Nieuw in de ESVS-richtlijn
Voor het eerst nam de ESVS-werkgroep het patiëntenperspectief op in de ESVS-richtlijn AAA. Verder heeft de werkgroep voor diverse onderwerpen de aanbevelingen herzien op basis van nieuw wetenschappelijk bewijs, zoals de aanbevelingen over EVAR als voorkeursbehandeling voor het geruptureerde AAA (rAAA), een gestratificeerd en minder frequent vervolgregime na EVAR, en een bijgewerkt protocol voor kleine AAA's.
Methodologie
De richtlijnwerkroep kwam enkele malen bijeen. Tijdens deze vergaderingen werden de taken vastgesteld en verdeeld. Concept-aanbevelingen werden bediscussieerd. Als er geen unanieme overeenstemming was, werd door middel van discussie getracht om tot consensus te komen. Als dit niet lukte, werd de formulering van de aanbeveling, de graad en/of het bewijsniveau bepaald op basis van stemming onder de werkgroepleden.
Zoeken en selecteren van literatuur
Leden van de commissie, ondersteund door literatuurspecialisten, voerden het literatuuronderzoek uit. Men zocht systematisch in Medline (via PubMed), Embase, Clinical Trial-databases en de Cochrane Library tot 31 december 2016. Men controleerde referenties en doorzocht, indien dat nodig werd geacht, handmatig relevante tijdschriften.
De werkgroepleden voerden een update van de literatuurzoekactie uit in mei 2018 om artikelen gepubliceerd tussen mei 2016 en januari 2018 te vinden.
De werkgroepleden voerden de literatuurselectie uit op basis van informatie in de titel en het abstract. Criteria voor zoeken en selectie waren (1) Taal: Engels. (2) Niveau van bewijs: de selectie van de literatuur werd uitgevoerd volgens de bewijspiramide, met geaggregeerde bewijs aan de top van de piramide (systematische beoordelingen, meta-analyses), vervolgens gerandomiseerde gecontroleerde studies (RCT’s, vervolgens observationele studies. Men excludeerde casestudies, dierstudies en in vitro studies.
Studies werden daarnaast beoordeeld op grootte: aan grotere studies kende men meer gewicht toe dan aan kleinere studies. Relevante artikelen gepubliceerd na de zoekdatum of in een andere taal includeerde de werkgroep alleen indien zij deze studies van groot belang achtte voor de richtlijn.
Bepalen van de bewijskracht
De richtlijnwerkgroep formuleerde conclusies op basis van het wetenschappelijk bewijs. De daaruit volgende aanbevelingen baseerde men op het beoordelingssysteem van de Europese Society of Cardiology (ESC). Elke aanbeveling classificeerde men door middel van de letter A, B of C. De werkgroep woog het bewijs en de mening van deskundigen en kende vervolgens aan elke aanbeveling een klasse toe: Klasse I, IIa, IIb of III (zie ESVS-richtlijn voor verdere details).
Het perspectief van de patiënt
De werkgroep maakte informatie voor patiënten bij elke (sub)module. Een gespecialiseerd vaatverpleegkundige en ten minste één leek of patiënt checkte deze informatie. Daarna legde de werkgroep de patiëntinformatie voor aan de “Leicester patient focus group”. Aan deze focusgroep bijeenkomst namen acht mannen met klein AAA deel. Tijdens de bijeenkomst discussieerde de deelnemers over de tekst en hieruit kwam onder andere naar voren dat men het belangrijk vindt dat feiten en aanbevelingen duidelijk, consistent en eenvoudig worden gepresenteerd. Een terugkerend voorbeeld dat door de deelnemers in de groep naar voren werd gebracht, was de vereiste voor contextualisering bij het presenteren van risico’s.
N.B. Bij Nederlandse richtlijnen levert de werkgroep zelf geen informatie voor patiënten op. De werkgroep ontwikkelt of herziet de informatie op Thuisarts in samenwerking met een redacteur.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., Fervers, B., Graham, I. D., Grimshaw, J., Hanna, S. E., Littlejohns, P., Makarski, J., Zitzelsberger, L., & AGREE Next Steps Consortium (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne, 182(18), E839–E842. https://doi.org/10.1503/cmaj.090449
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Adapteren van internationale richtlijnen naar de Nederlandse praktijk (2016). Nederlandse Vereniging voor Urologie en de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., Williams, J. W., Jr, Kunz, R., Craig, J., Montori, V. M., Bossuyt, P., Guyatt, G. H., & GRADE Working Group (2008). Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ (Clinical research ed.), 336(7653), 1106–1110. https://doi.org/10.1136/bmj.39500.677199.AE
Wanhainen, A., Verzini, F., Van Herzeele, I., Allaire, E., Bown, M., Cohnert, T., Dick, F., van Herwaarden, J., Karkos, C., Koelemay, M., Kölbel, T., Loftus, I., Mani, K., Melissano, G., Powell, J., Szeberin, Z., Esvs Guidelines Committee, de Borst, G. J., Chakfe, N., Debus, S., … Verhagen, H. (2019). Editor's Choice - European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 57(1), 8–93. https://doi.org/10.1016/j.ejvs.2018.09.020 (ESVS-richtlijn 2019).
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
