Behandeling van motorische klachten bij de novo patiënt met de ziekte van Parkinson
Uitgangsvraag
Hoe kunnen motorische klachten bij de novo patiënten met de ziekte van Parkinson medicamenteus het beste worden behandeld?
Aanbeveling
Start bij een de novo patiënt met ziekteverschijnselen die de kwaliteit van leven beïnvloeden vroeg in de ziekte met een levodopa-preparaat.
Bij patiënten jonger dan 40 dient een verhoogd risico op dyskinesieën te worden afgewogen tegen een geringer effect en meer kans op bijwerkingen bij dopa-sparende therapie.
Overweeg bij patiënten met geringe ziekteverschijnselen die de kwaliteit van leven niet beïnvloeden om te starten met levodopa, een MAO-B remmer of een dopamine-agonist. Vanwege de grotere effectiviteit heeft levodopa de voorkeur. Bij patiënten jonger dan 40 dient een verhoogd risico op dyskinesieën te worden afgewogen tegen een geringer effect en meer kans op bijwerkingen bij dopa-sparende therapie.
Levodopa dient met een opbouwschema te worden gestart waarbij wordt gestreefd naar een zo laag mogelijke dosering waarmee een goed effect wordt bereikt. Hierdoor wordt het risico op het krijgen van levodopa-geïnduceerde motorische responsfluctuaties verminderd. Gestart kan worden met 62,5 mg 3dd, bij onvoldoende effect na twee weken kan worden opgebouwd tot 125 mg 3dd.
Bij onvoldoende effect van 125 mg 3dd1 kan in stappen van bijvoorbeeld 62,5 mg 3dd1 extra worden opgehoogd tot 125 mg 3dd2, en eventueel tot maximaal 125 mg 3dd3. Bij uitblijvend effect van een dosering van 600-900mg bij patiënten met tenminste matig-ernstige bradykinesie of rigiditeit dient de diagnose ziekte van Parkinson te worden heroverwogen.
Indien er wel sprake is van een goede levodopa-respons kan op geleide van klachten en bijwerkingen de dosering in meerdere jaren worden opgehoogd tot soms meer dan 2000 mg levodopa, waarbij een dosering van meer dan 300 mg levodopa per gift ongebruikelijk is.
Vanwege een mogelijk interactie met eiwit-inname dient levodopa een half uur voor of een uur na de maaltijden te worden ingenomen, bijvoorbeeld met water, sap of appelmoes, maar niet met eiwithoudende producten zoals melk.
Voorafgaand aan starten van levodpa of een dopamine-agonist dienen patiënten te worden geïnformeerd over het risico op impulscontrolestoornissen. Tijdens poliklinische controle dient regelmatige controle op het optreden van impulscontrolestoornissen plaats te vinden.
Overwegingen
Levodopa/carbidopa en levodopa/benserazide zijn sinds hun introductie in het begin van de jaren 70 de basis van de behandeling van de ziekte van Parkinson. Er is een robuust symptomatisch effect, met name op de motorische beperkingen, met over het algemeen weinig bijwerkingen. De morbiditeit en zelfs mortaliteit van de ziekte van Parkinson zijn sinds de introductie van levodopa sterk afgenomen. Het ontstaan van motorische responsfluctuaties na meerdere jaren behandeling heeft geleid tot de ontwikkeling van MAO-B-remmers en dopamine-agonisten als alternatieve behandelopties. Dopamine-agonisten en MAO-B remmers zouden een kleinere kans op dyskinesieën geven.
In bovenstaande literatuursamenvatting is onderzocht wat de ongunstige effecten zijn van de verschillende typen medicamenteuze behandeling, en wat het effect is van vroeg of laat starten met anti-parkinsonmedicatie. De bewijskracht van alle beschreven studies is als redelijk tot laag gescoord. In deze sectie zullen de belangrijkste bevindingen worden aangehaald en klinische overwegingen worden beschreven om te komen tot een praktische aanbeveling met betrekking tot medicamenteuze behandeling bij patiënten in de vroege fase van de ziekte.
Uit de vergelijkend onderzoeken en meta-analyses die boven worden beschreven blijkt een verbetering op de UPDRS III van 2,89 punten meer bij levodopa dan bij MAO-B remmers en dopamineagonisten. Een verschil van meer dan 2,5 tot 5 punten wordt als klinische relevant gezien. In de PD-MED studie verbeterde de PDQ-39 1,8 punt meer op levodopa ten opzichte van levodopa-sparende behandeling, een verschil van meer dan 1,6 punt lijkt klinisch relevant. Dit iets grotere effect van levodopa op motorische verschijnselen en kwaliteit van leven ging gepaard met een licht verhoogde kans op het ontwikkelen van dyskinesieën (relatief risico 1,19). Dit licht verhoogde risico betreft “alle dyskinesieën”. Naar “hinderlijke dyskinesieën” is slechts beperkt gekeken, de indruk bestaat dat het verschil ten nadele van levodopa hier minder groot is. Echter, vanwege de angst voor responsfluctuaties bestaat er bij een deel van patiënten en behandelaars terughoudendheid bij het starten van levodopa. Patiënten met een debuut van de ziekte onder de 40 hebben een grotere kans op het ontwikkelen van dyskinesieën dan oudere patiënten (Kostic, 1991).
Uit de ELLDOPA-trial die in 2004 werd verricht kwamen conflicterende resultaten over een mogelijk effect op ziekteprogressie. Klinische uitkomsten suggereerden een ziekte remmend effect, maar functionele beeldvorming met (123I) β-CIT (DATSCAN) suggereerde een neurotoxisch effect. De recente gepubliceerde LEAP-trial laat zien dat er geen sprake is van een ziekte-modificerend effect, zowel niet in gunstige, als in ongunstige zin, maar dat het effect van levodopa puur symptomatisch is. De verbetering in kwaliteit van leven van de vroeg met levodopa behandelde groep was groter dan die van de aanvankelijk met placebo behandelde patiënten. Eerder starten met (langere blootstelling aan) levodopa liet ook geen grotere kans op dyskinesieën zien, maar de follow-up van deze de novo patiënt was relatief kort.
Een onderzoek waarin Ghanese parkinsonpatiënten, die relatief laat na het begin van klachten startten met levodopa (gemiddeld 4,2 jaar) werden vergeleken met een groep Italiaanse patiënten die eerder (gemiddeld na 1,8 jaar) startten met levodopa, liet zien dat respons-fluctuaties en dyskinesieën na een vergelijkbare ziekteduur optraden.
De duur van de ziekte, en niet de duur van de behandeling, lijkt het ontstaan van motorische complicaties te bepalen. Dit wordt geïllustreerd in onderstaande grafiek (Cilia, 2014).
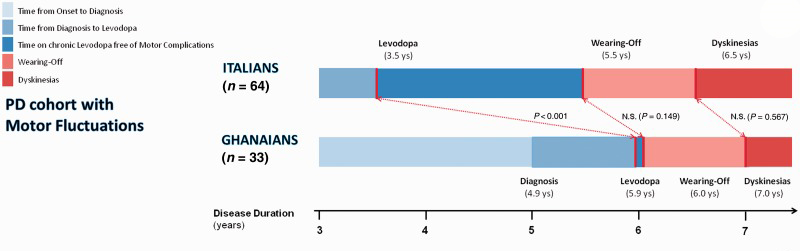
Eerder kon voor rasagiline en voor pramipexol ook al geen ziektemodificerend effect worden aangetoond (Olanow, 2009; Schapira, 2013). Levodopa-preparaten hebben het krachtigste effect, zijn aangetoond veilig en geven slechts een gering verhoogd risico op dyskinesieën. Uitstellen van starten geeft niet minder kans op dyskinesieën maar leidt wel tot afname in kwaliteit van leven. Daarom is het aan te bevelen om bij patiënten met duidelijke functionele beperkingen vroeg te starten met een levodopa-preparaat. Echter, bij patiënten die door hun ziekteverschijnselen weinig of geen beperkingen ervaren lijkt het voordeel van levodopa ten opzichte van dopa-sparende behandeling minder relevant.
Er zijn geen (nieuwe) onderzoeken waarin opbouwschema’s van levodopa worden vergeleken. Wanneer wordt gestart met levodopa, wordt daarom verwezen naar de multidisciplinaire richtlijn uit 2010, die adviseerde om de starten met 62,5 mg 3dd1 en bij onvoldoende resultaat na 2 weken op te hogen naar 125 mg 3dd1. De oude richtlijn stelde dat wanneer een dosering levodopa van rond de 1000 mg/dag gedurende minimaal vier weken geen klinische verbetering geeft, een atypische vorm van parkinsonisme diende te worden overwogen. In de nieuwe diagnostische criteria van de MDS Clinical Diagnostic Criteria for Parkinson’s Disease (Postuma, 2015) wordt een afwezige dopa-repons bij meer dan 600 mg levodopa per dag als exclusiecriterium beschouwd. De richtlijncommissie vindt deze dosering niet hoog, maar wil zich conformeren aan de internationaal vastgestelde criteria. Bij enige twijfel wordt wel geadviseerd verder op te hogen naar bijvoorbeeld 900 mg levodopa per dag.
Het is niet goed mogelijk een voorkeur uit te spreken voor een MAO-B remmer of een dopamine-agonist, indien wordt gekozen om te starten met een levodopa-sparende behandeling. In de PD-MED-studie had na 2 jaar 64% van de patiënten die startten met een MAO-B remmer en 40% van de dopamine-agonisten een tweede middel (= levodopa) nodig, wat een krachtiger dopaminerg effect van een dopamine-agonist suggereert. Patiënten die startten met een MAO-B-remmer scoorden wel marginaal beter op de PDQ-39, maar dit verschil is niet klinisch relevant. Daarnaast kunnen co-morbiditeit en het risico op het ontstaan van impulscontrolestoornissen de keuze beïnvloeden. De keuzekaart Beginnende ziekte van Parkinson kan ondersteuning bieden bij het keuzegesprek.
Medicamenteuze behandeling van tremoren met anticholinergica of bètablokkers (overgenomen uit richtlijn 2010):
Anticholinergica
Anticholinergica worden al meer dan 100 jaar gebruikt bij de behandeling van de ziekte van Parkinson. Sinds de tweede helft van de 20e eeuw zijn de selectieve centraalactieve muscarinereceptorantagonisten in gebruik. Anticholinergica zijn effectief op de tremor via de striatale cholinerge interneuronen, maar hebben eveneens een duidelijk negatief effect op de cholinerge innervatie van de cortex, hetgeen kan leiden tot geheugenklachten en verminderde aandacht.149.
Een Cochrane-review (negen studies; anticholinergica versus placebo) 150 en een additionele RCT (n=82, anticholinergica versus levodopa en bromocriptine)151 dienden als basis voor deze onderbouwing. De RCT toonde geen wezenlijke verschillen tussen de drie middelen.151 De studies in de Cochrane-review hadden allemaal teveel methodologische beperkingen om hieruit een eenduidig bewijs te kunnen distilleren.150.
Conclusie: Er is onvoldoende bewijs voor de effectiviteit en veiligheid van anticholinergica bij de ziekte van Parkinson, in het bijzonder bij patiënten met een dominante tremor (Niveau 2) (Katzenschlager 2003, Cooper 1992).
Overige overwegingen
Anticholinergica kunnen een goed effect hebben op de tremor en hebben daarom nog steeds een plaats bij de behandeling daarvan. Alle anticholinergica geven echter cognitieve bijwerkingen, ook bij jonge en gezonde mensen, hetgeen een belangrijke reden is om deze middelen in ieder geval niet voor te schrijven bij oudere patiënten met de ziekte van Parkinson.149 Al aanwezige cognitieve stoornissen kunnen bij gebruik van anticholinergica ernstig ontsporen en zelfs resulteren in een psychose.152.
Aanbeveling: Anticholinergica kunnen door de behandelend specialist worden voorgeschreven als symptomatische behandeling voor rusttremor bij relatief jonge en op cognitief gebied goed functionerende patiënten met de ziekte van Parkinson. Vanwege de kans op neuropsychiatrische bijwerkingen zijn anticholinergica echter niet het medicament van eerste keuze.
Bètablokkers
De tremor bij de ziekte van Parkinson betreft in principe een asymmetrische rusttremor die het meest uitgesproken is aan de extremiteiten, maar vaak ook aan de kin en de tong kan worden waargenomen.
Bètablokkers worden frequent toegepast bij de behandeling van essentiële tremor die wordt gekenmerkt door vooral een symmetrische posturele tremor en actietremor. Een posturele of actietremor wordt echter ook regelmatig bij patiënten met de ziekte van Parkinson gezien. Zowel de posturele tremor als de rusttremor kan grote functiebeperkingen tot gevolg hebben.
Een Cochrane-review van vier RCT’s (n=72), alle met een cross-over design, liet zien dat de studies afzonderlijk te veel methodologische beperkingen hadden om er een bewijsklasse uit te kunnen bepalen.147 Eén RCT uit 1975 vond geen significant verschil tussen oxprenolol en placebo op de totale tremorscore 148.
Conclusie: Er is onvoldoende bewijs voor de effectiviteit en veiligheid van bètablokkers
bij patiënten met de ziekte van Parkinson met een dominante tremor (niveau 4, mening van de werkgroep).
Overige overwegingen
Bètablokkers hebben alleen een effect op de perifere component van tremoren en kunnen als zodanig voor sommige patiënten met de ziekte van Parkinson van nut zijn, vooral voor diegenen met tevens een posturele tremor of actietremor naast hun rusttremor. Indien een patiënt met de ziekte van Parkinson de toename van de tremor door stressvolle situaties wil verminderen, kan de patiënt gebaat zijn bij het innemen van een bètablokker zoals propranolol 10 tot 40 mg/gift, 1 à 2 uur voordat de te verwachten stressvolle situatie zich voordoet. Uiteraard moeten (niet-selectieve) bètablokkers zoals propranolol, niet worden voorgeschreven bij patiënten met de ziekte van Parkinson die tevens COPD, diabetes mellitus, astma, bronchospasmen, AV-blok, onbehandeld hartfalen, perifere circulatiestoornissen of hypotensie hebben.
Aanbevelingen: Bètablokkers kunnen door de behandelend specialist worden voorgeschreven bij de symptomatische behandeling van patiënten met de ziekte van Parkinson en functiebeperkingen ten gevolge van een posturele tremor of actietremor.
Onderbouwing
Achtergrond
De Multidisciplinaire richtlijn 2010 stelde dat het niet mogelijk is om op basis van wetenschappelijk bewijs een medicament aan te bevelen in de behandeling van patiënten met functiebeperkingen in de ongecompliceerde fase. Hierdoor is er veel praktijkvariatie. Levodopa en dopamine-agonisten kunnen in de vroege fase als equipotent worden beschouwd in de behandeling van motorische symptomen. De keuze van een medicament wordt veelal bepaald door individuele factoren. Verder is het onduidelijk wanneer gestart moet worden en welk middel bij welke patiënt de voorkeur geniet. In deze module staat de medicamenteuze behandeling van motorische klachten bij de novo patiënten centraal.
Conclusies
Type anti-parkinsonmedicatie
Dagelijks functioenren (UPDRS-II)
|
Redelijk GRADE |
Levodopa geeft waarschijnlijk een grotere verbetering op de UPDRS-II score dan een behandeling met dopamine-agonist of MAO-B remmers in de novo patiënten met de ziekte van Parkinson.
Bronnen: (Storch, 2013; Holloway, 2000; Holloway, 2004; CALM-PD, 2009; Rascol, 2000; Hauser, 2007) |
|
Laag GRADE |
Rasagiline geeft mogelijk een grotere verbetering op de UPDRS-II score dan een placebobehandeling in de novo patiënten met de ziekte van Parkinson.
Bronnen: (Rascol, 2011) |
|
Laag GRADE |
Pramipexol geeft mogelijk een grotere verbetering op de UPDRS-II score dan een placebobehandeling in de novo patiënten met de ziekte van Parkinson.
Bronnen: (Shapira, 2013) |
Motorisch functioneren (UPDRS-III)
|
Laag GRADE |
Levodopa geeft waarschijnlijk een grotere verbetering op de UPDRS-III score dan een behandeling met dopamine-agonist/ MAO-B remmers in de novo patiënten met de ziekte van Parkinson.
Bronnen: (Storch, 2013; Holloway, 2000; Holloway, 2004; CALM-PD, 2009; Marek, 2012; Rascol, 2000; Hauser, 2007) |
|
Laag GRADE |
Rasagiline geeft mogelijk een grotere verbetering op de UPDRS-III score dan een placebobehandeling in de novo patiënten met de ziekte van Parkinson.
Bronnen: (Rascol, 2011) |
|
Laag GRADE |
Pramipexol geeft mogelijk een grotere verbetering op de UPDRS-III score dan een placebobehandeling in de novo patiënten met de ziekte van Parkinson.
Bronnen: (Shapira, 2013) |
Dyskinesieën
|
Redelijk GRADE |
Levodopa zorgt er waarschijnlijk voor dat meer patiënten dyskinesie ontwikkelen in vergelijking met een levodopa-sparende behandeling (dopamine-agonist/ MAO-B remmers) in de novo patiënten met de ziekte van Parkinson.
Bronnen: (Bracco, 2004; CALM-PD, 2009; Caraceni, 2001; Giménez-Roldan, 1997; Gray, 2014; Hauser, 2007; Holloway, 2000; Holloway, 2004; Kulisevsky, 1998; Larsen, 1999; Lees, 1995; Montastruc, 1989; Montrastruc, 1994; Oertel, 2006; Parkinson Study Group, 2004; PD MED, 2014; Rascol, 2000; Rascol, 2010; Rinne, 1989; Rinne, 1998; Utsumi, 2012; Weiner, 1993; Whone, 2003) |
Kwaliteit van leven (PDQ-39)
|
Zeer Laag GRADE |
Het is onduidelijk of levodopa de kwaliteit van leven verbetert in vergelijking met een controlebehandeling (/dopamine-agonist/ MAO-B remmers) in de novo patiënten met de ziekte van Parkinson.
Bronnen: (CALM PD, 2009; Hauser, 2007; Holloway, 2000; Holloway, 2004; PDMED, 2014) |
|
Zeer Laag GRADE |
Het is onduidelijk of pramipexol een verbetering geeft op de PDQ-39 score in vergelijking met een placebobehandeling in de novo patiënten met de ziekte van Parkinson.
Bronnen: (Shapira, 2013) |
|
Zeer Laag GRADE |
Het is onduidelijk of de PDQ-score verschilt tussen de novo patiënten die zijn behandeld met rasagiline of met pramipexol.
Bronnen: (Viallet, 2013) |
Complicaties
|
Zeer Laag GRADE |
Het is onduidelijk of het aantal complicaties verschilt tussen de novo patiënten die zijn behandeld met rasagiline of met pramipexol.
Bronnen: (Viallet, 2013) |
Vroege versus late start anti-parkinsonmedicatie
UPDRS
|
Laag GRADE |
Vroege start met levodopa geeft mogelijk vergelijkbare UPDRS totaal scores als wanneer laat gestart wordt met levodopa in de novo patiënten.
Bronnen: (Verschuur, 2019) |
Dagelijjks functioneren (UPDRS-II)
|
Laag GRADE |
Vroege start met pramipexol geeft mogelijk vergelijkbare UPDRS-II scores als wanneer er laat gestart wordt met pramipexol in de novo patiënten.
Bronnen: (Shapira, 2013) |
|
Laag GRADE |
Vroege start met rasagiline geeft mogelijk vergelijkbare UPDRS-II scores als wanneer er laat gestart wordt met rasagiline in de novo patiënten.
Bronnen: (Rascol, 2011) |
Motorisch functioneren (UPDRS-III)
|
Laag GRADE |
Vroege start met pramipexol geeft mogelijk vergelijkbare UPDRS-III scores als wanneer er laat gestart wordt met pramipexol in de novo patiënten.
Bronnen: (Shapira, 2013) |
|
Laag GRADE |
Vroege start met rasagiline geeft mogelijk vergelijkbare UPDRS-III scores als wanneer er laat gestart wordt met rasagiline in de novo patiënten.
Bronnen: (Rascol, 2011) |
Kwaliteit van leven (PDQ-39)
|
Laag GRADE |
Er is mogelijk geen verschil in PDQ-39 score tussen de novo patiënten die vroeg versus laat starten met Levodopa.
Bronnen: (Verschuur, 2019) |
|
Laag GRADE |
Er is mogelijk geen verschil in PDQ-39 score tussen de novo patiënten die vroeg versus laat starten met pramipexol.
Bronnen: (Shapira, 2013) |
Samenvatting literatuur
Beschrijving studies
Levodopa versus dopamine-agonisten of MAOB-remmers
Xie (2015) onderzocht het effect van levodopa in vergelijking met dopamine-agonisten of MAO-B remmers als initiële behandeling bij de novo patiënten. Xie (2015) dekt de literatuur tot augustus 2014 en beschrijft 11 RCT’s (n=3584). In totaal werden 1594 patiënten gerandomiseerd in de levodopagroep en 1990 in de dopamine-agonist/ MAO-B-remmer groep. Patiënten in de levodopagroep kregen enkelvoudige medicatiebehandeling met levodopa. Patiënten in de dopamine-agonist-/ MAO-B-remmergroep werden behandeld met verschillende type medicatie zoals met cabergoline (Rinne, 1998; Utsumi, 2012; Storch, 2013), pramipexol (Parkinson Study Group, 2000; Holloway, 2000; CALM-PD, 2009), ropinirol (Rascol, 2000; Hauser, 2007), bromocriptine (Caraceni, 2001) of een combinatie van dopamine-agonist plus MAO-B remmers (PD MED, 2004).
De systematische review van Giannakis (2018) onderzocht ook het effect van levodopa bij patiënten in de vroege fase van de ziekte van Parkinson. De primaire uitkomstmaat in de studie van Giannakis (2018) was het aantal patiënten dat dyskinesie ontwikkelde. De studie van Giannakis (2018) dekt de literatuur tot maart 2017 en beschrijft 14 RCT’s (n=2776); 1401 patiënten werden gerandomiseerd in de levodopagroep en 1375 patiënten in de controlegroep. De controle-interventie verschilde tussen de studies en bestond uit een placebobehandeling (Parkinson Study Group, 2004), behandeling met bromocryptine (Montastruc, 1989; Weiner, 1993), lisuride (Rinne, 1989), levodopa-bromocriptine (Montastruc, 1994; Giménez-Roldan, 1997), levodopa-selegiline (Lees, 1995; Larsen, 1999), pergolide (Kulisevsky, 1998; Oertel, 2006); ropinirol (Rascol, 2000; Whone, 2003) of cabergoline (Rinne, 1998; Bracco, 2004). De systematische reviews van Giannakis (2018) en Xie (2015) zijn als basis gebruikt voor de uitwerking van de literatuur. De volgende, voor de werkgroep relevante uitkomstaten, zijn uitgewerkt: UPDRS-II score, UPDRS-III score, dyskinesie en kwaliteit van leven.
Resultaten
Dagelijks functioneren (UPDRS-II)
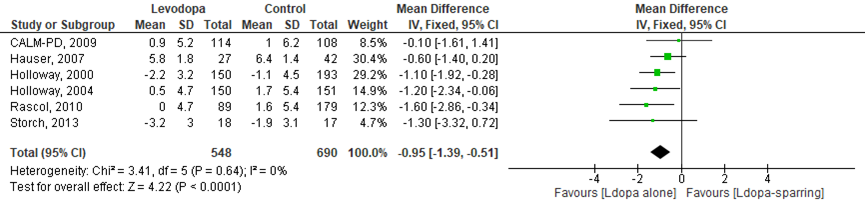
Het verschil in gemiddelde verandering op de UPDRS-II tussen de levodopagroep en de dopamine-agonist/ MAO-B remmer groep werd onderzocht in zes RCT’s (Storch, 2013; Holloway, 2000; Holloway, 2004; CALM-PD, 2009; Rascol, 2000; Hauser, 2007). Het gemiddelde verschil in UPDRS-II-score tussen de novo patiënten die zijn behandeld met levodopa of dopamine-agonist/ MAO-B remmers was -0,95 punten (95%BI -1,39 tot -0,51; p<0,0001); statistisch significant een betere verandering in UPDRS-II in de levodopagroep in vergelijking met de groep behandeld met dopamine-agonisten of MAO-B-remmers (Figuur 1).
Figuur 1 Meta-analyse en forest plot van het gemiddelde verschil in UPDRS-II-score tussen de levodopa en dopamine-agonist/ MAO-B-remmers behandeling in de novo patiënten
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-II is met één niveau verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als redelijk.
Motorisch functioneren (UPDRS-III)
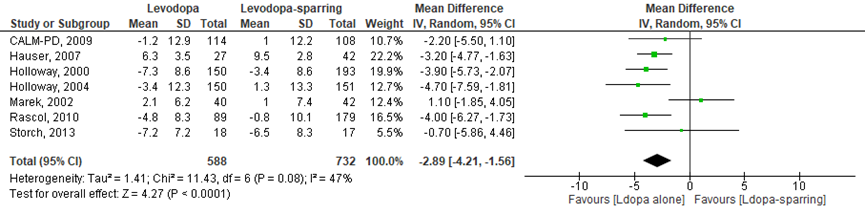
Het verschil in gemiddelde verandering op de UPDRS-III tussen de levodopagroep en de dopamine-agonist/ MAO-B-remmer groep werd onderzocht in zeven RCT’s (Storch, 2013; Holloway, 2000; Holloway, 2004; CALM-PD, 2009; Marek, 2012; Rascol, 2000; Hauser, 2007). Het gemiddelde verschil in UPDRS-III-score tussen de novo-patiënten die zijn behandeld met levodopa en dopamine-agonist/ MAO-B-remmers was -2,89 punten (95%BI -4,21 tot -1,56; p<0,0001); statistisch significant betere verandering in UPDRS III in de levodopagroep in vergelijking met de groep behandeld met dopamine-agonist/ MAO-B-remmers (Figuur 2).
Figuur 2 Meta-analyse en forest plot van het gemiddelde verschil in UPDRS III-score tussen de levodopa en dopamine-agonist/ MAO-B-remmers behandeling in de novo patiënten
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-III is met één niveau verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als redelijk.
Dyskinesieën
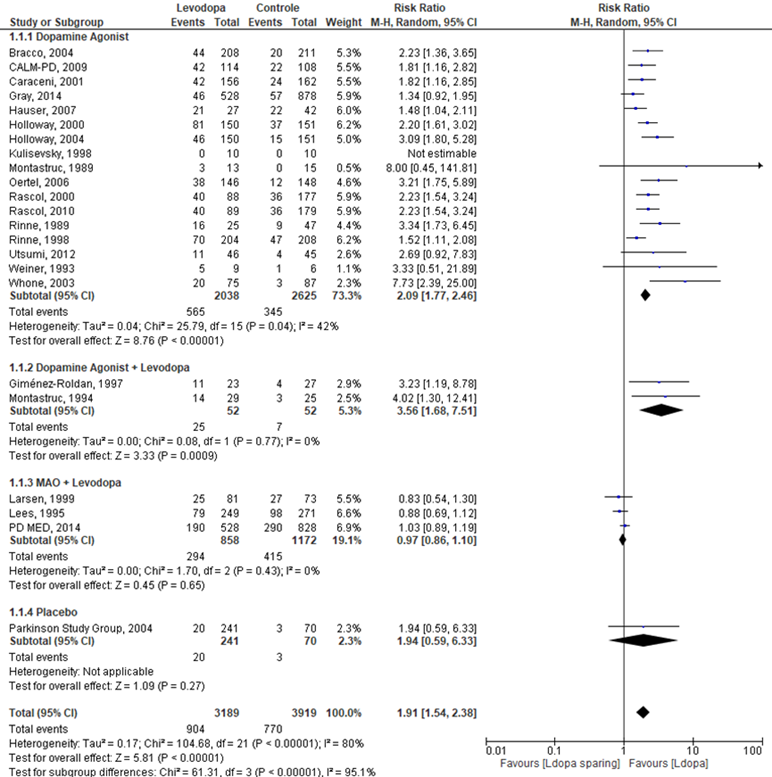
Het verschil in aantal patiënten dat een dyskinesie ontwikkelde tussen de levodopagroep en de controle groep werd onderzocht in 14 RCT’s (Bracco, 2004; CALM-PD, 2009; Caraceni, 2001; Giménez-Roldan, 1997; Gray, 2014; Hauser, 2007; Holloway, 2000; Holloway, 2004; Kulisevsky, 1998; Larsen, 1999; Lees, 1995; Montastruc, 1989; Montrastruc, 1994; Oertel, 2006; Parkinson Study Group, 2004; PD MED, 2014; Rascol, 2000; Rascol, 2010; Rinne, 1989; Rinne, 1998; Utsumi, 2012; Weiner, 1993; Whone, 2003). Dyskinesie kwam voor in 28,3% van de patiënten in de levodopagroep (n=904) en in 19,6% van de patiënten in de controlegroep. Het gemiddelde relatieve risico voor dyskinesie was RR=1,19 (95%BI 1,54 tot 2,38; p<0,0001; n=7.108 patiënten, statistisch significant meer patiënten die een dyskinesie ontwikkelen in de levodopagroep in vergelijking met de controlegroep (Figuur 3).
Figuur 3 Meta-analyse en forest plot van het relatieve risico voor het aantal novo patiënten dat een dyskinesie ontwikkelt na behandeling met levodopasparing techniek versus levodopa
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Dyskinesie is met één niveau verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als redelijk.
Kwaliteit van leven (PDQ-39)
Het verschil in kwaliteit van leven tussen de levodopagroep en de dopamine-agonist-/ MAO-B-remmergroep werd onderzocht in vijf RCT’s (CALM PD, 2009; Hauser, 2007; Holloway, 2000; Holloway, 2004; PDMED, 2014). Alle RCT’s gebruikten de PDQ-39 om kwaliteit van leven te meten. Vanwege de methodologische heterogeniteit is het niet mogelijk om de resultaten te poolen. Drie van de vijf studies vonden geen statisch significant verschil tussen de levodopagroep en de groep behandeld met dopamine-agonist/ MAO-B remmers (p> 0,05) (Holloway, 2004; Hauser, 2007; CALM PD, 2009). Twee studies vonden wel een significant verschil ten gunste van de levodaopagroep (PD MED, 2014; Holloway, 2000). De PD MED (2014) trial vond een gemiddeld verschil van 1,8 punten op de PDQ-39 ten gunste van de levodopagroep (p<0,05), en ook Holloway (2004) rapporteerde een statisch significant verschil in PDQ-39 score ten gunste van de levodopagroep in vergelijking met de groep behandeld met dopamine-agonist/ MAO-B-remmers.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd gezien de inconsistentie en vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Rasagiline versus placebo
Rascol (2011) onderzocht het effect van een rasagiline in een placebogecontroleerde, dubbel geblindeerde RCT. Patiënten, nieuw gediagnosticeerd met de ziekte van Parkinson (n=1176) werden gerandomiseerd verdeeld over drie groepen: de placebogroep (n=593), rasagilinegroep 1 mg (n=288) en rasagilinegroep 2 mg (n=293). De eerste fase van het onderzoek (tot week 36) wordt gekarakteriseerd door het placebo-gecontroleerde onderzoeksdesign, in de tweede fase kregen de patiënten in de placebogroep rasagiline in plaats van placebo (tot week 72) en in deze fase wordt het effect van vroege versus late start rasagiline onderzocht. Baseline patiëntkarakteristieken verschilden niet tussen beide groepen. De volgende voor de werkgroep relevante uitkomsten werden meegenomen: UPDRS-II en UPDRS-III.
Resultaten
Dagelijks functioneren (UPDRS-II)
Het verschil in gemiddelde verandering op de UPDRS-II score tussen de rasagilinegroepen (1 en 2 mg) en placebogroep is onderzocht in één RCT (Rascol, 2011). In de eerste fase was de gemiddelde verandering op de UPDRS-II score in de rasagiline 1 mg groep 0,78 punten (95%BI 0,49 tot 1,06), in de rasagiline 2 mg groep 0,76 punten (95%BI 0,47 tot 1,04) en in de placebogroep 1,64 (95%BI 1,43 tot 1,85). Voor beide rasagilinegroepen was er een statistisch significant verschil in vergelijking met placebo (p<0,05).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-II is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Motorisch functioneren (UPDRS-III)
Het verschil in gemiddelde verandering op de UPDRS-III score tussen de rasagilinegroepen (1 en 2 mg) en placebogroep is onderzocht in één RCT (Rascol, 2011). In de eerste fase was de gemiddelde verandering op de UPDRS-III score in de rasagiline 1mg groep 0,50 punten (95%BI -0,07 tot 1,07), in de rasagiline 2mg groep 0,20 punten (95%BI -0,37 tot 0,76) en in de placebogroep 2,38 (95%BI 1,96 tot 3,85). Voor beide rasagiline groepen was er een statistisch significant verschil in vergelijking met placebo (p<0,05).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-III is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Pramipexol versus placebo
Shapira (2013) onderzocht in dubbel-geblindeerd, placebogecontroleerd onderzoek het effect van vroege versus late behandeling met pramipexol op de UPDRS-scores in de novo patiënten. Patiënten (n=535) werden verdeeld over twee groepen: groep 1 (n=261) kreeg in een vroeg stadium pramipexol (1 mg) en groep 2 (n=274) startte met een placebobehandeling waarna patiënten in stadium twee overstapten naar pramipexol (6/9 maanden). De primaire uitkomstmaat was de score op de UPDRS na 15 maanden. Baseline patiëntkarakteristieken verschilden niet tussen beide groepen. De volgende voor de werkgroep relevante uitkomsten werden meegenomen: UPDRS-II, UPDRS-III en kwaliteit van leven (PDQ-39).
Resultaten
Dagelijks functioneren (UPDRS-II)
Het verschil in gemiddelde verandering op de UPDRS-II score tussen de pramipexolgroep en placebogroep is onderzocht in één RCT (Shapira, 2013). In de eerste fase was de gemiddelde verbetering op de UPDRS-II score in de pramipexolgroep 0,4 punten (SE=0,2) en de gemiddelde verandering in de placebogroep was 1,5 punten (SE=0,2), MD= -1,1 punten (95%BI -1,7 tot -0,5; p=0,0001), statistische significant in het voordeel van de pramipexolgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-II is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Motorisch functioneren (UPDRS-III)
Het verschil in gemiddelde verandering op de UPDRS-III score tussen de pramipexolgroep en placebogroep is onderzocht in één RCT (Shapira, 2013). In de eerste fase was de gemiddelde verbetering op de UPDRS-III score in de pramipexolgroep -0,6 punten (SE=0,2) en de gemiddelde verandering in de placebogroep was 2,7 punten (SE=0,5), MD=3,3 punten (95%BI -4,5 tot -2,2; p<0,0001), statistische significant in het voordeel van de pramipexolgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-III is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Kwaliteit van leven (PDQ-39)
Het verschil in gemiddelde verandering op de PDQ-39 score tussen de pramipexolgroep en placebogroep is onderzocht in één RCT (Shapira, 2013). In de eerste fase was de gemiddelde verbetering op de PDQ-39 score in de pramipexolgroep -0,5 punten (IQR: -3,6 tot 2,0) en de gemiddelde verandering in de placebogroep was 1,4 punten (IQR: -2,2 tot 5,0), MD= -2,0 punten (95%BI -3,1 tot -0,9; p=0,0001), statistische significant in het voordeel van de pramipexolgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat PDQ-39 is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Rasagiline versus pramipexol
Viallet (2013) onderzocht in dubbel-geblindeerd gerandomiseerd onderzoek het effect van rasagiline op het aantal complicaties en kwaliteit van leven bij patiënten in de vroege fase. Patiënten werden verdeeld over twee groepen: groep 1 (n=53) kreeg dagelijks rasagiline (1 mg) en groep 2 (n=56) kreeg dagelijks pramipexol (1,5 mg). De gemiddelde duur van de ziekte was 3,4 maanden en patiënten hadden gemiddelde leeftijd van 62,6 jaar. Baseline karakteristieken verschilden niet tussen beide groepen. De volgende voor de werkgroep relevante uitkomsten werden meegenomen: aantal complicaties en kwaliteit van leven (PDQ-8).
Resultaten
Kwaliteit van leven (PDQ-8 score)
Het verschil in gemiddelde verandering op de PDQ-8 tussen de rasagilinegroep en pramipexolgroep is onderzocht in één RCT (Viallet, 2013). Wilcoxon test liet zien dat de gemiddelde verandering op de PDQ8 in de rasagilinegroep niet verschilde met de pramipexolgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat PDQ-8 is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Complicaties
Het percentage patiënten dat tenmiste één klinisch belangrijke complicatie rapporteerde was 32,1% in de rasagilinegroep en 44,6% in de pramipexolgroep. Het gemiddelde verschil tussen beide groepen was -12,6 (95%BI -27,8 tot 2,6), groter dan de gedefinieerde afkapwaarde van 10%. Echter, dit verschil was niet statistisch significant (Viallet, 2013).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Vroege versus late start anti-parkinsonmedicatie
Levodopa vroege versus laat
Verschuur (2019) onderzocht het effect van levodopa in een placebo-gecontroleerde, dubbel geblindeerde RCT. Patiënten, nieuw gediagnosticeerd met de ziekte van Parkinson (n=446) werden gerandomiseerd verdeeld over twee groepen: groep 1 startte vanaf moment van randomisatie (fase 1) met levodopa (100 mg driemaal daags) in combinatie met carbidopa (25mg driemaal daags) (n=222) en groep 2 startte met placebo en kreeg op week 40 van randomisatie levodopa (100 mg driemaal daags) in combinatie met carbidopa (25 mg driemaal daags) voorgeschreven (vertraagde start). De eerste fase van het onderzoek wordt gekenmerkt door het placebo-gecontroleerde onderzoeksdesign en de tweede fase door het verschil in vroege versus late start anti-parkinsonmedicatie. Baseline patiëntkarakteristieken verschilden niet tussen beide groepen. De volgende voor de werkgroep relevante uitkomsten werden meegenomen: UPDRS-score en PDQ-39.
Resultaten
Kwaliteit van leven (PDQ-39)
Het verschil in gemiddelde verandering op de PDQ39-score tussen de groep patiënten die in de vroege fase of late fase zijn gestart met levodopa-carbidopa is onderzocht in één RCT (Verschuur, 2019). De gemiddelde verandering in PDQ39-score in de groep patiënten die vroeg zijn gestart met levodopa-carbidopa was 7,7 (95%BI 3,2 tot 14,7) punten versus 8,3 (95%BI 3,8 tot 14,7) punten in de groep patiënten die later is gestart met levodopa-carbidopa, MD= -0,39 (95%BI -2,09 tot 1,27; p=ns), geen statistisch significant verschil tussen beide groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat PDQ-39 is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
UPDRS-totaal score
Het verschil in gemiddelde verandering op de UPDRS-totaal tussen de groep patiënten die in de vroege fase of late fase zijn gestart met levodopa-carbidopa is onderzocht in één RCT (Verschuur, 2019). De gemiddelde verandering in UPDRS-totaal score in de groep patiënten die vroeg zijn gestart met levodopa-carbidopa was -1,0 (SD= 13,1) punten versus -2,0 (SD= 13,0) punten in de groep patiënten die later is gestart met levodopa-carbidopa, MD= 1,0 (95%BI -1,5 tot 3,5; p= 0,44), geen statistisch significant verschil tussen beide groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Pramipexol vroeg versus laat
Shapira (2013) onderzocht in dubbel-geblindeerd, placebogecontroleerd onderzoek het effect van vroege versus late behandeling met pramipexol op de UPDRS-scores in de novo patiënten. Patiënten (n=535) werden verdeeld over twee groepen: groep 1 (n=261) kreeg in een vroeg stadium pramipexol (1 mg) en groep 2 (n=274) startte met een placebobehandeling waarna patiënten in stadium twee overstapte naar pramipexol (6/9 maanden). De primaire uitkomstmaat was de score op de UPDRS op 15 maanden. Baseline patiëntkarakteristieken verschilden niet tussen beide groepen. De volgende voor de werkgroep relevante uitkomsten werden meegenomen: UPDRS II, UPDRS III, kwaliteit van leven (PDQ-39).
Resultaten
Dagelijks functioneren (UPDRS-II)
In de tweede fase was ten opzichte van baseline de gemiddelde verandering op de UPDRS-II score in de vroege pramipexolgroep 0,6 punten (SE=0,2) en de gemiddelde verandering in de late pramipexolgroep 0,6 punten (SE=0,0), MD tussen de groepen =0,2 punten (95%BI -0,6 tot 0,6; p=0,98), geen statistisch significant verschil tussen de vroege en late pramipexolgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-II is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Motorisch functioneren (UPDRS-III)
In de tweede fase was ten opzichte van baseline, de gemiddelde verandering op de UPDRS-III score in de vroege pramipexolgroep 0,2 punten (SE=0,1) en de gemiddelde verandering in de late pramipexolgroep was -0,1 punten (SE=0,1), MD=0,2 punten (95%BI -1,1 tot 1,5; p=0,74), geen statistisch significant verschil tussen de vroege en late pramipexolgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-III is met twee niveaus verlaagd vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Kwaliteit van leven (PDQ-39)
In de tweede fase was ten opzichte van baseline, de gemiddelde verandering op de PDQ-39 score in de vroege pramipexolgroep -0,4 punten (IQR: -3,2 tot 3,8) en de gemiddelde verandering in de late pramipexolgroep was 0,3 punten (IQR: -3,6 tot 4,4), MD= -0,6 punten (95%BI -1,8 tot 0,7; p=0,26), geen statistisch significant verschil tussen de vroege en late pramipexolgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat PDQ-39 is met drie niveaus verlaagd gezien ernstige beperkingen in de onderzoeksopzet (risk of bias) en vanwege imprecisie. De bewijskracht is gegradeerd als zeer laag.
Rasagiline vroeg versus laat
Rascol (2011) onderzocht het effect van een rasagiline in een placebogecontroleerde, dubbel geblindeerde RCT. Patiënten, nieuw gediagnosticeerd met de ziekte van Parkinson (n=1176) werden gerandomiseerd verdeeld over drie groepen: de placebogroep (n=593), rasagiline groep 1 mg (n=288) en rasagiline groep 2 mg (n=293). De eerste fase van het onderzoek (tot week 36) wordt gekarakteriseerd door het placebo-gecontroleerde onderzoeksdesign, in de tweede fase krijgen de patiënten in de placebogroep rasagiline in plaats van placebo (tot week 72) en in deze fase wordt het effect van vroege versus late start rasagiline onderzocht. Baseline patiëntkarakteristieken verschilden niet tussen beide groepen. De volgende voor de werkgroep relevante uitkomsten werden meegenomen: UPDRS-II en UPDRS-III.
Resultaten
Dagelijks functioneren (UPDRS-II)
In de tweede fase was het gemiddelde verschil tussen de verandering op de UPDRS-II score in patiënten die vroeg zijn behandeld met rasagiline (1 mg en 2 mg) of laat zijn behandeld met rasagiline, respectievelijk -0,62 (SE=0,29) punten en -0,23 (SE=0,25) punten, geen statistisch significant verschil tussen beide groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-II is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Motorisch functioneren (UPDRS-III)
In de tweede fase was het gemiddelde verschil tussen de verandering op de UPDRS-III score in patiënten die vroeg zijn behandeld met rasagiline (1 mg en 2 mg) of laat zijn behandeld met rasagiline, respectievelijk -0,76 (SE=0,51) punten en 0,36 punten (SE=0,48), geen statistisch significant verschil tussen beide groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat UPDRS-III is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en vanwege imprecisie. De bewijskracht is gegradeerd als laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Zoekvraag 1:
Wat zijn de (on)gunstige effecten van medicamenteuze behandelingen bij de novo patiënten met de ziekte van Parkinson?
P: de novo patiënten ziekte van Parkinson met motorische klachten;
I: medicamenteuze behandeling (levodopa, dopamine-agonisten (bromocripine, pergolide, pramipexol, ropinirol), amantadine, monoamine oxidase type B (MAO-B) remmers (selegiline, rasagiline, safinamide), trihexyfenidyl, biperideen;
C: andersoortige behandeling, placebobehandeling;
O: QoL (PDQ-39, PDQ8), UPDRS II, UPDRS-III, bijwerkingen, dyskinesie.
Zoekvraag 2
Wat zijn de (on)gunstige effecten van een vroege versus een late start met medicamenteuze behandelingen bij de novo patiënten?
P: de novo patiënten ziekte van Parkinson met motorische klachten;
I: vroege medicamenteuze behandeling;
C: late medicamenteuze behandeling;
O: QoL (PDQ-39, PDQ8), UPDRS II, UPDRS-III, bijwerkingen, dyskinesie.
Relevante uitkomstmaten
De werkgroep achtte kwaliteit van leven en UPDRS-II en UPDRS-III scores voor de besluitvorming cruciale uitkomstmaten; en dyskinesieën en bijwerkingen voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt:
- Kwaliteit van leven middels de Parkinson’s Disease Quality of Life Scale (PDQ-39): de werkgroep definieerde een verbetering van -4,22 punten of een achteruitgang van +4,72 punten als een klinisch (patiënt) relevant verschil (Horvath, 2017).
- Motorisch functioneren: de werkgroep definieerde een verbetering van 5 punten op de UPDRS-III als een klinisch (patiënt) relevant verschil.
- Dagelijks functioneren: de werkgroep definieerde een verbetering van 5 punten op de UPDRS-II als een klinisch (patiënt) relevant verschil.
- Dyskinesieën
- Bijwerkingen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 27 februari 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd vergelijkend onderzoek (RCT) die de zoekvraag zouden kunnen beantwoorden. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 155 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: primair vergelijkend onderzoek, RCT’s naar het effect van anti-parkinsonmedicatie bij de novo patiënten met de ziekte van Parkinson. Op basis van titel en abstract werden in eerste instantie 31 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 23 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 8 studies definitief geselecteerd.
In totaal zijn acht publicaties opgenomen in de literatuuranalyse. Twee systematische reviews zijn als basis gebruikt voor de uitwerking van de literatuur aangaande type anti-parkinsonmedicatie (Giannakis, 2018; Xie, 2015) en aangevuld met meer recente publicaties en publicaties die het effect van vroege versus late start van anti-parkinsonmedicatie onderzochten (Rascol, 2011; Pahwa, 2014; Shapira, 2013; Olanow, 2017; Viallet, 2013; Verschuur, 2019). De literatuursamenvatting is opgedeeld in twee delen. In het eerste gedeelte worden de vergelijkingen uitgewerkt betreffende de effectiviteit van type anti-parkinsonmedicatie en in het tweede gedeelte worden de vergelijking uitgewerkt aangaande de timing van de start van de anti-parkinsonmedicatie.
Referenties
- Caraceni T, Musicco M (2001) Levodopa or dopamine agonists, or deprenyl as initial treatment for Parkinson’s disease. A randomized multicenter study. Parkinsonism Relat Disord 7(2):107–114.
- Cilia R, Akpalu A, Sarfo FS, The modern pre-levodopa era of Parkinson's disease: insights into motor complications from sub-Saharan Africa. Brain. 2014 Oct; 137(10): 2731–2742.
- Giménez-Roldán S, Tolosa E, Burguera JA et al (1997) Early combination of bromocriptine and levodopa in Parkinson’s disease: a prospective randomized study of two parallel groups over a total follow-up period of 44 months including an initial 8-month double-blind stage. Clin Neuropharmacol 20(1):67–76
- Gray R, Ives N, Rick C, Patel S, Gray A, Jenkinson C, et al. Long-term effectiveness of dopamine agonists and monoamine oxidase B inhibitors compared with levodopa as initial treatment for Parkinson's disease (PD MED): A large, open-label, pragmatic randomised trial. 2014; The Lancet. 384(9949):1196-205.
- Hauser RA, Rascol O, Korczyn AD et al (2007) Ten-year followup of Parkinson’s disease patients randomized to initial therapy with ropinirole or levodopa. Mov Disord 22(16):2409–2417.
- Holloway RG, Shoulson I, Fahn S, Kieburtz K, Lang A, Marek K, et al. Pramipexole versus levodopa as initial treatment for Parkinson disease: a 4-year randomized controlled trial. Arch Neurol. 2004;61(7):1044-53.
- Giannakis A, Chondrogiorgi M, Tsironis C, Tatsioni A, Konitsiotis S. Levodopa-induced dyskinesia in Parkinson’s disease: still no proof? A meta-analysis. 2018; Journal of Neural Transmission. 125(9):1341-9.
- Kostic V, Przedborski S, Flaster E, Sternic N. Early development of levodopa-induced dyskinesias and response fluctuations in young-onset Parkinson's disease Neurology. 1991;41:202-5
- Kulisevsky J, López-Villegas D, García-Sánchez C et al (1998) A sixmonth study of pergolide and levodopa in de novo Parkinson’s disease patients. Clin Neuropharmacol 21(6):358–362
- Larsen JP, Boas J, Erdal JE et al (1999) Does selegiline modify the progression of early Parkinson’s disease? Results from a five-year study. Eur J Neurol 6(5):539–547
- Lees AJ (1995) Comparison of therapeutic effects and mortality data of levodopa and levodopa combined with selegiline in patients with early, mild Parkinson’s disease. Parkinson’s Disease Research Group of the United Kingdom. BMJ 311(7020):1602–1607
- Montastruc JL, Rascol O, Rascol A (1989) A randomised controlled study of bromocriptine versus levodopa in previously untreated Parkinsonian patients: a 3 year follow-up. J Neurol Neurosurg Psychiatry 52(6):773–775
- Montastruc JL, Rascol O, Senard JM et al (1994) A randomised controlled study comparing bromocriptine to which levodopa was later added, with levodopa alone in previously untreated patients with Parkinson’s disease: a five year follow up. J Neurol Neurosurg Psychiatry 57(9):1034–1038
- Oertel WH, Wolters E, Sampaio C, Gimenez-Roldan S, Bergamasco B, Dujardin M, et al. Pergolide versus levodopa monotherapy in early Parkinson’s disease patients: The PELMOPET study. Mov Disord. 2006;21(3):343-53.
- Olanow CW, Rascol O, Hauser R, Feigin PD, Jankovic J, Lang A, Langston W, Melamed E, Poewe W, Stocchi F, Tolosa E. A double-blind, delayed-start trial of rasagiline in Parkinson's disease.; ADAGIO Study Investigators. N Engl J Med. 2009 Sep 24;361(13):1268-78
- Parkinson Study Group. A controlled, randomized, delayed-start study of rasagiline in early Parkinson disease.Arch Neurol. 2004;61(4):561-6.
- Parkinson Study Group CALM Cohort Investigators (2009) Long-term effect of initiating pramipexole versus levodopa in early Parkinson disease. Arch Neurol 66(5):563–570.
- Pd Med Collaborative Group (2014) Long-term effectiveness of dopamine agonists and monoamine oxidase B inhibitors compared with levodopa as initial treatment for Parkinson’s disease (PD MED): a large, open-label, pragmatic randomised trial. Lancet 384(9949):1196–1205.
- Rascol O, Brooks DJ, Korczyn AD, De Deyn PP, Clarke CE, Lang AE. A five-year study of the incidence of Dyskinesia in patients with early Parkinson’s disease who were treated with ropinirole or levodopa. 056 Study Group. N Engl J Med. 2000;342(20):1484-91.
- Rascol O, Fitzer-Attas CJ, Hauser R, Jankovic J, Lang A, Langston JW, et al. A double-blind, delayed-start trial of rasagiline in Parkinson's disease (the ADAGIO study): Prespecified and post-hoc analyses of the need for additional therapies, changes in UPDRS scores, and non-motor outcomes. 2011; The Lancet Neurology. 10(5):415-23.
- Rinne UK, Bracco F, Chouza C, Dupont E, Gershanik O, Marti Masso JF, et al. Early treatment of Parkinson’s disease with cabergoline delays the onset of motor complications. Results of a double-blind levodopa controlled trial. The PKDS009 Study Group. Drugs. 1998;55(Suppl.1):23-30.
- Schapira AHV, McDermott MP, Barone P, Comella CL, Albrecht S, Hsu HH, et al. Pramipexole in patients with early Parkinson's disease (PROUD): A randomised delayed-start trial. 2013; The Lancet Neurology. 12(8):747-55.
- Storch A, Wolz M, Beuthien-Baumann B et al (2013) Effects of dopaminergic treatment on striatal dopamine turnover in de novo Parkinson disease. Neurology 80(19):1754–1761.
- Utsumi H, Okuma Y, Kano O et al (2013) Evaluation of the efficacy of pramipexole for treating levodopa-induced dyskinesia in patients with Parkinson’s disease. Intern Med 52(3):325–332.
- Utsumi H; Cabergoline as the Starting Treatment and its Long-term Effects (CASTLE) Study Group. Long-term effects of cabergoline and levodopa in Japanese patients with early Parkinson's disease: a 5-year prospective study. Acta Med Okayama. 2012;66(2):163-70.
- Verschuur CVM, Suwijn SR, Boel JA, Post B, Bloem BR, van Hilten JJ, van Laar T, Tissingh G, Munts AG, Deuschl G, Lang AE, Dijkgraaf MGW, de Haan RJ, de Bie RMA; LEAP Study Group. Randomized Delayed-Start Trial of Levodopa in Parkinson's Disease. N Engl J Med. 2019 Jan 24;380(4):315-324. doi: 10.1056/NEJMoa1809983. PubMed PMID: 30673543.
- Xie CL, Zhang YY, Wang XD, Chen J, Chen YH, Pa JL, Lin SY, Lin HZ, Wang WW. Levodopa alone compared with levodopa-sparing therapy as initial treatment for Parkinson's disease: a meta-analysis. Neurol Sci. 2015 Aug;36(8):1319-29. doi: 10.1007/s10072-015-2253-7. Epub 2015 May 17. Review. PubMed PMID: 25981231.
- Viallet F, Pitel S, Lancrenon S, Blin O. Evaluation of the safety and tolerability of rasagiline in the treatment of the early stages of Parkinson's disease. 2013; Current Medical Research and Opinion. 29(1):23-31.
- Weiner WJ, Factor SA, Sanchez-Ramos JR et al (1993) Early combination therapy (bromocriptine and levodopa) does not prevent motor fluctuations in Parkinson’s disease. Neurology 43(1):21–27
- Whone AL, Watts RL, Stoessl AJ, Davis M, Reske S, Nahmias C, et al. Slower progression of Parkinson’s disease with ropinirole versus levodopa: The REAL-PET study. Ann Neurol. 2003;54(1):93-101.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 14-10-2020
Laatst geautoriseerd : 14-10-2020
Geplande herbeoordeling :
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk vijf jaar na de autorisatiedatum besluit het bestuur van de NVN om de richtlijn te updaten. In principe zullen de modules jaarlijks beoordeeld worden of deze nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Naast de ontwikkelde modules, is een aantal onderwerpen niet uitgewerkt in de huidige richtlijn. De werkgroep adviseert om deze op korte termijn alsnog te ontwikkelen omdat hier in de praktijk vraag naar is, te weten:
- urogenitale stoornissen;
- seksuele gezondheid;
- interacties tussen medicijnen ;
- visusstoornissen;
- orthostatische hypotensie;
- mond- en keelklachten;
- obstipatie.
Tabel 1 Geldigheid en onderhoud richtlijnmodules
|
Module |
Regiehou-der(s) |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Diagnostiek |
NVN |
NVN |
Nieuwe inzichten, veranderingen in zorg |
|
Medicamenteuze behandeling de Novo patiënt |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Medicamenteuze behandeling van motorische klachten en responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Geavanceerde therapieën voor responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN, NVvN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling houdingsproblematiek bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling valrisico bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Impulscontrolestoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Dopamine dysregulatie-stoornis bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Angststoornissen bij de ziekte van Parkinson |
NVN |
NVvP, NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Apathie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Depressie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Wanen en hallucinaties bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVKG |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Cognitieve stoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vermoeidheid bij de ziekte van Parkinson |
NVN |
NVN, NIP, NVKG |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Slaapstoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Pijnklachten bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Coping met de ziekte van Parkinson |
NVN |
NVN, V&VN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Werk en arbeidsongeschiktheid |
NVN |
NVAB |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Rijgeschiktheid |
NVN, VRA |
NVN, VRA |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Mantelzorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medicinale cannabis bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Mucuna Pruriens bij de ziekte van Parkinson |
NVN |
NVN, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vitamine B12 of D-suppletie bij de ziekte van Parkinson |
NVN |
NVN, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Multidisciplinaire revalidatieprogramma’s bij de ziekte van Parkinson |
VRA |
VRA, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Palliatieve zorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Advance care planning |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medische symptoombehandeling in de stervensfase |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
eHealth bij de ziekte van Parkinson |
NVN |
NVN |
Veranderingen in zorg |
|
Netwerkzorg, casemanagement en verwijscriteria |
NVN, VRA |
NVN, ParkinsonNet |
Veranderingen in zorg |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap (NHG)
- Parkinson Vereniging (PV)
- Vereniging van Specialisten Ouderengeneeskunde (Verenso)
- Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- Ergotherapie Nederland (EN)
- Nederlands Instituut van Psychologen (NIP)
- Nederlandse Vereniging van Diëtisten (NVD)
- ParkinsonNet, beroepsvereniging van professionals in sociaal werk (BPSW)
- Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVvS)
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Nederlandse Associatie Physician Assistants (NAPA)
- ParkinsonNet
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente (para)medische kennis omtrent de zorg voor patiënten met ziekte van Parkinson wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson te maken hebben.
Werkgroep
- Prof. dr. T. (Teus) van Laar (voorzitter), neuroloog, NVN
- Dr. A.J.W. (Agnita) Boon, neuroloog, NVN
- Dr. J.I. (Jorrit) Hoff, neuroloog, NVN
- Dr. M.L. (Mark) Kuijf, neuroloog, NVN
- Dr. A.G. (Alexander) Munts, neuroloog, NVN
- Dr. B. (Bart) Post, neuroloog, NVN
- Dr. G. (Gerrit) Tissingh, neuroloog, NVN (tot ..)
- Dr. F.J. (Erik) Slim, vicevoorzitter, revalidatiearts, VRA
- Drs. W.J. (Willem) Oudegeest, , revalidatiearts, VRA
- Drs. S.P. (Susan) Meuleman, revalidatiearts, VRA
- Prof. dr. O.A. (Odile) van den Heuvel, psychiater, NVvP
- Prof. dr. A.F.G. (Albert) Leentjens, psychiater, NVvP
- Dr. G. (Bert) Ziere, klinisch geriater, NVKG
- Drs. H.J. (Hannie) Scheper, specialist Ouderengeneeskunde, Verenso
- Dr. A.L. (Abram) Rutgers, huisarts, NHG
- Dr. A.A. (Annelien) Duits, klinisch neuropsycholoog, NIP
- H.H. (Herma) Lennaerts – Kats MSc, Parkinsonverpleegkundige, V&VN, ParkinsonNet
- T. (Tiny) van Wieren-Beerda MSc, verpleegkundig specialist parkinson, V&VN
- Drs. M.M. (Masja) van het Hoofd, beleidsmedewerker, Parkinson Vereniging
- Drs. K.C. (Kaie) Klaassen, patiënt-onderzoeker, Parkinson Vereniging
- Drs. M. (Marianne) Luinstra, ziekenhuisapotheker, NVZA
- Dr. M. (Marlies) van Nimwegen, fysiotherapeut (niet praktiserend), KNGF, ParkinsonNet
- Dr. I.H.W.M. (Ingrid) Sturkenboom, ergotherapeut, EN, ParkinsonNet
- K. (Karin) Overbeek-Dekker, diëtist, NVD, ParkinsonNet
- Dr. M. (Marten) Munneke, ParkinsonNet
Klankbordgroep
- Dr. J.G. (Hanneke) Kalf, logopedist, NVLF, ParkinsonNet
- K. (Klaas) Kooistra MSc, apotheker, KNMP
- P.R.I. (Paul) Rabsztyn, verpleegkundig seksuoloog SH (seksuologische hulpverlening) &VPO (voorlichting preventie en onderwijs), NVvS
- Dr. F.J.A. (Anton) Meijer, Neuro- en hoofd-hals radioloog, NVvR
- Prof. Dr. Y. (Yasin) Temel, neurochirurg, NVvN
- Drs. J.P. (Jacqueline) Janssen, Bedrijfsarts, klinisch arbeidsgeneeskundige, NVAB
- M. (Marlinda) Bakker, Geriatrisch maatschappelijk werker, BPSW
- Drs. A.L.A.J. (Danny) Hommel, specialist ouderengeneeskunde, Verenso
- Drs. H. (Hajo) Jongepier, huisarts, NHG
Met ondersteuning van
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. ir. N.L. (Nikita) van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Linda) Niesink-Boerboom, literatuurspecialist, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Guiterrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S. (Sonja) Wouters, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Parkinson Vereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door stakeholderpartijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn ziekte van Parkinson (NVN, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens de invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). De zekerheid van het bewijs wordt beïnvloed door beperkingen in studieopzet- of uitvoering (risk of bias), imprecisie, inconsistentie, indirectheid en publicatiebias.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De formulering van de conclusies hangt af van de bewijskracht. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Netwerkzorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten in de bijlagen).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.

