Blootstelling van derden bij therapie met 90Y
Uitgangsvraag
Zijn maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 90Y redelijkerwijs noodzakelijk?
Indien de uitgangsvraag positief wordt beantwoord:
Welke maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 90Y zijn redelijkerwijs noodzakelijk?
Aanbeveling
Uitgaande van het generieke, conservatieve model en een generiek scenario worden de blootstellingskaders zoals beschreven in de algemene inleiding op de richtlijn niet overschreden. Desondanks kan vanuit ALARA principe worden aanbevolen leefregels aan te houden. Op basis van bovenstaande overwegingen en de gepubliceerde leefregels voor Zevaling, SIRT en RSV in de Procedure Guidelines van de NVNG worden de volgende aanbevelingen gedaan:
Aanbevelingen 90Y ibritumomab tiuxetan (Zevalin)
In geval van het generieke scenario en het generieke biokinetisch model wordt aangetoond dat er geen aanvullende maatregelen en/of leefregels ten behoeve van het beperken van externe of inwendige blootstelling vereist zijn. Onderbouw in afwijkende situaties op basis van berekening met de daarvoor bestemde rekentool welke maatregelen en/of leefregels benodigd zijn om te borgen dat dosisbeperkingen niet worden overschreden.
Overweeg of het nodig is een vliegbrief mee te geven. De noodzaak hiervan hangt af van patiëntspecifieke gegevens zoals de activiteit, het toegediende radiofarmacon en het moment van reizen.
Om te bepalen of een vliegbrief noodzakelijk is kan gebruik gemaakt worden van de rekentool van de Nederlandse Commissie voor Stralingsdosimetrie (NCS):
Zwangerschap is een contra-indicatie voor deze therapie. Borstvoeding dient te worden gestaakt.
Geef de patiënt de instructie dat bij bezoek aan een zorgverlener binnen een week na toediening moet worden aangegeven dat de patiënt therapie met radiofarmaca heeft ondergaan en dat de zorgverlener voor verdere informatie contact kan opnemen met de behandelend arts.
Bij overlijden binnen 24 dagen na therapie is maatwerk met betrekking tot stralingshygiënische aspecten benodigd. Wijs de patiënt en indien van toepassing de verzorger dienen erop dat mogelijk beperkingen met betrekking tot lijkbezorging zullen gelden.
Aanbevelingen 90Y-microsferen (SIRT)
In geval van het generieke scenario en het generieke biokinetisch model wordt aangetoond dat er geen aanvullende maatregelen en/of leefregels ten behoeve van het beperken van externe of inwendige blootstelling vereist zijn. Onderbouw in afwijkende situaties op basis van berekening met de daarvoor bestemde rekentool welke maatregelen en/of leefregels benodigd zijn om te borgen dat dosisbeperkingen niet worden overschreden.
Overweeg of het nodig is een vliegbrief mee te geven. De noodzaak hiervan hangt af van patiëntspecifieke gegevens zoals de activiteit, het toegediende radiofarmacon en het moment van reizen.
Om te bepalen of een vliegbrief noodzakelijk is kan gebruik gemaakt worden van de rekentool van de Nederlandse Commissie voor Stralingsdosimetrie (NCS):
Zwangerschap is een contra-indicatie voor deze therapie. Borstvoeding dient te worden gestaakt.
Geef de patiënt de instructie dat bij bezoek aan een zorgverlener binnen drie dagen na toediening moet worden aangegeven dat de patiënt therapie met radiofarmaca heeft ondergaan en dat de zorgverlener voor verdere informatie contact kan opnemen met de behandelend arts.
Bij overlijden binnen 29 dagen na therapie is maatwerk met betrekking tot stralingshygiënische aspecten benodigd. Wijs de patiënt en indien van toepassing de verzorger dienen erop dat mogelijk beperkingen met betrekking tot lijkbezorging zullen gelden.
Aanbevelingen 90Y-sulfide
In geval van het generieke scenario en het generieke biokinetisch model wordt aangetoond dat er geen aanvullende maatregelen en/of leefregels ten behoeve van het beperken van externe of inwendige blootstelling vereist zijn. Onderbouw in afwijkende situaties op basis van berekening met de daarvoor bestemde rekentool welke maatregelen en/of leefregels benodigd zijn om te borgen dat dosisbeperkingen niet worden overschreden.
Overweeg of het nodig is een vliegbrief mee te geven. De noodzaak hiervan hangt af van patiëntspecifieke gegevens zoals de activiteit, het toegediende radiofarmacon en het moment van reizen.
Om te bepalen of een vliegbrief noodzakelijk is kan gebruik gemaakt worden van de rekentool van de Nederlandse Commissie voor Stralingsdosimetrie (NCS):
Zwangerschap is een contra-indicatie voor deze therapie. Borstvoeding dient te worden gestaakt.
Geef de patiënt de instructie dat bij bezoek aan een zorgverlener binnen drie dagen na toediening moet worden aangegeven dat de patiënt therapie met radiofarmaca heeft ondergaan en dat de zorgverlener voor verdere informatie contact kan opnemen met de behandelend arts.
Bij overlijden binnen 18 dagen na therapie is maatwerk met betrekking tot stralingshygiënische aspecten benodigd. Wijs de patiënt en indien van toepassing de verzorger dienen erop dat mogelijk beperkingen met betrekking tot lijkbezorging zullen gelden.
Overwegingen
Biokinetisch model
Bij SIRT en radiosynoviorthese (RSV) wordt 90Y rechtstreeks ingebracht en blijft het opgesloten in de lever (SIRT) of knie (RSV) en is er geen of een verwaarloosbaar kleine klaring door het lichaam. Lekkages bij RSV zijn maximaal in de orde van 1%, dankzij immobilisatie van het gewricht.
Voor alle blootstellingsberekeningen bij SIRT en RSV kan worden uitgegaan van een puntbron benadering, zonder zelfabsorptie en zonder weglekkende activiteit. De tijdactiviteitscurve wordt dan gelijkgesteld aan het fysisch verval, zie Figuur 1.
In het geval van Zevalin verspreidt de activiteit zich naar verschillende organen en weefsels en
is er ook sprake van enige klaring door de urine (rond de 6% gemeten over een periode van 7 dagen post-therapie [Wiseman, 2000]). Metingen van dosistempo 24 uur na toediening van 3 GBq 90Y Zevalin bij 50 patiënten [Cremonesi, 2006] lagen gemiddeld onder de 5 µGy·h-1 op 5 cm. Ook in dit geval geldt dat de extern meetbare straling het meest bepaald zal worden door de remstraling van de uitgezonde β-deeltjes. Conservatief wordt de dosis ten gevolge van remstraling gesteld op 1 µSv·h-1·GBq-1 op 1 meter en wordt voor de berekening van de externe blootstelling aangenomen dat er geen klaring optreedt.
90Y is een pure β-straler die al met een kleine hoeveelheid zacht weefsel kan worden afgeschermd. De extern meetbare straling zal het meest bepaald worden door de remstraling als gevolg van de uitgezonde β-deeltjes door de toegediende activiteit in het gewricht. Vanwege de minimale lekkage is het een veilige aanname om de biologische klaring voor een gewricht te negeren. Voor SIRT ligt de gemeten gemiddelde omgevingsdosistempoequivalent direct na therapie met 5 GBq op 1 meter onder de 3 Sv·h-1. In de literatuur zijn geen artikelen gevonden van het omgevingsdosistempo bij RSV maar gezien de veel lagere dosering (typisch tot 220 MBq [Chojnowski, 2016]) zal dit dosistempo ook veel lager liggen dan bij SIRT. Conservatief wordt de dosis ten gevolge van remstraling gesteld op 1 µSv·h-1·GBq-1 op 1 meter.
Daar de toegediende activiteit door het hele lichaam verspreidt, wordt de ioniserende straling deels afgeschermd en vindt build-up plaats. Op basis van de geometrische progressiebenadering [Shultis, 2000] voor het berekenen van de build-up, conversiecoëfficienten voor verschillende fotonenergieën en het vervalschema is de transmissie inclusief build-up ftli berekend. In de berekening is aangenomen dat de patiënt een diameter van 30 centimeter heeft.
Tabel 2: eigenschappen van 90Y
|
hfoton(10) (µSv·h-1·GBq-1 op 1 m) [Otto, 2016] |
0 |
|
hfoton(0.07) (mSv·h-1·GBq-1 op 10 cm) [Otto, 2016] |
0 |
|
hhuidbesmetting(0.07) (mSv·h-1·kBq-1·cm2) [Petoussi, 1993] |
1,61 |
|
DCCingestie (Sv·Bq-1) [ICRP 119, 2012] |
2,7·10-9 |
|
T1/2,fys (h) [ICRP 119, 2012] |
64,0 |
|
Vrijstellingswaarde activiteitsconcentratie (kBq·kg-1) [Bbs, 2018] |
1·103 |
|
Vrijstellingswaarde activiteit (Bq) [Bbs, 2018] |
1·105 |
Tabel 3: gehanteerde parameters voor berekening van de potentiële blootstelling voor de beschreven therapieën
|
Therapie |
T1/2,biol (h) |
ftli |
|
90Y ibritumomab tiuxetan (Zevalin) |
∞ |
0,81 |
|
90Y SIRT |
∞ |
0,81 |
|
90Y radiosynoviorthese |
∞ |
0,81 |
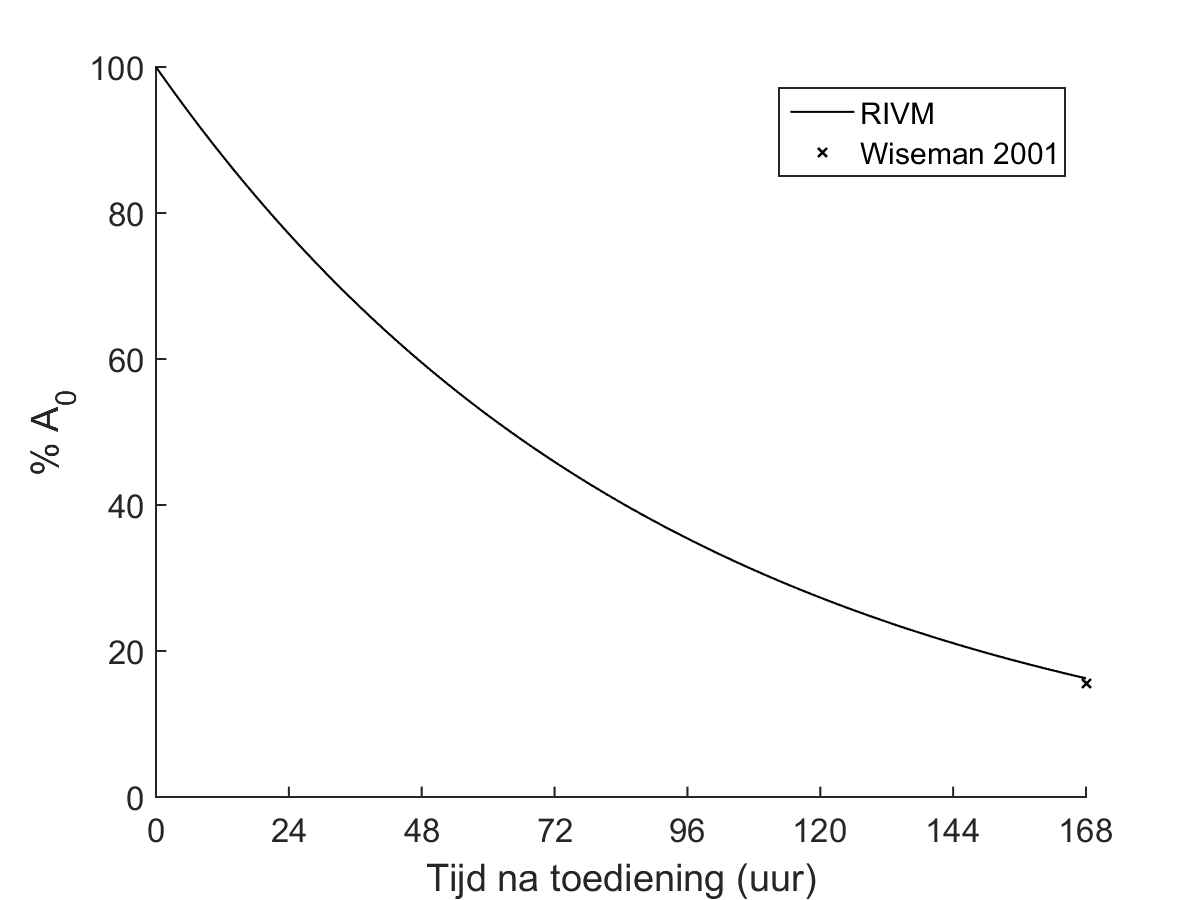
Figuur 1: biokinetisch model voor therapieën met 90Y, op basis van fysisch verval (Tabel 3) ten behoeve van het bepalen van de externe blootstelling. De NVNG hanteert het model van het RIVM.
Externe blootstelling
Aangezien de verhouding tussen de dosisequivalenttempoconstante voor de huid h(0.07) en voor het lichaam h(10) kleiner is dan de verhouding tussen de dosisbeperking voor de huid en het lichaam wordt de effectieve dosis als beperkende factor beschouwd.
De blootstellingscenario’s in het RIVM-rapport [Kloosterman, 2020] zijn gehanteerd als uitgangspunt bij het bepalen van de externe blootstelling. Bij toediening van 4000 MBq 90Y bedraagt de conservatief berekende externe blootstelling minder dan 0,3 mSv voor verzorgers, kinderen of derden gedurende de eerste 21 dagen na toediening zonder leefregels. Voor RSV en Zevalin ligt de blootstelling lager (Appendix A).
Besmetting en ingestie 90Y ibritumomab tiuxetan (Zevalin)
In het geval van therapie met 90Y-Zevalin kan vanwege de renale klaring huidbesmetting met een druppel urine voorkomen; bijvoorbeeld wanneer een druppel urine is gemorst op de toiletbril, of via de patiënt op een oppervlakte terecht is gekomen. Om de ordegrootte van de huiddosis te schatten, wordt de activiteit in een druppel geschat:
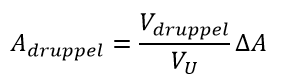
met Adruppel de activiteit in een druppel, Vdruppel het volume van een druppel, VU urineproductie in een tijdsinterval en ΔA de activiteit die biologisch wordt geklaard in dat tijdsinterval. Bij een druppel van 50 µl, 1000 ml urineproductie in 24 uur en een biologische klaring van 6% van de toegediende activiteit in de eerste 7 dagen na toediening bedraagt de activiteit in een druppel 0,5 kBq bij een toegediende activiteit van 1,2 GBq. Bij de dosisequivalenttempoconstante voor huidbesmetting van 1,61 mSv·cm2·h-1·kBq-1 levert een huidbesmetting van 1 cm2 met 10% van de activiteit in de druppel urine persisterend op de huid een huiddosis van 83 µSv·h-1.
Indien de huidbesmetting onopgemerkt blijft, kan deze leiden tot ingestie. Ingestie van 10% van de activiteit in de hierboven beschreven druppel leidt tot een effectieve volgdosis van 0,1 µSv voor volwassenen.
Op basis van het biokinetisch model kan gesteld worden dat 168 uur na toediening geen noemenswaardige biologische klaring meer plaatsvindt.
Besmetting en ingestie 90Y-microsferen (SIRT) en 90Y-sulfide
Aangezien uit de literatuur blijkt dat de renale klaring bij SIRT verwaarloosbaar is, is het overschrijden van dosisbeperkingen door huidbesmetting en/of ingestie geen reëel scenario voor deze therapie.
Vanwege de renale klaring bij RSV kan huidbesmetting met een druppel urine voorkomen; bijvoorbeeld wanneer een druppel urine is gemorst op de toiletbril, of via de patiënt op een oppervlakte terecht is gekomen. Om de ordegrootte van de huiddosis te schatten, wordt de activiteit in een druppel geschat:
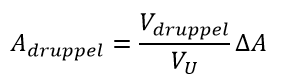
met Adruppel de activiteit in een druppel, Vdruppel het volume van een druppel, VU urineproductie in een tijdsinterval en ΔA de activiteit die biologisch wordt geklaard in dat tijdsinterval. Bij een druppel van 50 µl, 1000 ml urineproductie in 24 uur en een dagelijkse biologische klaring van 1% van de toegediende activiteit bedraagt de activiteit in een druppel de eerste dag na toediening 110 Bq. Bij de dosisequivalenttempoconstante voor huidbesmetting van 1,61 mSv·cm2·h-1·kBq-1 levert een huidbesmetting van 1 cm2 met 10% van de activiteit in de druppel urine persisterend op de huid een huiddosis van 0,02 mSv·h-1.
Indien de huidbesmetting onopgemerkt blijft, kan deze leiden tot ingestie. Ingestie van 10% van de activiteit in de hierboven beschreven druppel leidt tot een effectieve volgdosis van 0,03 µSv voor volwassenen.
Gezien het bovenstaande is een overschrijding van de dosisberperkingen bij huidbesmetting en inwendige besmetting niet realistisch.
Zwangerschap wordt in de Procedure Guidelines van de NVNG aangemerkt als contra-indicatie voor zowel SIRT als RSV. Borstvoeding wordt in de Procedure Guidelines van de NVNG aangemerkt als contra-indicatie voor RSV [Procedure Guidelines NVNG, 2017].
De werkgroep is van mening dat in de meeste gevallen met systemische behandeling het best gekozen kan worden om het geven van borstvoeding af te raden. Bij RSV is op grond van een aantal studies weliswaar te verwachten dat de lekkage uit het gewricht laag zijn, toch zijn er maar heel weinig specifieke studies gevonden die naar activiteit in borstvoeding hebben gekeken.
Pigree et al. [Pigree, 2019] gaan specifiek in op de aanwezigheid van 90Y in borstvoeding na RSV en beschrijven een casus van een patiënt waarbij na toediening van 185 MBq 90Y in de knie, 32 uur na injectie, in de borstvoeding een maximale concentratie van 90Y van 22,5 kBq·l-1 werd aangetroffen.
Deze casuïstiek laat zien dat door het geven van borstvoeding een volgdosis in de ordegrootte van 1 mSv kan worden ontvangen na radiosynoviorthese. Vanwege deze bevinding en de contra-indicatie voor zwangerschap en het geven van borstvoeding in de Procedure Guidelines van de NVNG wordt aangeraden om borstvoeding te staken [Procedure Guidelines NVNG, 2017]. Behoudens dat artikel zijn er geen artikelen gevonden die een activiteit buiten de injectieplaats hebben aangetroffen [Barber, 2016; Spooren, 1985].
Overlijden
Bij gebrek aan wet- en regelgeving op stralingshygiënisch vlak met betrekking tot het omgaan met patiënten die overlijden na radionuclidentherapie wordt teruggevallen op de vrijstellings- en vrijgavewaarden zoals vastgelegd in het Besluit basisveiligheidsnormen stralingsbescherming [Bbs, 2018].
Bij toediening van 1,2 GBq 90Y ten behoeve van therapie met 90Y - Zevalin wordt de vrijstellingswaarde voor activiteitsconcentratie 11 dagen na toediening bereikt voor een patiënt van 70 kg conform het biokinetisch model. In geval van crematie wordt conservatief aangenomen dat alle activiteit in 2,5 kg as achterblijft [Siegersma, 2019], waardoor de vrijstellingswaarde voor activiteitsconcentratie wordt bereikt na 24 dagen.
Bij toediening van 4,0 GBq 90Y ten behoeve van SIRT wordt de vrijstellingswaarde voor activiteitsconcentratie 16 dagen na toediening bereikt voor een patiënt van 70 kg conform het biokinetisch model. In geval van crematie wordt conservatief aangenomen dat alle activiteit in 2,5 kg as achterblijft [Siegersma, 2019], waardoor de vrijstellingswaarde voor activiteitsconcentratie wordt bereikt na 29 dagen.
Bij toediening van 0,22 GBq 90Y ten behoeve van RSV wordt de vrijstellingswaarde voor activiteitsconcentratie 5 dagen na toediening bereikt voor een patiënt van 70 kg conform het biokinetisch model. In geval van crematie wordt conservatief aangenomen dat alle activiteit in 2,5 kg as achterblijft [Siegersma, 2019], waardoor de vrijstellingswaarde voor activiteitsconcentratie wordt bereikt na 18 dagen.
Bij overlijden binnen deze periodes gelden mogelijk beperkingen met betrekking tot lijkbezorging en is maatwerk met betrekking tot stralingshygiënische aspecten benodigd.
Onderbouwing
Achtergrond
In deze module wordt behandeld:
- 90Y ibritumomab tiuxetan (Zevalin)
- 90Y-microsferen (SIRT)
- 90Y-sulfide
90Y ibritumomab tiuxetan (Zevalin) is een radiofarmacon dat kan worden ingezet bij de behandeling van non-Hodgkin lymfoom, bij progressief of persisterend CD20+ folliculair B-cel non-Hodgkin lymfoom of als consolidatie therapie bij patiënten met folliculair non-Hodgkin lymfoom na partiële of complete respons op eerstelijns-chemotherapie. 90Y is hierbij gebonden aan monoclonale antilichamen die gericht zijn op de tumorcellen van het lymfoom en binden zich aan deze cellen zodat deze direct bestraald worden met de beta-straling van het 90Y [Chamarty, 2011].
Bij 90Y-SIRT is 90Y gekoppeld aan glazen of hars microsferen en wordt via selectieve katheterisatie in een tak van de arteria hepatica, die een hepatocellulair carcinoom of levermetastase voedt, ingespoten. De diameter van de microsferen is in de ordegrootte van enkele tientallen µm waardoor de microsferen de arteriolen van de tumor emboliseren. Omdat 90Y een pure β-emitter is met een maximumdracht in weefsel van 10 mm, wordt zo lokaal een stralingsdosis afgeleverd in de tumor in de lever terwijl de stralingsdosis in gezond omliggend weefsel beperkt blijft [Lee, 2016].
Een andere toepassing van 90Y is in verbinding met sulfide in het kader van radiosynoviorthese (RSV). Deze vorm van therapie wordt toegepast bij persisterende synovitis, ondanks behandeling met corticosteroïden, bij synovitis villonodularis pigmentosa en bij recidiverende gewrichtsbloedingen bij patiënten met hemofilie. Het werkingsmechanisme berust op intra-articulaire injectie van radioactief gelabelde colloïdale deeltjes die door synoviocyten, macrofaag-achtige cellen, gefagocyteerd worden. Deze cellen liggen in de buitenste laag van het synoviale membraan waar door de afgegeven β-straling water hydrolyse, productie van zuurstofradicalen en celapoptosis optreedt door de oxidatieve stress. Dit leidt tot necrose en vervolgens fibrose van het synoviale membraan, met daardoor een afname van de synoviale vochtproductie en klinisch afname van de ontstekingsklachten [Chojnowski, 2016].
Na toediening van 90Y kunnen personen die zich bevinden in de nabijheid van een patiënt die hiermee is behandeld mogelijk worden blootgesteld aan ioniserende straling. Deze module beschrijft de aard en omvang van die potentiële blootstelling. Op basis hiervan is met inachtneming van de kaders die in de algemene inleiding van de richtlijn zijn beschreven gedefinieerd welke maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 90Y redelijkerwijs noodzakelijk zijn.
Samenvatting literatuur
28 studies werden gevonden naar blootstelling van derden ten gevolge van therapie met 90Y. Wegens het ontbreken van vergelijkende of prognostische studies naar de gevolgen van de mate van blootstelling met 90Y ibritumomab tiuxetan, 90Y SIRT en 90Y radiosynoviorthese en bijbehorende maatregelen is de literatuur beschrijvend weergegeven. Er is om diezelfde reden een aangepaste beoordeling van de bewijskracht uitgevoerd (zie Verantwoording).
Biokinetisch model 90Y ibritumomab tiuxetan (Zevalin)
Er zijn verschillende studies die hebben gekeken naar de biodistributie van 90Y ibritumomab tiuxetan en de dosimetrie die daarbij hoort. In de meeste studies gebeurt dit door gebruik te maken van een diagnostische scan met een gammacamera en 111In-ibritumomab waarvan algemeen wordt aangenomen dat dit hetzelfde biokinetisch gedrag vertoont.
De studie van Rizvi et al. heeft met behulp van 89Zr gelabeld ibritumomab quantitatieve PET gebruikt om de biodistributie en effectieve halveringstijden in het bloed, de longen, nieren, milt en lever te bepalen. Voor de klaring van het bloedcompartiment naar andere lichaamsdelen werd in de eerste fase 1-72 uur na toediening een effectieve halveringstijd van 42 ± 9 uur gevonden en in de tweede fase een halveringstijd van 66 ± 20 uur [Rizvi, 2012].
De studie van Arichiello et al. heeft gekeken naar het percentage van de toegediende activiteit als functie van de tijd in de lever, het rode beenmerg en het totale lichaam en komt tot een schatting van de effectieve halveringstijd van 50 uur voor het totale lichaam [Arrichiello, 2012].
Twee studies van Wiseman et al. beschrijven een biologische halveringstijd (mediaan) van 46 uur (18-140) voor de activiteit in bloed, waaruit een effectieve halveringstijd in bloed van 27 (14-44) uur kan worden berekend. Wiseman et al. hebben ook de uitgescheiden fractie van de toegediende activiteit in urine onderzocht. Aan de hand van diagnostiek met 111In-Zevalin vonden zij in twee studies dat de gemiddelde fractie van uitgescheiden 90Y activiteit respectievelijk gelijk was aan 9,2% en 11,5%. Een directe bepaling van de urineklaring kwam uit op 5,8% van de toegediende activiteit in een periode van 7 dagen na toediening [Wiseman, 2000; Wiseman, 2001].
In de studie van Arico wordt melding gemaakt van abnormale uptake in de lever bij twee patiënten en worden effectieve halveringstijden in bloed gemeld van 6.2 en 55.5 uur [Arico, 2009].
Biokinetisch model 90Y-microsferen (SIRT)
Voor SIRT laat de studie van Lambert et al. zien dat zowel voor glazen microsferen (0,0641%) als hars microsferen (0,0025%) de uitgescheiden fractie microsferen erg laag is [Lambert, 2011]. De gemiddelde activiteit die werd aangetroffen in de verzamelde urine na 12 uur waren 52 kBq (glas) op basis van 6 patiënten en 1128 kBq (hars) op basis van 15 patiënten. De studie van Song et al. heeft in groepsgrootte van 23 patiënten gevonden dat de long shunt fractie ongeveer 0,018 bedraagt [Song, 2015].
Biokinetisch model 90Y-sulfide
In het geval van RSV hebben Barber et al. gekeken naar systemische lekkage in een studie van 41 patiënten waarbij 41 knieën of ellebogen werden behandeld. Bij twee patiënten werd lekkage waargenomen naar regionale lymfklieren. Bij geen van de patiënten werd systemische lekkage naar lever of milt gevonden en bij drie patiënten was sprake van extra articulaire activiteit [Barber, 2016].
Extra onderbouwing voor deze bevindingen wordt gegeven door Spooren et al. die geen activiteit na 24 en 48 uur in regionale lymfklieren vonden [Spooren, 1985].
Scenario’s 90Y ibritumomab tiuxetan (Zevalin)
Meo et al. hebben bij 8 patiënten die een Zevalin-therapie hebben ondergaan het air kerma dosistempo gemeten op 1 m en 2,5 uur na toediening. Gemiddeld werd een dosistempo van 4,4 µGy h-1 gevonden bij een gemiddelde toegediende dosis van 1 GBq [Meo, 2008].
Vergelijkbare waardes werden gemeten in een studie met 50 patiënten door Cremonesi et al. In deze studie werd het air kerma rondom 50 patiënten gemeten na 1, 24 en 48 uur op afstanden van 5, 20, 50 en 100 cm bij een toediening van 3 GBq 90Y-Zevalin. Gemiddeld werd na 1 uur een dosistempo van ongeveer 30 µGy h-1 op een afstand van 1 m gemeten en na 24 uur waren alle gemeten dosistempi gemiddeld lager dan 5 µGy h-1 op 5 cm [Cremonesi, 2006].
Meredith et al. hebben de dosis voor 13 familieleden van patiënten behandeld met Zevalin gedurende 7 dagen na therapie gemeten [Meredith, 2006]. De mediaan van de stralingsblootstelling hierbij kwam uit op 35 Sv.
Scenario’s 90Y-microsferen (SIRT) en 90Y-sulfide
Cournane et al. hebben bij 30 patiënten direct post therapie dosistempo’s gemeten op verschillende afstanden. Bij direct contact op de buik vinden zij een dosis van 30 Sv h-1GBq-1, op 30 cm afstand een dosis van 4 Sv h-1GBq-1 en op 1 m afstand een dosis van 0,59 Sv h-1GBq-1 [Cournane, 2019]. Law et al. vonden tijdens de therapie een gemeten dosis van 0,71 Sv h-1GBq-1 op een afstand van 0,5 m [Law, 2015].
De studie van McCann et al. heeft in totaal 143 patiënten die met SIRT zijn behandeld geïncludeerd. De onderzoekers concluderen dat alle patiënten werden behandeld met max 5,14 GBq 90Y en bij een maximaal dosistempo van 10 Sv h-1 op 1 m afstand zonder beperkingen ontslagen konden worden. Er is in deze studie gekeken naar de verschillende soorten microsferen maar in alle 143 gevallen werd de grenswaarde van 1 mSv blootstelling van omstanders niet gehaald bij toediening tot 5,14 GBq. Ook valt er geen blootstelling van lichaamsvloeistoffen te verwachten al is dat niet geanalyseerd omdat er geen biologische klaring is [McCann, 2012].
Kim et al. hebben ook metingen bij SIRT-patiënten gedaan en op grond van het gemeten dosistempo op 1 m van de patiënt berekend dat de maximale dosis voor verzorgers niet meer dan 0,2 mSv bedraagt [Kim, 2010].
Gulec et al. hebben een uitgebreide theoretische berekening van de blootstelling van derden door patiënten die een 90Y therapie ondergaan uitgevoerd. Omdat het lichaam alle directe β straling afschermt, werd alleen remstraling beschouwd en is een conservatief model op basis van een puntbron berekening zonder biologische klaring uitgewerkt. In deze theoretische behandeling vonden ze dat bij een toediening van 284 GBq of meer iemand die zich continu op 1 m van de patiënt bevindt een dosis van meer dan 1 mSv kan oplopen. Omdat de werkelijk toegediende klinische doses veel lager liggen dan 284 GBq concludeerden de auteurs dat patiënten zonder maatregelen ontslagen kunnen worden. Specifiek werd ook gekeken naar de dosis voor een pasgeborene, kind en zwangere vrouw en er werd gevonden dat bij een toediening 3 GBq op een afstand van 10 cm een maximale dosis van 0,05 mSv kan worden bereikt. Een uitgebreide theoretische schatting van de blootstelling voor een zuigeling werd ook uitgevoerd waarbij men kwam tot 0,18 mSv [Gulec, 2007].
Maatregelen 90Y ibritumomab tiuxetan (Zevalin)
Zhu et al. benoemen een aantal specifieke ontslagcriteria, waarbij tot 3 dagen na behandeling de urine en lichaamsvloeistoffen opgeruimd dienen te worden en na wc-bezoek basishygiëne wordt aanbevolen. Aangeraden wordt om tot 1 jaar na behandeling niet zwanger te worden en geen borstvoeding te geven [Zhu, 2004].
Wiseman et al. geven aan dat er gegeven de lage niveaus van remstraling in principe geen aanvullende afscherming nodig is. Wel wordt aanbevolen dat ontslagen patiënten gedurende 3 dagen na therapie basishygiëne op de wc hanteren en dat ze het toilet goed schoonhouden [Wiseman, 2001b; Meredith, 2006]. Ook wordt het gebruik van condooms gedurende 1 week na therapie aanbevolen.
Zwangerschap en borstvoeding worden in de Procedure Guidelines van de NVNG aangemerkt als contra-indicaties voor deze therapie [Procedure Guidelines NVNG, 2017].
Maatregelen 90Y-microsferen (SIRT) en 90Y-sulfide
Zwangerschap wordt in de Procedure Guidelines van de NVNG aangemerkt als contra-indicatie voor zowel SIRT als RSV. Borstvoeding wordt in de Procedure Guidelines van de NVNG aangemerkt als contra-indicatie voor RSV [Procedure Guidelines NVNG, 2017].
Fysische eigenschappen
90Y vervalt onder uitzending van β--deeltje naar de stabiele isotoop 90Zr en heeft een fysische halveringstijd van 64.0 uur [ICRP 119, 2012]. De dosisequivalenttempoconstante voor huidbesmetting (hhuidbesmetting(0.07)) is ontleend aan Petoussi [Petoussi, 1993] en bedraagt 1,61 mSv·h-1·kBq-1·cm2. De dosisequivalenttempoconstanten voor fotonbijdrage lichaam (h(10)) en huid (h(0.07)) zijn ontleend aan Otto [Otto, 2016]. Deze bedragen respectievelijk, 0 µSv·h-1·GBq-1 op 1 meter en 0 mSv·h-1·GBq-1 op 10 cm.
De dosisconversiecoëfficiënt voor ingestie van 90Y bedraagt 2,7·10-9 Sv·Bq-1 voor een volwassen lid van de bevolking [ICRP 119, 2012].
De vrijstellingswaarden voor activiteitsconcentratie en totale activiteit bedragen 1 MBq·kg-1 en 0,1 MBq, respectievelijk [Bbs, 2018].
Zoeken en selecteren
Voor het beantwoorden van deze uitgangsvraag heeft de werkgroep gebruik gemaakt van het RIVM-rapport Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. Dosisberekeningen als basisinformatie voor de herziening van maatregelen en leefregels [Kloosterman, 2020].
Daarnaast is er oriënterend literatuuronderzoek verricht in Pubmed, waarbij in april 2020 is gezocht middels 3 zoekopdrachten gericht op biologische modellen, scenario’s en maatregelen met relevante zoektermen in combinatie met 90Y. De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
De literatuurzoekacties leverden 146 resultaten op. Studies zijn geselecteerd op grond van de volgende selectiecriteria:
- betrekking op het juiste radiofarmacon
- betrekking op mensen
- betrekking op het hele lichaam
- betrekking op blootstelling van derden
- betrekking op beperkende maatregelen
- aanwezige samenvatting
- in een bekende taal
- betreft humaan onderzoek
- Monte Carlo simulaties
In eerste instantie zijn voor biologische modellen, scenario’s en maatregelen studies geselecteerd op basis van titel en abstract. Na raadpleging van de volledige tekst zijn hiervan 13 studies geëxcludeerd (zie exclusietabel) en zijn 28 studies definitief geselecteerd. In eerste instantie zijn voor biologische modellen, scenario’s en maatregelen bij 90Y studies voorgeselecteerd op basis van titel en abstract. De overgebleven artikelen zijn doorgelezen voor relevantie. Omdat er relatief weinig artikelen overbleven zijn ook nog op basis van expert opinion additionele studies geïncludeerd.
Uiteindelijk zijn er respectievelijk 14, 5 en 9 studies definitief geselecteerd (zie verdeling in Tabel 1).
Tabel 1: verdeling van artikelen per therapie
|
|
90Y ibritumomab tiuxetan (Zevalin) |
90Y-microsferen (SIRT) |
90Y-sulfide |
|
Biologische modellen |
11 |
1 |
2 |
|
Scenario’s |
1 |
3 |
1 |
|
Maatregelen |
5 |
4 |
0 |
Referenties
- Arico, 2009 Aricò D, Grana CM, Vanazzi A, Ferrari M, Mallia A, Sansovini M, Martinelli G, Paganelli G, Cremonesi M. The role of dosimetry in the high activity 90Y-ibritumomab tiuxetan regimens: two cases of abnormal biodistribution. Cancer Biother Radiopharm. 2009 Apr;24(2):271-5. https://doi.org/10.1089/cbr.2008.0541 PubMed PMID: 19409050.
- Ahmad, 2018 Ahmad I, Nisar H. Dosimetry perspectives in radiation synovectomy. Phys Med. 2018 Mar;47:64-72. https://doi.org/10.1016/j.ejmp.2018.02.015 Epub 2018 Feb 28. Review. PubMed PMID: 29609820.
- Arrichiello, 2012 Arrichiello C, Aloj L, Mormile M, D'Ambrosio L, Frigeri F, Caracò C, Arcamone M, De Martinis F, Pinto A, Lastoria S. Feasibility of bremsstrahlung dosimetry for direct dose estimation in patients undergoing treatment with 90Y-ibritumomab tiuxetan. Eur J Nucl Med Mol Imaging. 2012 Jun;39(6):956-66. https://doi.org/10.1007/s00259-011-2040-5 Epub 2012 Jan 12. PubMed PMID: 22237846.
- Barber, 2016 Barber TW, Cherk MH, Powell A, Yap KS, Billah B, Kalff V. EJNMMI Res. 2016 Dec;6(1):45. https://doi.org/10.1186/s13550-016-0201-z Epub 2016 May 31.
- Bielinska, 2014 Bielińska A, Korkosz M, Gąsowski J, Tomaszuk M, Staszczak-Sowa A, Kwaśny-Krochin B, Buziak-Bereza M, Hubalewska-Dydejczyk A, Grodzicki T. Ann Nucl Med. 2014 Aug;28(7):688-92. doi: 10.1007/s12149-014-0827-8. Epub 2014 Mar 5.
- Chamarty, 2011 Chamarthy MR, Williams SC, Moadel RM. Radioimmunotherapy of Non-Hodgkin’s Lymphoma: From the ‘Magic Bullets’ to ‘Radioactive Magic Bullets’. Yale J Biol Med. 2011; 84(4): 391-407.
- Chiesa, 2007 Chiesa C, Botta F, Di Betta E, Coliva A, Maccauro M, Aliberti G, Bavusi S, Devizzi L, Guidetti A, Seregni E, Gianni AM, Bombardieri E. Dosimetry in myeloablative (90)Y-labeled ibritumomab tiuxetan therapy: possibility of increasing administered activity on the base of biological effective dose evaluation. Preliminary results. Cancer Biother Radiopharm. 2007 Feb;22(1):113-20. PubMed PMID: 17627419.
- Chojnowski, 2016 Chojnowski MM, Felis-Giemza A, Kobylecka M. Radionuclide synovectomy – essentials for rheumatologists. Reumatologia. 2016; 54(3): 108-16.
- Cooney, 2007 Cooney-Qualter E, Krailo M, Angiolillo A, Fawwaz RA, Wiseman G, Harrison L, Kohl V, Adamson PC, Ayello J, vande Ven C, Perkins SL, Cairo MS; Children's Oncology Group. A phase I study of 90yttrium-ibritumomab-tiuxetan in children and adolescents with relapsed/refractory CD20-positive non-Hodgkin's lymphoma: a Children's Oncology Group study. Clin Cancer Res. 2007 Sep 15;13(18 Pt2):5652s-5660s. PubMed PMID: 17875803.
- Cournane, 2019 Cournane S, McCavana J, Manley M, Gray L, McCann J, Lucey J. Yttrium-90 selective internal radiation therapy, examining dose rates and radiation protection precautions. Phys Med. 2019 Sep;65:121-127. https://doi.org/10.1016/j.ejmp.2019.08.011 Epub 2019 Aug 23. PubMed PMID: 31450122.
- Cremonesi, 2006 Cremonesi M, Ferrari M, Paganelli G, Rossi A, Chinol M, Bartolomei M, Prisco G, Tosi G. Radiation protection in radionuclide therapies with (90)Y-conjugates: risks and safety. Eur J Nucl Med Mol Imaging. 2006 Nov;33(11):1321-7. Epub 2006Jul 11. PubMed PMID: 16832636.
- Cremonesi, 2007 Cremonesi M, Ferrari M, Grana CM, Vanazzi A, Stabin M, Bartolomei M, Papi S, Prisco G, Ferrucci PF, Martinelli G, Paganelli G. High-dose radioimmunotherapy with 90Y-ibritumomab tiuxetan: comparative dosimetric study for tailored treatment. J Nucl Med. 2007 Nov;48(11):1871-9. Erratum in: J Nucl Med. 2007 Dec;48(12):2027. PubMed PMID: 17978355.
- Gulec, 2007 Gulec SA, Siegel JA. Posttherapy radiation safety considerations in radiomicrosphere treatment with 90Y-microspheres. J Nucl Med. 2007 Dec;48(12):2080-6. Epub 2007 Nov 15. Review. PubMed PMID: 18006608.
- He, 2009 He B, Wahl RL, Sgouros G, Du Y, Jacene H, Kasecamp WR, Flinn I, Hammes RJ, Bianco J, Kahl B, Frey EC. Comparison of organ residence time estimation methods for radioimmunotherapy dosimetry and treatment planning--patient studies. Med Phys. 2009 May;36(5):1595-601. PubMed PMID: 19544775; PubMed Central PMCID: PMC2851232.
- Hendrix, 2004 Radiation safety guidelines for radioimmunotherapy with yttrium 90 ibritumomab tiuxetan. Hendrix C.Clin J Oncol Nurs. 2004 Feb;8(1):31-4. Review. PMID: 14983760
- ICRP 119, 2012 ICRP Publication 119. Compendium of Dose Coefficients based on ICRP Publication 60. Ann ICRP 2012;41 suppl 1:1-130. https://doi.org/10.1016/j.icrp.2012.06.038
- ICRP 94, 2004 International Commission on Radiological Protection. Release of patients after therapy with unsealed radionuclides. Ann ICRP. 2004;34(2):v-vi, 1-79. Erratum in: Ann ICRP. 2004;34(3-4):281. Ann ICRP. 2006;36(4):77. Ann ICRP. 2013 Aug;42(4):341. PubMed PMID: 15571759.
- Kalef, 2005 Kalef-Ezra J, Bozios G, Tsekeris P, Michalis L. Patient and personnel dosimetry in endovascular radiotherapy with 90Sr/90Y sources. Radiat Prot Dosimetry. 2005;114(4):514-23. Epub 2005 Jun 7. PubMed PMID: 15941815.
- Kim, 2010 Kim YC, Kim YH, Uhm SH, Seo YS, Park EK, Oh SY, Jeong E, Lee S, Choe JG. Radiation safety issues in y-90 microsphere selective hepatic radioembolization therapy: possible radiation exposure from the patients. Nucl Med Mol Imaging. 2010 Dec;44(4):252-60. https://doi.org/10.1007/s13139-010-0047-7 Epub 2010 Aug 25. PubMed PMID: 24899961; PubMed Central PMCID: PMC4042917.
- Kloosterman, 2020 Kloosterman A, van Dijk A, Boudewijns-Schoonderbeek L, et al. Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. RIVM-briefrapport 2020-0113.
- Lambert, 2011 Lambert B, Mertens J, Ravier M, et al. Urinary excretion of Yttrium-90 following intra-arterial microsphere treatment for liver tumours. sJournal of Nuclear Medicine May 2011, 52 (supplement 1) 1744;
- Law, 2009 Law M, Liu R, Ng S, Luk MY, Leung TW, Au GK. Radiation dose measurements for personnel performing 90Y-ibritumomab tiuxetan administration: a comparison between two injection methods for dose reduction. Br J Radiol. 2009 Jun;82(978):491-6. https://doi.org/10.1259/bjr/53303087. Epub 2009 Feb 2. PubMed PMID: 19188242.
- Law, 2016 Law M, Wong KK, Tso WK, Lee V, Luk MY, Tong CC, Chu F. PeRSVnnel dose reduction in (90)Y microspheres liver-directed radioembolization: from interventional radiology suite to patient ward. Br J Radiol. 2017 Mar;90(1071):20160591. https://doi.org/10.1259/bjr.20160591 Epub 2016 Dec 20. PubMed PMID: 27993095; PubMed Central PMCID: PMC5601515.
- Lee, 2016 Lee EW, et al. Yttrium-90 Selective Internal Radiation Therapy with Glass Microspheres for Hepatocellular Carcinoma: Current and Updated Literature Review. Korean J Radiol. 2016; 17(4): 472-88.
- Leonard, 2003 Leonard JP, Siegel JA, Goldsmith SJ. Comparative physical and pharmacologic characteristics of iodine-131 and yttrium-90: implications for radioimmunotherapy for patients with non-Hodgkin's lymphoma. Cancer Invest. 2003 Apr;21(2):241-52. Review. PubMed PMID: 12743990.
- McCann, 2012 McCann JW, Larkin AM, Martino LJ, Eschelman DJ, Gonsalves CF, Brown DB. Radiation emission from patients treated with selective hepatic radioembolization using yttrium-90 microspheres: are contact restrictions necessary? J Vasc Interv Radiol. 2012 May;23(5):661-7. https://doi.org/10.1016/j.jvir.2012.01.070 Epub 2012 Mar 21. PubMed PMID: 22440592.
- Meo, 2008 Meo SL, Cicoria G, Montini G, Bergamini C, Campanella F, Pancaldi D, Panebianco AS, Rubello D, Marengo M. Radiation emission dose from patients administered 90Y-labelled radiopharmaceuticals: comparison of experimental measurements versus Monte Carlo simulation. Nucl Med Commun. 2008 Dec;29(12):1100-5. https://doi.org/10.1097/MNM.0b013e328314b895. PubMed PMID: 18987532.
- Meredith, 2006 Meredith RF. Logistics of therapy with the ibritumomab tiuxetan regimen. Int J Radiat Oncol Biol Phys. 2006;66(2 Suppl):S35-8. Review. PubMed PMID: 16979437.
- Nelson, 2008 Nelson K, Vause PE Jr, Koropova P. Post-mortem considerations of Yttrium-90. 90Y microsphere therapy procedures. Health Phys. 2008 Nov;95(5 Suppl):S156-61. doi: 10.1097/01.HP.0000318887.65414.15. PubMed PMID: 18849708.
- Pigree, 2019 Pigrée G, Césini J, Cruet-Hennequart S, Peyronnet D, Vigne J, Marcelli C, Agostini D, Barbey P. Eur J Nucl Med Mol Imaging. 2019 Jul;46(8):1591-1593. https://doi.org/10.1007/s00259-019-04335-2. Epub 2019 May 8. No abstract available. PMID: 31069455
- Procedure Guidelines NVNG, 2017 Procedure Guidelines Nuclear Medicine. NVNG. Kloosterhof, 2017. ISBN: 978-90-78876-09-0
- Rizvi, 2012 Rizvi et al. Biodistribution, radiation dosimetry and scouting of 90Y-ibritumomab tiuxetan therapy in patients with relapsed B-cell non-Hodgkin’s lymphoma using 89Zr-ibritumomab tiuxetan and PET. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3276758/
- Shen, 2010 Shen S, Forero A, Meredith RF, Shah JJ, Knox SJ, Wiseman GA, Usrey ME, Lobuglio AF. Impact of rituximab treatment on (90)Y-ibritumomab dosimetry for patients with non-Hodgkin lymphoma. J Nucl Med. 2010 Jan;51(1):150-7. https://doi.org/10.2967/jnumed.109.066597 Epub 2009 Dec 15. PubMed PMID: 20008989.
- Shultis, 2000 Shultis JK, Faw RE. Radiation Shielding. American Nuclear Society 2000.
- Siegersma, 2019 Siegersma D, et al. Potentiële stralingsbelasting na het overlijden van patiënten behandeld met radioactieve stoffen. RIVM Briefrapport 2019-0165.
- Silverman, 2004 Silverman DH, Delpassand ES, Torabi F, Goy A, McLaughlin P, Murray JL. Radiolabeled antibody therapy in non-Hodgkins lymphoma: radiation protection,isotope comparisons and quality of life issues. Cancer Treat Rev. 2004 Apr;30(2):165-72. Review. PubMed PMID: 15023434.
- Song, 2015 Song YS, Paeng JC, Kim HC, Chung JW, Cheon GJ, Chung JK, Lee DS, Kang KW. PET/CT-Based Dosimetry in 90Y-Microsphere Selective Internal Radiation Therapy: Single Cohort Comparison With Pretreatment Planning on (99m)Tc-MAA Imaging and Correlation With Treatment Efficacy. Medicine (Baltimore). 2015 Jun;94(23):e945. https://doi.org/10.1097/MD.0000000000000945 PubMed PMID: 26061323; PubMed Central PMCID: PMC4616469.
- Spooren, 1985 Spooren PF, Rasker JJ, Arens RP. Synovectomy of the knee with 90Y. Eur J Nucl Med. 1985;10(9-10):441-5. https://doi.org/10.1007/BF00256587.
- Tenvall, 2007 Tennvall J, Fischer M, Bischof Delaloye A, Bombardieri E, Bodei L, Giammarile F, Lassmann M, Oyen W, Brans B; Therapy Committee, EANM; Oncology Committee, EANM; Dosimetry Committee, EANM. EANM procedure guideline for radio-immunotherapy for B-cell lymphoma with 90Y-radiolabelled ibritumomab tiuxetan (Zevalin). Eur J Nucl Med Mol Imaging. 2007 Apr;34(4):616-22. PubMed PMID: 17323056.
- Weigert, 2006 Recommendations for the use of yttrium-90 ibritumomab tiuxetan in malignant lymphoma. Weigert O, Illidge T, Hiddemann W, Dreyling M. Cancer. 2006 Aug 15;107(4):686-95.PMID: 16826593
- Wiseman, 2000 Wiseman GA, White CA, Stabin M, Dunn WL, Erwin W, Dahlbom M, Raubitschek A, Karvelis K, Schultheiss T, Witzig TE, Belanger R, Spies S, Silverman DH, Berlfein JR, Ding E, Grillo-López AJ. Phase I/II 90Y-Zevalin (yttrium-90 ibritumomabtiuxetan, IDEC-Y2B8) radioimmunotherapy dosimetry results in relapsed or refractory non-Hodgkin's lymphoma. Eur J Nucl Med. 2000 Jul;27(7):766-77. PubMed PMID: 10952488.
- Wiseman, 2001 Wiseman GA, White CA, Sparks RB, Erwin WD, Podoloff DA, Lamonica D, Bartlett NL, Parker JA, Dunn WL, Spies SM, Belanger R, Witzig TE, Leigh BR. Biodistribution and dosimetry results from a phase III prospectively randomized controlled trial of Zevalin radioimmunotherapy for low-grade, follicular, or transformed B-cell non-Hodgkin's lymphoma. Crit Rev Oncol Hematol. 2001 Jul-Aug;39(1-2):181-94. PubMed PMID: 11418315.
- Wiseman, 2001b Wiseman G, Leigh B, Witzig T,et al.Radiation exposureis very low to the family members of patients treated withyttrium-90 Zevalin anti-CD20 monoclonal antibody ther-apy for lymphoma Abstract.Eur J Nucl Med2001;28:1198.
- Wiseman, 2002 Wiseman GA, Leigh B, Erwin WD, Lamonica D, Kornmehl E, Spies SM, Silverman DH, Witzig TE, Sparks RB, White CA. Radiation dosimetry results for Zevalin radioimmunotherapy of rituximab-refractory non-Hodgkin lymphoma. Cancer. 2002 Feb 15;94(4 Suppl):1349-57. PubMed PMID: 11877765.
- Wiseman, 2003 Wiseman GA, Leigh BR, Erwin WD, Sparks RB, Podoloff DA, Schilder RJ, Bartlett NL, Spies SM, Grillo-López AJ, Witzig TE, White CA. Radiation dosimetry results from a Phase II trial of ibritumomab tiuxetan (Zevalin) radioimmunotherapy for patients with non-Hodgkin's lymphoma and mild thrombocytopenia. Cancer Biother Radiopharm. 2003 Apr;18(2):165-78. PubMed PMID: 12804042.
- Wiseman, 2003b Wiseman GA, Kornmehl E, Leigh B, Erwin WD, Podoloff DA, Spies S, Sparks RB, Stabin MG, Witzig T, White CA. Radiation dosimetry results and safety correlations from 90Y-ibritumomab tiuxetan radioimmunotherapy for relapsed or refractory non-Hodgkin's lymphoma: combined data from 4 clinical trials. J Nucl Med. 2003 Mar;44(3):465-74. PubMed PMID: 12621016.
- Zanzonico, 1999 Zanzonico PB, Binkert BL, Goldsmith SJ. Bremsstrahlung radiation exposure from pure beta ray emitters, J Nuc Med 1999, 40:1024-1028.
- Zhu, 2003 Zhu X. Radiation safety considerations with therapeutic 90Y Zevalin. Health Phys. 2003 Aug;85(2 Suppl):S31-5. PubMed PMID: 12865747.
- Zhu, 2004 Zhu X. Radiation safety considerations with yttrium 90 ibritumomab tiuxetan (Zevalin). Semin Nucl Med. 2004 Jan;34(1 Suppl 1):20-3. Review. PubMed PMID: 14762741.
Evidence tabellen
90Y ibritumomab tiuxetan (Zevalin)
|
Biological models |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Leonard, 2003 |
Observat |
|
|
|
|
B2 |
|
Arichiello, 2012 |
Observat |
Histologically proven CD2-=positive G1/G2 follicular cell lymphoma > 18 years |
WB images and blood samples |
16 pt with 111In and then 90Y; other pt only 90Y administration |
29 |
B2 |
|
Shen, 2010 |
Observat |
Histologically confirmed, follicular, or transformed CD20-positive B-cell non-Hodgkin’s lymphoma. |
Whole-blood samples at 0.5, 4, 24, 72 and 144 p.i. 111In-ibritumomab. |
90Y doses based on 111In dosimetry |
17 |
B2 |
|
Arico, 2009 |
Observat |
2 women, 57 and 69 yo, with histologically confirmed resistant/refractory CD20-positive B-cell non-Hodgkin’s lymphoma |
WB anterior and posterior views acquired at 1, 16, 24, 48h and 4 and 6 days p.i. + blood samples |
56 MBq/kg 90Y |
2 |
B2 |
|
Cremonesi, 2007 |
Observat |
Histologically confirmed refractory or transformed CD20-positive B-cell non-Hodgkin’s lymphoma, 17 men, 5 female |
Blood samples at various time points. |
4 pt received 29.6 MBq/kg; others 44.4 or 55.5 MBq/kg. |
22 |
B2 |
|
Wiseman, 2000 |
Observat |
Histologically confirmed, relapsed or refractory low-grade or follicular B-cell non-Hodgkin’s lymphoma. |
Quantitative imaging and blood sampling |
90Y dose based on weight (7.4, 11 or 15 MBq/kg) |
57 |
B2 |
|
Wiseman, 2001 |
Observat |
Histologically confirmed, relapsed or refractory low-grade, follicular, or transformed CD20-positive B-cell non-Hodgkin’s lymphoma |
Urine output collected from 10 pt |
15 MBq/kg 90Y-Zevalin up to a dose of 1.2 GBq |
143 |
B2 |
|
Wiseman, 2002 |
Observat |
Histologically confirmed follicular non-Hodgkin’s lymphoma |
111In-dosimetry extrapolated to 90Y dose |
15 MBq/kg 90Y-Zevalin up to a dose of 1.2 GBq |
27 |
B2 |
|
Wiseman, 2003 |
Observat |
Histologically confirmed, relapsed or refractory, low-grade, follicular, or CD20+ transformed B-cell non-Hodgkin’s lymphoma |
WB camera imaging |
Rituximab followed by 90Y ibritumomab tiuxetan, 11 MBq/kg |
30 |
B2 |
|
Wiseman, 2003b |
Observat |
4 clinical trials, non-Hodgkin lymphoma; <25% bone marrow involvement by NHL, no prior myeloablative therapy, no prior radioimmunotherapy |
Quantitative WB-imaging and blood sampling at various time points |
7.4 - 15 MBq/kg 90Y administered |
179 |
B2 |
|
Rizvi, 2012 |
Observat |
Relapsed or refractory aggressive B-cell (CD20-positive) non-Hodgkin’s lymphoma younger than 66 |
89Zr-ibritumomab tiuxetan followed by 3 PET scans at 1, 72 and 144 p.i., blood sampling; urine collection |
15 or 30 MBq/kg 90Y-ibritumomab tiuxetan. |
7 |
B2 |
|
Scenarios |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Meo, 2008 |
Observat |
B-cell non-Hodgkin’s lymphoma |
Ionization chamber detector and crystal NaI(Tl) detector at 1 m from patient |
1015 ± 156 MBq 90Y-Zevalin |
8 |
B2 |
|
Wiseman, 2001b |
Observat |
|
|
|
|
|
|
Counter measures |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Zhu, 2004 |
Overview |
- |
- |
- |
- |
- |
|
Cremonesi, 2006 |
Observat |
non-Hodgkin’s lymphoma |
Various instruments |
- |
15 |
- |
90Y-microsferen (SIRT)
|
Biological models |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Song, 2015 |
Observat |
Hepatocellular carcinoma, cholangio-carcinoma, metastatic liver mass from other cancers. |
99mTc-MAA dose planning, PET/CT directly after administration of microspheres |
LSF <10% in 19 pt, 10-15% in 4 pt. 2.3 ± 1.2 (0.3 – 3.9) GBq 90Y |
23 |
B2 |
|
Scenarios |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
McCann, 2012 |
Observat |
SIRT-patients |
Dose rate measurement at 2 distances with a survey meter at 10 and 30 cm from patient |
124 resin microspheres, 19 glass microspheres |
86 |
B2 |
|
Kim, 2010 |
Observat |
Unresectable hepatocellular carcinoma, mean age 66.6 years |
Ambient exposure rate at 1 m from the patient during 0-3, 4-12, 13-24 and 25-72 h |
1.2 GBq on average |
18 |
B2 |
|
Gulec, 2007 |
Overview |
- |
- |
- |
- |
- |
|
Counter measures |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Cournane, 2019 |
|
SIRT-patients |
Dose rate measurement at 0.3 and 1 meter. |
2.9 ± 3.1 (0.62 – 7.2) GBq administered. |
30 |
B2 |
|
McCann, 2012 |
Observat |
SIRT-patients |
Dose rate measurement at 2 distances with a survey meter at 10 and 30 cm from patient |
124 resin microspheres, 19 glass microspheres |
86 |
B2 |
|
Gulec, 2007 |
Overview |
- |
- |
- |
- |
- |
|
Law, 2016 |
Observat |
Hepatocellular carcinoma, 16 males 64 ± 9 y/o; 2 females 44 and 83 years |
Dose rate at chest and hand position of interventional radiologist. |
2.54 ± 0.87 (1.65 – 4.75) GBq administered |
18 |
B2 |
90Y-sulfide
|
Biological models |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Barber, 2016 |
Observat |
Haemophilia, seronegative arthritis, rheumatoid arthritis or other causes of arthropathy. |
Brehmsstrahlung planar imaging for 2 min between 4 and 24h p.i. |
185-222 MBq 90Y-colloid administered |
41 (51 joints) |
B2 |
|
Pigree, 2019 |
Observat |
30 y/o female patient with a recurrence of villonodular synovitis of knee |
Breast milk collected 12h after administration and follow-up for 26 days, scintillation counter |
185 MBq injected |
1 |
B2 |
|
Spooren, 1985 |
Observat |
Chronic persistent arthritis. |
Geiger counter measurements |
5 mCi injected in joint |
33 |
|
|
Scenarios |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Ahmad, 2008 |
Overview |
- |
- |
- |
- |
- |
|
Counter measures |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
Exclusietabellen
90Y ibritumomab tiuxetan (Zevalin)
Biological models
|
|
|
Reason for exclusion |
|
1 |
Delaloye, 2003 |
Review based on the results of Wiseman et al. |
|
2 |
He, 2009 |
Study focusing on treatment planning. |
|
3 |
Cooney, 2007 |
Phase 1 study focusing on pediatric oncology |
|
4 |
Chiesa, 2007 |
Study focusing on internal dosimetry to determine toxicity threshold. |
|
5 |
Tenvall, 2007 |
Guideline based on the results of Wiseman et al. |
Scenarios
|
|
|
Reason for exclusion |
|
1 |
Weigert, 2006 |
review that focuses on current recommendations for use in patients, no exposure pathways. |
|
2 |
Law, 2009 |
Study reporting only dose to the extremities for personnel performing administration. |
|
3 |
Kalef, 2005 |
Does not apply to Zevaling, SIRT or RSV |
|
4 |
ICRP 94, 2004 |
Contains no specific information for Y90 exposure pathways |
|
5 |
Zhu, 2003 |
Focus on counter measures rather than exposure pathways. |
|
6 |
Hendrix, 2004 |
A general introduction to Zevalin therapy that contains no specific exposure pathway information. |
|
7 |
Meredith, 2006 |
Based on Wiseman et al. |
Counter measures
|
|
|
Reason for exclusion |
|
1 |
Silverman, 2004 |
Contains no counter measures |
90Y-microsferen (SIRT)
Scenarios
|
|
|
Reason for exclusion |
|
1 |
Nelson, 2008 |
Does not discuss exposure pathways. |
90Y-sulfide
Biological models
|
|
|
Reason for exclusion |
|
1 |
Bielinska, 2014 |
This study does not report extra-articular activity |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 20-04-2021
Laatst geautoriseerd : 20-04-2021
Geplande herbeoordeling : 01-01-2027
Deze module is opgesteld door de werkgroep herziening aanbevelingen ‘het werken met therapeutische doses radionucliden’, bestaande uit afgevaardigden vanuit de NVNG, NVKF, NVS en ANVS. Er is nauw contact onderhouden met het RIVM, dat gelijktijdig het rapport [Kloosterman, 2020] schreef.
De werkgroep beveelt aan in 2026 de inhoud van deze module te beoordelen, en te overwegen of revisie of herziening gewenst is.
Doel en doelgroep
Doel
In 2005 werden de Aanbevelingen ‘Het werken met therapeutische doses radionucliden’ gepubliceerd. Deze aanbevelingen waren bedoeld als leidraad voor degenen die in de medische praktijk betrokken waren bij het werken met therapeutische doses radionucliden (met name bij 131I-therapieën). Het vormde onder andere de basis voor de normen voor ontslag van de patiënt en de leefregels die na ontslag aan de patiënt werden meegegeven met als doel de blootstelling van verzorgers en andere personen in de naaste omgeving van ontslagen patiënten zoveel als redelijkerwijs mogelijk te beperken. Heden ten dage is niet alleen het aantal behandelingen met radioactieve stoffen toegenomen maar worden naast 131I diverse andere radionucliden, zoals bijvoorbeeld 177Lu, veelvuldig voor therapie ingezet. Om ook voor de nieuwe therapieën goed onderbouwde ontslagnormen en leefregels te kunnen opstellen, heeft een werkgroep bestaande uit vertegenwoordigers van de Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG), de Nederlandse Vereniging voor Klinische Fysica (NVKF) en Nederlandse Vereniging voor Stralingshygiëne (NVS) in nauwe samenwerking met vertegenwoordigers van de Autoriteit Nucleaire Veiligheid en Stralingsbescherming (ANVS) de aanbevelingen herzien.
Doelgroep
De richtlijn is bedoeld voor (medisch) specialisten uit de radiofarmacie, klinische fysica, nucleaire geneeskunde en radiochemie. Daarnaast is de richtlijn ook relevant voor verwijzers, i.e. internisten, oncologen, urologen, longartsen. Gegeven de expliciete positie van de ‘Aanbevelingen’ in de Kernenergiewet vergunning is deze richtlijn ook relevant voor de overheid en stralingsbeschermingsdeskundigen in medische centra.
Samenstelling werkgroep
Richtlijnwerkgroep
- ir. S. Rijnsdorp (voorzitter) NVKF
- Dr. D. Dieckens NVNG
- Dr. B. Godthelp ANVS
- Dr. T. van der Goot NVKF
- Ing. D.W. Rook NVS
- Drs. N.C .Veltman NVNG
Belangenverklaringen
Er zijn geen conflicterende belangen gemeld. De volledig ingevulde belangenverklaringen zijn op te vragen bij het secretriaat van de Nederlandse vereniging nucleaire geneeskunde.
Inbreng patiëntenperspectief
Gezien de zeer specialistische en technische aard van de uitgangsvragen is het perspectief van de patiënt op de aanbevelingen niet van toepassing.
Methode ontwikkeling
Evidence based
Werkwijze
Bronnen
Voor medici die deze richtlijn lezen is het goed om stil te staan bij de verschillen tussen het domein waar deze richtlijn betrekking op heeft, blootstelling aan ioniserende straling van personen in de omgeving van de patiënt buiten het ziekenhuis, ten opzichte van het gebruikelijke klinisch domein van een medisch specialistische richtlijn. Dit verschil betekent dat de literatuur en de kennis die over stralingsblootstellingen en eventuele maatregelen te vinden is verschillen kent ten opzichte van de klinisch wetenschappelijke literatuur. Waar de klinisch wetenschappelijke literatuur vooral leunt op klinische trials gericht op de vergelijking tussen interventie en reguliere zorg is die opzet niet haalbaar in het domein van de stralingsblootstellingen op grond van medisch ethische bezwaren bij een dergelijke onderzoeksopzet met blootstelling aan ioniserende straling als interventie en het meten van de schadelijke effecten daarvan als uitkomstmaat. Voor klinische studies met patiënten waarbij de stralingsblootstelling een therapeutisch effect beoogt zijn wel klinische trials beschikbaar, maar daarmee begeeft de studie zich weer in het klinisch domein en bovendien gelden ook dan aanvullende aanbevelingen ten aanzien van de stralingsblootstelling van vrijwilligers ten opzichte van reguliere klinische therapeutische verrichtingen [Radiation Protection 97, 1998]. Deze richtlijn richt zich niet op aanbevelingen ten aanzien van de klinische toepassing van therapeutische radiofarmaca. Om die reden zal niet gezocht worden naar fase 3 klinische trials als meest richting gevende referentie, aangezien die alleen bestaan voor studies naar de therapeutische effectiviteit. Dat aspect van stralingsblootstellingen wordt gedekt door de betreffende klinische richtlijnen rondom een ziektebeeld waar het gebruik van therapeutische radiofarmaca hun toepassing hebben. Deze richtlijn richt zich op de veiligheid van de toepassing van radiofarmaca voor verzorgers en leden van de bevolking. Voor de omgeving dient de patiënt beschouwd te worden als een stralingsbron met een continu veranderende activiteit door fysisch verval, het biologisch gedrag van het radiofarmacon in de patiënt en uitscheiding. De relevante literatuur om die informatie beschikbaar te krijgen gaat over biodistributie, farmacokinetiek en farmacodynamiek. Dit betreft de fase 1 en 2 studies voor een radiofarmacon. Aangezien het biologisch gedrag gerelateerd is aan de chemische eigenschappen van een stof geldt dat dit biologisch gedrag niet specifiek voor radioactieve isotopen geldt, maar ook voor de stabiele natuurlijke isotopen van een zelfde stof. Een deel van de vereiste informatie bevindt zich dus buiten het klinisch domein. Vanwege bovenstaande is de gebruikelijke classificatietabel voor het graderen van de bewijskracht van gevonden literatuur uit de EBRO of GRADE methodologie niet toepasbaar. Wel is een alternatieve weging van bronnen gebruikt zoals hierna beschreven om in de geest van EBRO te blijven werken.
In belangrijke mate is de informatie waarmee bepaald kan worden wat de blootstelling van de omgeving is, gebaseerd op fysische eigenschappen van ioniserende straling, radioactieve stoffen en afscherming. Voor de afscherming die wordt veroorzaakt door het lichaam van de patiënt is in de berekeningen gekozen om als benadering van de werkelijkheid het menselijk lichaam opgebouwd te zien uit een laag water. De bedoelde grootheden zijn grotendeels bekende waarden waarvoor het toepassen van een graderingsschaal niet zinvol is. De beschrijving van de toegepaste zoektermen en de documentatie over inclusie en exclusie van literatuur inclusief het onderliggend argument zijn wel uitgevoerd.
De literatuursearches zijn uitgevoerd in Pubmed omdat via deze database, zowel geneeskundige literatuur als ook de fysische, biologische en biofysische literatuur beschikbaar is. Daarnaast is rekening gehouden met de kaders en normen van de wetgeving, meer specifiek de Kernenergiewet [KEW, 1963] en het Besluit basisveiligheidsnormen stralingsbescherming [Bbs, 2018]. Dit besluit is een uitwerking van de Europese Richtlijn 2013/59/Euratom van 5 december 2013 [Euratom, 2013]. In deze Europese Richtlijn staat de volgende overweging:
“(27) De besmetting van het milieu kan een bedreiging voor de menselijke gezondheid vormen. In de secundaire wetgeving van de Gemeenschap is die besmetting tot nog toe alleen beschouwd als blootstellingsroute voor de leden van de bevolking die rechtstreeks getroffen zijn door de lozing van radioactieve afvalstoffen in het milieu. Aangezien de staat waarin het milieu zich bevindt de menselijke gezondheid op de lange termijn kan beïnvloeden, is beleid vereist dat het milieu beschermt tegen de schadelijke gevolgen van ioniserende straling. Ten behoeve van de bescherming van de menselijke gezondheid op de lange termijn dient rekening te worden gehouden met milieucriteria die zijn gebaseerd op internationaal erkende wetenschappelijke gegevens (zoals gepubliceerd door de EC, de ICRP, de Wetenschappelijke Commissie van de Verenigde Naties inzake de gevolgen van atoomstraling, de Internationale Organisatie voor Atoomenergie (IAEA)).”
Ten aanzien van de blootstelling van het milieu waarnaar gerefereerd wordt zijn er in deze richtlijn geen specifieke berekeningen en aanbevelingen gedaan ten aanzien van het beschermen van het milieu voor blootstelling aan ioniserende straling. De reden daartoe is dat met het naleven van leefregels ter reductie van de blootstelling van derden vanzelf aan de huidige normering voor het milieu wordt voldaan. Als er naar bijvoorbeeld één behandeling met 177Lu-PSMA wordt gekeken, wordt er bij lozing van 100% van de toegediende activiteit niet meer dan 0,05 Reing geloosd door de patiënt thuis. Dit betekent dat dit zonder vergunning geloosd mag worden. Trends zullen wel in de gaten gehouden moeten worden, maar op dit moment is er geen toegevoegde waarde voor aparte aanbevelingen ten aanzien van het milieu.
In de overige paragrafen van de Europese Richtlijn worden de specifieke publicaties van bovenstaande organisaties, bron van de bedoelde “internationaal erkende wetenschappelijke gegevens”, meerdere malen aangehaald. De richtlijnwerkgroep heeft daarom deze passage geïnterpreteerd als generieke verwijzing naar de huidige (en mogelijk toekomstige) publicaties door genoemde organisaties die betrekking hebben op stralingsblootstelling van leden van de bevolking. Daarmee geeft de Europese Raad dus aan dat regelgeving binnen de lidstaten gebaseerd dient te zijn op de wetenschappelijke gegevens die geleverd worden via deze organisaties, waarbij 2013/59/Euratom zelf deze gegevens al (grotendeels) samengebracht heeft in een format voor implementatie tot wetgeving binnen de EU lidstaten. De relatie tussen Euratom en het IAEA is dat de aanbevelingen (Safety Standards) van het IAEA als basis gelden voor mogelijke wetgeving en daarom zullen worden geïmplementeerd via Euratom richtlijnen. IAEA baseert haar Safety Standards weer primair op de ICRP publicaties.
Om deze redenen zijn de dosisnormen, voor zover vermeld in deze publicaties, overgenomen in volgorde van meest directe relatie met geldende Nederlandse wetgeving: 1) KEW en Besluit basisveiligheidsnormen stralingsbescherming 2) Euratom 3) IAEA, en 4) ICRP. Voor de fysische en biologische eigenschappen zijn zoekopdrachten in Pubmed uitgevoerd. Vooral voor het vinden van gegevens over biologisch gedrag en maatregelen ter bescherming tegen straling zijn deze zoekopdrachten relevant, aangezien die maar beperkt of niet beschreven zijn in bovenstaande publicaties. Ook zijn er zoekopdrachten uitgevoerd voor de wel beschreven eigenschappen, maar dan beperkt tot de periode na de zoekdatum van de betreffende publicaties om te verifiëren dat er niet al nieuwe inzichten zijn ontstaan.
Bij het beoordelen van de kwaliteit van de literatuur die is gevonden middels zoekopdrachten in Pubmed, is onderscheid gemaakt tussen hoge kwaliteit en lage kwaliteit van het uitgevoerde onderzoek. Kenmerken die iets classificeren als hoge of lage kwaliteit zijn terug te zien in Tabel 1, waarbij voldoen aan ≥ 2 kenmerken beschouwd wordt als hoge kwaliteit.
Tabel 1: beoordelingscriteria voor de kwaliteit van gevonden literatuur
|
Kenmerk |
Hoge kwaliteit |
Lage kwaliteit |
|
onderwerp |
mensen |
dieren |
|
opzet |
experimenteel |
observationeel |
|
methode |
reproduceerbaar |
niet reproduceerbaar |
Omdat wet- en regelgeving vóór eigen wetenschappelijk inzicht van de professional in de stralingsbescherming gaat, is onderstaande volgordelijkheid aangehouden op basis van autoriteit van de gevonden gegevens met van boven naar beneden hogere waarde naar mindere waarde. De gradering van de gebruikte bronnen en daarmee de bewijskracht is conform Tabel 2. Hierbij geldt niet zozeer wetenschappelijke maar meer juridische bewijskracht.
Tabel 2: gradatie in kwaliteit van geïncludeerde bronnen
|
Bbs/KEW |
A1 |
|
Richtlijn 2013/59/Euratom |
A2 |
|
IAEA |
A3 |
|
ICRP |
A4 |
|
Pubmed hoge kwaliteit |
B1 |
|
Pubmed lage kwaliteit |
B2 |
Vragen voor zoekopdrachten
De aanbevelingen in deze richtlijn dienen gebaseerd te zijn op het mortaliteitsrisico en/of morbiditeitsrisico per toepassing van een radiofarmacon per scenario voor leden van de bevolking (anderen dan de patiënt zelf en de betrokken zorgprofessionals). Deze getallen zijn bekend voor de stralingsblootstelling uitgedrukt in Sv [ICRP 103, 2007]. Extra aandacht verdient de beoordeling van deze waarden tussen verschillende leeftijdsgroepen. Voor het bepalen van de blootstelling zijn gegevens nodig over:
A. de samenstelling van een radiofarmacon, inclusief contaminatie met moeder/dochter/zuster-isotopen
B. de hoeveelheid activiteit in de patiënt in de loop van de tijd I) voor de activiteit in de loop van de tijd hebben we het biologisch model van een radiofarmacon in de patiënt nodig (inclusief de contaminatie isotopen). II) de fysische halveringstijden
C. de afscherming van de straling door het lichaam van de patiënt
D. de afstanden tot de activiteit
E. tijdstip van blootstelling t.o.v. tijdstip van toediening en blootstellingsduur
F. omgevingsdosisequivalenttempoconstanten per radionuclide.
G. dosisconversieconstanten voor ingestie per radionuclide
Voor onderdelen D en E dienen de relevante scenario’s (zie hieronder) bekend te zijn.
De literatuurstudie beoogt bovenstaande gegevens boven tafel te krijgen. Gedeeltelijk is dat opzoeken van bekende fysische eigenschappen (fysische halveringstijden, massieke verzwakkingscoëfficiënten van water, omgevingsdosisequivalenttempoconstanten), te halen uit het scenario (tijdstip van blootstelling t.o.v. tijdstip van toediening, blootstellingsduur, afstanden tot de activiteit) en literatuurzoekopdrachten in de eerder beschreven bronnen (biologische modellen). De scenario’s zijn ontleend aan de RIVM-publicatie ‘Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden’ [Kloosterman, 2020], waarbij deze scenario’s zijn gebaseerd op SCP-studie ‘Alle ballen in de lucht: Tijdsbesteding in Nederland en de samenhang met kwaliteit van leven’ [Roeters, 2018].
Ook de inventarisatie van maatregelen waarmee de blootstelling kan worden verlaagd, is iets wat gebaat kan zijn bij een literatuurzoekopdracht. Deze maatregelen zijn niet radiofarmaconspecifiek. Aspecten die daarin dienen te worden meegenomen zijn maatregelen die zich richten op:
- klaring via verschillende uitscheidingsroutes
- inname via ingestie/inhalatie door derden
- afscherming voor gamma-/beta-/alfa-straling
- afstand tot de patiënt
De vragen voor de literatuurzoekopdrachten zullen per radiofarmacon worden uitgevoerd en zijn gericht op onderstaande 3 onderdelen:
- biologische model
- scenario’s
- stralingsbeschermingsmaatregelen
Berekeningen
Voor de te verrichten berekeningen conform de rekenmethode [Kloosterman, 2020] zijn fysische en dosimetrische parameters nodig die in de meeste gevallen tabulair gepubliceerd zijn. Primaire bron hierbij zijn de IAEA- en ICRP-publicaties. Bij het zoeken naar de vereiste waarden voor de benodigde rekenvariabelen bleek dat deze niet altijd terug te vinden waren voor alle in deze richtlijn behandelde radiofarmaca. Om die reden zijn ook andere bronnen gebruikt om de dataset compleet te krijgen. Hetzelfde gold voor de afschermingseigenschappen voor het materiaal water voor de verschillende fotonenergieën. Deze bronnen werden verkregen doordat ze al bekend waren bij een of meer van de leden van de werkgroep, op basis van opzoeken van de data safety sheets van radiofarmaca door fabrikanten en door generieke online searches middels Google.
Reeds bekend bij de leden of gevonden via bovenstaande methode zijn de volgende bronnen:
- Atomic and Nuclear Data from the French Laboratoire National Henri Becquerel (http://www.lnhb.fr/nuclear-data/nuclear-data-table)
- The RadPro Calculator (http://www.radprocalculator.com/Gamma.aspx)
- National Institute of Standards and Technology U.S. Department of Commerce (https://physics.nist.gov/PhysRefData/XrayMassCoef/ComTab/water.html)
- Radiological Protection Ordinance of 22 june 1994 from the Swiss Federal Council (https://www.admin.ch/opc/en/classified-compilation/19940157/201401010000/814.501.pdf)
- Dose distributions in the ICRU sphere for monoenergetic photons and electrons and for ca. 800 radionuclide. Petoussi N, Zankl M, Fehrenbacher G, Drexler G. Institut für Strahlenschutz. GSF-Bericht 7/93 (https://push-zb.helmholtz-muenchen.de/deliver.php?id=10991)
- Personal Dose-equivalent conversion coefficients for 1252 radionuclides. T. Otto. Radiation Protection Dosimetry. 2016, vol 168, No 1: p1-70.
- Radiation Shielding. Shultis JK, Faw RE. Amer Nuclear Society. 2000
- X-Ray Mass Attenuation Coefficients for Water (https://physics.nist.gov/PhysRefData/XrayMassCoef/ComTab/water.html)
Ten aanzien van de berekeningen die zijn toegepast zij verwezen naar de Rekentool waar zowel de gebruikte bronnen als de rekenformules zijn gegeven. Ook de rekenkundige definitie van de transmissie van gammastraling door het lichaam van de patiënt (ftli) die in de Tabel met gehanteerde parameters voor de berekeningen wordt gegeven bij iedere module wordt daar toegelicht.
Maatregelen
Na het in kaart brengen van bovenstaande gegevens is de volgende stap het beoordelen welke factoren de meeste invloed hebben op reductie van de stralingsblootstelling. Hiertoe zijn berekeningen uitgevoerd, opgebouwd middels een blootstellingscenario gebaseerd op de SCP-tijdsbestedingsscenario’s [Roeters, 2018]. Deze werkwijze is ook toegepast in het rekenmodel dat is ontwikkeld door het RIVM voor het rapport ‘Nucleair-geneeskundige therapieën: potentiële blootstellingen voor derden’ [Kloosterman, 2020]. De principes van dit RIVM-rekenmodel zijn overgenomen in de Rekentool die is ontwikkeld voor deze richtlijn. Rechtstreeks overnemen van het rekenmodel van het RIVM bleek niet mogelijk doordat daarin de transmissiefactor is ontleend
aan het programma Nucleonica waarover de richtlijnwerkgroep niet de beschikbaarheid had en dat ook gezien moet worden als ‘blackbox’. Dit tast de reproduceerbaarheid en mogelijkheid tot updaten van waarden op basis van nieuwe literatuur aan. In de Rekentool bij deze Richtlijn is daarom een berekende transmissiefactor gehanteerd. Door de scenario-gebaseerde berekeningen wordt inzichtelijk welke handelingen binnen dat scenario verantwoordelijk zijn voor het belangrijkste deel van de totale blootstelling. Hierdoor is optimale selectie van maatregelen ter reductie van de blootstelling mogelijk. In de aanbevelingen die zijn geformuleerd zijn de meest relevante en generieke maatregelen benoemd. Daarnaast is de Rekentool die is ontwikkeld voor deze berekeningen eveneens beschikbaar gesteld. Met deze rekenbladen kunnen in de dagelijkse praktijk meer specifieke scenario’s worden uitgewerkt evenals het effect van meer specifieke maatregelen. Op deze wijze kan er in de nucleair geneeskundige praktijk meer ‘Patient Tailored Medicine’ bedreven worden zonder dat dit leidt tot grotere gezondheidsrisico’s ten gevolge van stralingsblootstelling voor verzorgers en leden van de bevolking.
Rekenbladen
Ter ondersteuning van het gebruik van de rekenbladen is voorwaardelijke opmaak gebruikt die een signaalfunctie heeft ten aanzien van de mate van blootstelling totaal of voor een specifiek scenario. Hierbij is een kleurgradient gecreëerd die loopt van een gekozen minimale grenswaarde in de kleur geel naar een gekozen maximale grenswaarde in rood. Deze grenswaarden zijn deels gebaseerd op de in de inleiding genoemde normen voor blootstellingen [Radiation Protection 97, 1998]. Voor de goede orde zij vermeld dat de kleurencodes geen dwingend karakter hebben en alleen fungeren als signalering. Wel geldt dat de kleur rood bij de totale dosis aangeeft dat de normen voor blootstelling worden overschreden. De overige gekozen grenswaarden zijn, met uitzondering van de waarden voor een ‘Derde’, afgeleide waarden waarbij voor > 10% van de norm voor totale blootstelling is gekozen voor de kleur geel in Tabel 3. Voor een ‘Derde’ is 10% van de norm voor de totale dosis gelijk aan 0,03 mSv. Dat is dermate laag voor een totale blootstelling dat het weinig toevoegt om op die waarde een signalering te geven. Daarom is er door de richtlijnwerkgroep gekozen om die waarde op minimaal 0,1 mSv te laten. Voor de afzonderlijke handelingen in Tabel 4 is voor de kleur rood gekozen bij een waarde > 10% van de norm voor de totale blootstelling. De kleur geel geldt dan voor waarden > 1% van de norm voor de totale blootstelling. Uitzondering hierbij zijn de signaleringswaarden voor een ‘Derde’ aangezien dat gaat om anderen dan ‘familie en vrienden’ en er dus in de regel altijd slechts sprake is van een blootstelling via slechts 1 handeling. Daarom is de grenswaarde voor een handeling hetzelfde als voor de totale dosis aangezien de laatste op de eerste gebaseerd is.
Tabel 3: gekozen grenswaarden voor totale blootstelling
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 0,1 mSv |
≥ 0,3 mSv |
≥ 1,5 mSv |
≥ 0,1 mSv |
|
|
≥ 1 mSv |
≥ 3 mSv |
≥ 15 mSv |
≥ 0,3 mSv |
|
Tabel 4: gekozen grenswaarden voor blootstelling per afzonderlijke handeling
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 0,01 mSv |
≥ 0,03 mSv |
≥ 0,15 mSv |
≥ 0,1 mSv |
|
|
≥ 0,1 mSv |
≥ 0,3 mSv |
≥ 1,5 mSv |
≥ 0,3 mSv |
|
Radiation Protection 97 geeft geen grenswaarden voor de huiddosis. Om die toch vast te stellen is gekeken naar de relatie tussen de vastgestelde dosislimieten in het Bbs tussen leden van de bevolking en blootgestelde medewerkers. Daarbij gaat de dosislimiet voor de blootgestelde medewerker voor de totale dosis van 1 mSv naar 20 mSv ten opzichte van een lid van de bevolking (verhouding 1:20) en voor de huiddosis gaat deze van 50 mSv naar 500 mSv (verhouding 1:10), zie Bbs artikel 7.34.2 vs. 9.1.1 [Bbs, 2018]. Daarmee kan worden vastgesteld dat de correctiefactor van de dosislimiet voor de huiddosis gelijk is aan de helft van de correctiefactor voor de totale dosis. Voor de correctie van de dosislimiet voor de totale dosis bij een derde na een behandeling (0,3 mSv in plaats van 1 mSv) is de onderliggende ratio de herhaalkans per jaar op een blootstelling van een derde aan een patiënt die is behandeld met een radiofarmacon. Die herhaalkans is voor zowel de totale dosis als de huiddosis gelijk. Daarom is de correctiefactor (0,3) daarvoor aan elkaar gelijkgesteld. Daarmee worden de gehanteerde grenswaarden voor de huiddosis zoals gegeven in Tabel 5.
Tabel 5: gekozen grenswaarden voor huiddosis
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 5 mSv |
≥ 7,5 mSv |
≥ 37,5 mSv |
≥ 1,5 mSv |
|
|
≥ 50 mSv |
≥ 75 mSv |
≥ 375 mSv |
≥ 15 mSv |
|
Deze kleurgradient heeft een signaalfunctie om aan te geven waar de meeste winst te halen is ten aanzien van het reduceren van blootstelling en via de kleurovergangen ook de oplopende wenselijkheid om in ieder geval te beoordelen of er maatregelen mogelijk zijn om de blootstelling te reduceren. Daarbij dient wel in alle gevallen de afweging gemaakt te worden of de winst voor leden van de bevolking opweegt tegen de overlast voor de patiënt. Ook hierbij geldt het principe van redelijkheid en de graduele aanpak zoals verwoord in Euratom 2013/59 [Euratom, 2013].
Literatuur
- [Bbs, 2018] Besluit basisveiligheidsnormen stralingsbescherming. nr. IENM/BSK-2017/135624; Staatsblad nr. 404, 2017
- [Euratom, 2013] Euratom/2013/59 van de Raad 2013. (2013 5 december).
- [ICRP 103, 2007] Annex A of ICRP, 2007. The 2007 Recommendations of the International Commission on Radiological Protection. ICRP publication 103. Ann. ICRP 37 (2-4). 2007
- [KEW, 1963] Kernenergiewet 1963. (1963 21 februari).
- [Kloosterman, 2020] Kloosterman A, van Dijk A, Boudewijns-Schoonderbeek L, et al. Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. RIVM-briefrapport 2020-0113.
- [NCS, 2016] Human Exposure to Ionising Radiation for Clinical and Research Purposes NCS 26, mei 2016
- [RP 97, 1998] European Commission, Directorate-General Environment, Nuclear Safety and Civil Protection. Radiation Protection following Iodine-131 therapy (exposures due to out-patients or discharged in-patients). 1998
- [Roeters, 2018] Roeters, A., Alle ballen in de lucht: Tijdsbesteding in Nederland en de samenhang met kwaliteit van leven. SCP, 2018
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
