Effect van behandeling van OSA op comorbiditeiten
Uitgangsvraag
Dient een patiënt met (asymptomatisch of symptomatisch) obstructief slaapapneu (OSA) en comorbiditeit behandeld te worden om uitkomsten gerelateerd aan de comorbiditeiten te verbeteren?
Aanbeveling
Voer niet standaard een slaaponderzoek uit bij patiëntengroepen op basis van (cardiovasculaire) comorbiditeit. Vraag naar klachten middels een slaapanamnese en zet zo nodig vervolgonderzoek in (zie ook module Klinische testen voor OSA en de bijlage Slaapanamnese).
Behandel in principe geen patiënten zonder klachten behorende bij OSA, ook niet bij bestaande cardiovasculaire comorbiditeit.
Overweeg een OSA-proefbehandeling bij patiënten met therapieresistente hypertensie of therapieresistent atriumfibrilleren, alleen indien er in de anamnese aanwijzingen zijn voor OSA en een slaaptestuitslag hier aanleiding toe geeft.
Continueer de therapie alleen indien er een verbetering optreedt in de comorbiditeit of bij verbetering van klachten. Evalueer dit na 3 maanden goed gebruik van CPAP (ten minste 4 uur per nacht gedurende ten minste 5 nachten per week, zie ook de module Bevordering van therapietrouw CPAP).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In bovenstaande literatuuranalyse is uitgezocht wat de effecten zijn van behandeling van OSA in combinatie met een comorbiditeit. Aanvankelijk zouden alleen RCT’s meegenomen worden bij asymptomatische OSA-patiënten, dus zonder slaperigheidsklachten (ESS≤10). Er werden echter maar weinig studies gevonden die dit criterium hadden gebruikt voor inclusie van patiënten. Er werd daarom besloten dit te laten vallen. Subgroepanalyses waren helaas niet mogelijk vanwege de kleine aantallen. In het algemeen is het niveau van de onderzoeken laag. Er zijn weinig RCT’s en het gebruik van CPAP was regelmatig minder dan de geadviseerde minimale therapieduur (5 dagen per week, gemiddeld minimaal 4 uur per nacht). Ook was de onderzoeksduur in een deel van de studies te kort om een effect te kunnen bewerkstelligen op de uitkomstmaten. Er blijft dus sprake van een kennislacune. Met het huidige bewijs kunnen we per comorbiditeit de onderstaande conclusies trekken. Maar vooral is er behoefte aan meer en kwalitatief beter onderzoek.
Er is weinig bewijs voor een verbetering op de HbA1c wanneer patiënten met OSA en diabetes mellitus type 2 behandeld worden met CPAP, vergeleken met sham-CPAP. Ook op andere diabetes-gerelateerde uitkomstmaten zoals beschreven in de Cochrane review (Bergman, 2019), kon het niet worden aangetoond dan wel uitgesloten of behandeling met CPAP meerwaarde heeft.
Voor het effect van CPAP-behandeling op atriumfibrilleren werden slechts twee studies geïncludeerd. Met een zeer lage bewijskracht konden er geen conclusies worden getrokken over de effectiviteit.
Er lijkt enig bewijs voor een afname van systolische bloeddruk en diastolische bloeddruk wanneer patiënten met OSA en hypertensie behandeld worden met CPAP. De resultaten in onze literatuuranalyse beperken zich tot de 24-uurs meting en nachtelijke bloeddruk. Ook in de spreekkamer gemeten bloeddruk zou mogelijk iets dalen (Bergman, 2019). De puntschatter van het effect haalt de klinisch relevante grens volgens de AASM-criteria (daling systolische bloeddruk van ≥2 mmHg; daling van ≥1 mmHg diastolisch), echter de betrouwbaarheidsintervallen overschrijden deze grens. Het is daarnaast onduidelijk wat de klinische relevantie is van deze bloeddrukdaling voor de individuele patiënt. Een dergelijke daling zal zelden leiden tot aanpassing van zijn medicatie. Op groepsniveau geeft het mogelijk een verlaagd risico op andere cardiovasculaire eindpunten, maar dit lijkt niet klinisch relevant. In de Nederlandse richtlijn Hypertensie in de tweede lijn worden daarom hogere grenzen voor klinisch relevante uitkomsten gehanteerd (daling 24-uurs systolische bloeddruk van ≥5 mm Hg). De resultaten van de twee studies (Barbe, 2010; Robinson, 2016) die asymptomatische patiënten includeerden AHI≥5 en ESS<11) waren in lijn met de andere studies.
Verder lijken meer patiënten de streefwaarde voor de bloeddruk te halen na behandeling met CPAP. Een mogelijke verklaring is dat patiënten een uitgangsbloeddruk hadden, die dicht bij de streefwaarde ligt. Maar het is ook mogelijk dat de gemiddeld lage daling van de systolische bloeddruk en de diastolische bloeddruk in de CPAP-groep veroorzaakt wordt doordat grotere, klinisch relevante bloeddrukdalingen bij sommige patiënten (‘responders’) worden uitgemiddeld door geen of zeer kleine bloeddrukdalingen bij anderen. Er zijn echter geen subgroepanalyses (bijvoorbeeld voor therapieresistente hypertensie) verricht.
Op basis van twee RCT’s kon de effectiviteit van CPAP-behandeling bij patiënten met OSA en coronaire hartziekten niet worden aangetoond dan wel worden uitgesloten bij lage/zeer lage kwaliteit bewijs.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
CPAP-therapie kan de kwaliteit van slaap beïnvloeden, en met name een ogenschijnlijk asymptomatische patiënt zal waarschijnlijk sneller de nadelen (zoals invloed op de kwaliteit van slaap) dan de voordelen ondervinden. Het is onduidelijk of hier op lange termijn nadelige effecten aan zitten. De mogelijke implicaties op de gezondheid van de patiënt moeten dus in ogenschouw worden genomen.
Het komt ook voor dat patiënten geen klachten ervaren, maar uiteindelijk toch voordeel van behandeling hebben. Vaak gaat het dan om patiënten die zich niet bewust zijn van hun klachten en op aanraden van hun partner in beeld komen.
Kosten (middelenbeslag)
De rol van screenen is niet onderzocht, maar uit de literatuur is bekend dat de incidentie van een verhoogde AHI vele malen hoger is dan die van klinisch relevant OSA (Heinzer, 2015). Het actief screenen op OSA bij grote patiëntgroepen (mensen met diabetes, hypertensie, cardiovasculaire ziekten) die geen voor OSA-verdachte klachten hebben, zou daarmee tot onnodig veel (dure) behandelingen kunnen leiden.
Aanvaardbaarheid, haalbaarheid en implementatie
In de huidige situatie worden patiënten met een verhoogde AHI en zonder OSA-klachten, niet standaard behandeld. Het is de ervaring van de werkgroep dat bij therapieresistente hypertensie het nuttig kan zijn om extra aandacht te geven aan OSA-gerelateerde klachten. Indien hier sprake van is, is een slaaponderzoek geïndiceerd. Als slaapapneu wordt vastgesteld, kan met een proefbehandeling worden begonnen. De aanbevelingen wijken daar niet van af.
De werkgroep kent geen landelijke screening op OSA in risicogroepen en gezien het huidige bewijs is daar ook geen aanleiding voor. Er zijn dus geen veranderingen nodig in de huidige organisatie van zorg.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het bewijs voor effecten van OSA-behandeling op comorbiditeit-gerelateerde uitkomstmaten is beperkt, maar dit kan te maken hebben met de kwaliteit van de studies en de vaak relatief korte behandelduur om een dergelijk effect te zien. CPAP-behandeling lijkt een kleine daling van de systolische bloeddruk en diastolische bloeddruk te veroorzaken, maar deze is mogelijk niet klinisch relevant. Op basis van literatuuranalyse (meer patiënten de streefwaarde voor de bloeddruk te halen na behandeling met CPAP) en expert opinion zijn er aanwijzingen dat er subgroepen zijn met grotere effecten op de bloeddruk van de OSA-behandeling. In de praktijk zien behandelaren bij patiënten met therapieresistente hypertensie wel effecten en daarom lijkt het aannemelijk dat voor deze subgroep CPAP-behandeling wel klinisch relevante effecten zou kunnen hebben. Dat geldt ook voor therapieresistent atriumfibrilleren.
Bij de keuze of OSA zonder klachten (asymptomatisch OSA) bij een individuele patiënt wel of niet behandeld dient te worden, dient er rekening gehouden te worden met de mogelijk beperkte positieve effecten op comorbiditeit-gerelateerde uitkomstmaten, en de mogelijke implicaties voor de patiënt (zoals invloed op de kwaliteit van slaap). In individuele gevallen, zoals therapieresistente hypertensie of therapieresistente atriumfibrilleren, kan na een zorgvuldige slaapanamnese en aanvullend onderzoek naar OSA zo nodig een OSA-proefbehandeling worden overwogen, mits er duidelijke behandeldoelen worden vastgesteld. De behandeling wordt alleen gecontinueerd bij een klinisch relevant effect (afhankelijk van de behandeldoelen) na 3 maanden goed gebruik van het CPAP-apparaat. Bij een combinatie van OSA en comorbiditeit wordt daarnaast aanbevolen om aandacht te besteden aan leefstijl ten behoeve van gewichtsreductie, bewegen en stoppen met roken te geven conform de richtlijn Cardiovasculair risicomanagement.
Wanneer patiënten in aanmerking komen voor een proefbehandeling (comorbiditeit en (niet anders verklaarde) vermoeidheid of slaperigheidsklachten) moet goed worden uitgelegd dat wanneer na 3 maanden goed gebruik van CPAP er geen verbetering optreedt, er geen indicatie is voor continueren van de behandeling. Bij de evaluatie dient ook aandacht te zijn voor non-compliantie (zie ook de module over Therapietrouw).
Wetende dat een goede anamnese zeer belangrijk is voor de keuze van het juiste slaaponderzoek, en dat het behandelen van OSA zonder klachten hooguit een minimale gezondheidswinst oplevert voor de individuele patiënt, is de mening van de werkgroep dat er geen winst te verwachten is door het screenen van groepen patiënten (zoals die met hypertensie of atriumfibrilleren) op OSA. Natuurlijk moet er in deze groep wel aandacht zijn voor de aanwezigheid van OSA gerelateerde klachten. Indien de anamnese past bij een mogelijke slaapstoornis is er wel een indicatie voor aanvullende diagnostiek. Als er zonder selectie vooraf op grote schaal slaaponderzoeken worden verricht, zullen er ook veel vals positieve testen zijn (een afwijkende AHI zonder klachten en hieruit voortvloeiende mogelijke negatieve gevolgen voor de gezondheid van een onterechte diagnose). We kennen geen onderzoek naar de negatieve gevolgen hiervan, maar vanuit de dagelijkse praktijk herkennen we dat patiënten zich ziek voelen nadat een verhoogde AHI leidt tot het opgespeld krijgen van de diagnose OSA, zonder dat hiervoor gegronde reden is. Dit samennemend zijn wij van mening dat screenen leidt tot onnodige onzekerheid bij een grote groep personen over een verhoogde AHI en daarnaast veel onnodige en dus onzinnige behandelingen.
Onderbouwing
Achtergrond
Waar het bij patiënten met OSA-gerelateerde klachten makkelijk is om een behandeldoel vast te stellen, is het onduidelijk wanneer een patiënt met een verhoogde AHI zonder klachten (asymptomatisch OSA), wel of niet behandeld moet worden. Obstructief slaapapneu (OSA) is geassocieerd met een verhoogd risico op andere aandoeningen. Wanneer behandeling van OSA ook een effect op deze andere aandoeningen bewerkstelligt, zou dat een reden kunnen zijn om OSA-behandeling te starten.
In deze module onderzoeken we wat er bekend is over behandeling van (asymptomatische en symptomatische) OSA bij patiënten met bestaande comorbiditeit. Met andere woorden; is het zinvol om OSA te behandelen met het oog op comorbiditeit(en) (McNicholas, 2018)? En dienen patiënten met andere aandoeningen (onder andere diabetes mellitus, hypertensie, atriumfibrilleren) gescreend te worden op het bestaan van OSA?
Conclusies
|
Redelijk GRADE |
Behandeling met CPAP resulteert na 3 maanden waarschijnlijk niet of nauwelijks in een verbetering van het percentage HbA1c vergeleken met geen of sham-CPAP bij patiënten met OSA en diabetes type 2. Bronnen: Bergman, 2019 |
|
Zeer laag GRADE |
Het bewijs is zeer onzeker over het effect van CPAP op HbA1c na zes maanden vergeleken met geen CPAP bij patiënten met OSA en diabetes type 2. Bronnen: Bergman, 2019 |
|
zeer laag GRADE |
Het bewijs is zeer onzeker over het effect van CPAP-behandeling op recidief van atriumfibrilleren na 1 jaar vergeleken met geen CPAP bij patiënten met OSA en status na cardioversie vanwege atriumfibrilleren.
Bronnen (Bergman, 2019 (Caples, 2018)) |
|
zeer laag GRADE |
Het bewijs is zeer onzeker over het effect van CPAP-behandeling AF-ziektelast na 6 maanden vergeleken met geen CPAP bij patiënten met OSA en atriumfibrilleren.
Bronnen (Traaen, 2020) |
|
Laag
zeer laag GRADE |
Behandeling met CPAP resulteert mogelijk in een kleine verbetering van de 24-uurs diastolische en systolische bloeddruk bij patiënten met OSA en hypertensie.
Het bewijs is zeer onzeker over het effect van CPAP-behandeling op de gemiddelde arteriële bloeddruk (MAP) bij patiënten met OSA en hypertensie (2 onderzoeken).
Bronnen: Bergman, 2019 |
|
laag GRADE |
Behandeling met CPAP resulteert mogelijk in een kleine verbetering van de nachtelijke diastolische en systolische bloeddruk, en de MAP bij patiënten met OSA en hypertensie.
Bronnen: Bergman, 2019 |
|
laag GRADE |
Behandeling met CPAP resulteert mogelijk in een toename van het aantal patiënten dat een bloeddrukstreefwaarde behaalt.
Bronnen: Bergman, 2019 |
|
Laag GRADE |
Behandeling met een MRA resulteert mogelijk niet in een verbetering van de 24-uurs diastolische en systolische bloeddruk bij patiënten met OSA en hypertensie.
Bronnen: Bergman, 2019 |
|
Zeer laag GRADE |
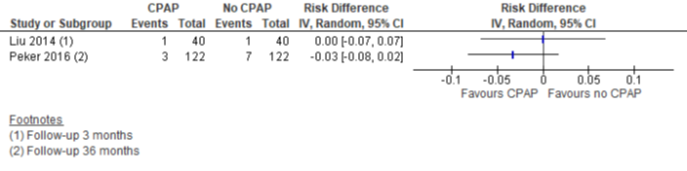
Het bewijs is zeer onzeker over het effect van CPAP-behandeling op cardiovasculair overlijden bij patiënten met OSA en coronaire hartziekte (follow-up na 3 en 36 maanden).
Bronnen (Liu, 2014; Peker, 2016) |
|
Laag GRADE |
CPAP-behandeling resulteert waarschijnlijk niet in een verschil in overlijden bij patiënten met OSA en coronaire hartziekte (follow-up 36 maanden).
Bronnen (Peker, 2016) |
Samenvatting literatuur
Beschrijving studies – Diabetes mellitus
De zoekactie van Cochrane Nederland op 14 december 2018 leverde 516 hits op. Uiteindelijk werden zeven RCT’s geïncludeerd die het effect van CPAP-behandeling onderzochten bij patiënten met een verhoogde AHI en diabetes mellitus type 2. Vier studies vergeleken CPAP met gebruikelijke zorg. De andere drie studies gebruikten sham-CPAP als controle (1 studie nam HbA1c mee als uitkomstmaat). De follow-up varieerde van 1 week tot 1 jaar. Geen van de studies includeerde alleen asymptomatische patiënten (ESS<10), maar bij vier studies was de gemiddelde baseline ESS wel onder de 10. Alle studies hadden een hoog risico op bias vanwege performance bias en detection bias.
Resultaten - diabetes mellitus
HbA1c
De vier studies die CPAP met geen CPAP vergeleken, rapporteerden alle de uitkomstmaat HbA1c. Na drie maanden follow-up bedroeg het gemiddelde verschil in verbetering van het percentage HbA1c t.o.v. baseline -0,03% (95% BI -0,39 tot 0,33) (zie Figuur 2.1). Na zes maanden waren de resultaten tegenstrijdig waardoor de data niet gepooled zijn (figuur 2.2): Martinez-Ceron (2016) liet een gemiddeld verschil in afname zien van 0,40 tegenover Shaw (2016) die geen significant verschil vond. Eén onderzoek kon niet meegenomen worden in de meta-analyse, omdat geen kwantitatieve resultaten werden vermeld. De auteurs rapporteerden op geen enkel meetmoment een verschil op HbA1c (West, 2018a).
Ook één studie die CPAP met shamCPAP vergeleek, vond geen verschil tussen de groepen op HbA1c (MD= -0,07% (95% BI -0,81 tot 0,67) na drie maanden follow-up (West, 2007).
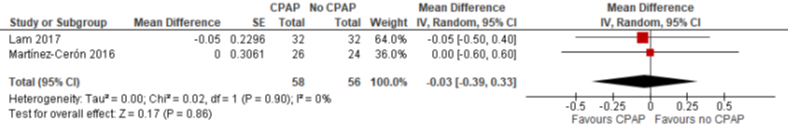
Figuur 1 Forest plot van het verschil in verbetering van HbA1c (%) t.o.v. baseline na drie maanden follow-up tussen CPAP en geen CPAP onder patiënten met OSA en diabetes mellitus type 2 (figuur overgenomen uit Bergman, 2019)
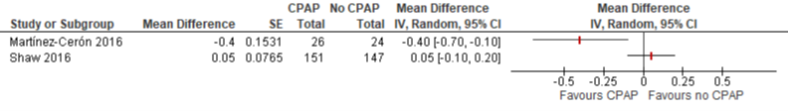
Figuur 2 Forest plot van het verschil in verbetering van HbA1c (%) t.o.v. baseline na zes maanden follow-up tussen CPAP en geen CPAP onder patiënten met OSA en diabetes mellitus type 2 (figuur overgenomen uit Bergman, 2019)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat HbA1c na 3 maanden is met 1 niveau verlaagd vanwege het geringe aantal patiënten (imprecisie). Er zijn beperkingen in de onderzoeksopzet (risk of bias gezien gebrek aan blindering), maar daar is niet voor afgewaardeerd.
De bewijskracht voor de uitkomstmaat HbA1c na 6 maanden is met 3 niveaus verlaagd vanwege het geringe aantal patiënten (imprecisie), inconsistentie en beperkingen in de onderzoeksopzet (risk of bias vanwege een onvolledige intention-to-treat analyses).
Beschrijving studies - Atriumfibrilleren
De zoekactie van Cochrane op 14 december 2018 naar behandeling van patiënten met OSA en atriumfibrilleren leverde 141 hits op, waarvan geen van de onderzoeken ging over de behandeling van patiënten met OSA en atriumfibrilleren. Eén onderzoek echter betrof patiënten met OSA en atriumfibrilleren die cardioversie vanwege atriumfibrilleren hadden ondergaan en bij wie het effect van CPAP-behandeling (versus geen CPAP) op het optreden van een recidief van het atriumfibrilleren werd onderzocht (Caples, 2018). Deze studie is geïncludeerd. Er werden 25 patiënten geïncludeerd, die een AHI ≥5 en een ESS≤10 hadden. De follow-up bedroeg 1 jaar. De evidence tabel, risk-of bias tabel en summary-of-findings tabel is te vinden in de Cochrane review, bijlage 2.4, 2.5 en 2.6 (Bergman, 2019).
De update van de literatuursearch op 5 juli 2021 leverde 21 hits op. Hiervan voldeed 1 studie aan de PICO. De studie van Traaen (2021) onderzocht CPAP versus geen CPAP bij 109 patiënten met OSA en atriumfibrilleren. Deze patiënten werden verwezen voor een catheterablatie vanwege paroxismaal atriumfibrilleren. Patiënten werden geïncludeerd als ze een AHI≥15 en een ESS≤15 hadden. De follow-up was 6 maanden en er was geen verschil in uitval tussen de groepen. Bij baseline waren de patiënten in de CPAP-groep 5,6% van de tijd in atriumfibrilleren en 5,0% in de controlegroep.
Resultaten atriumfibrilleren
Recidief atriumfibrilleren
In de studie van Caples (2018) trad bij 3/12 patiënten in de CPAP-groep versus 3/13 patiënten in de controlegroep een recidief atriumfibrilleren op (RR=1,08, 95%BI 0,27 tot 4,37).
Atriumfibrilleren-ziektelast
Van baseline naar de laatste 3 maanden daalde het percentage tijd in atriumfibilleren licht in beide groepen, waarbij er een minimaal verschil was ten gunste van de CPAP groep van -0,6% (95%BI (95% BI: -2,6 tot 1,3) (Traaen, 2021).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat recidief atriumfibrilleren is met drie niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias gezien performance bias, detection bias, attrition bias en other bias) en imprecisie (het geringe aantal patiënten, onvoldoende power).
De bewijskracht voor de uitkomstmaat AF-ziektelast is met drie niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en imprecisie (het geringe aantal patiënten, onvoldoende power).
Beschrijving studies - Hypertensie
De zoekactie van Cochrane op 14 december 2018 naar behandeling van patiënten met OSA en hypertensie leverde 1117 hits op, waarvan veertien RCT’s uiteindelijk werden geïncludeerd. Zeven studies vergeleken CPAP met geen CPAP, zes studies vergeleken CPAP en sham-CPAP. De follow-up varieerde van 1 maand tot 36 maanden, en het aantal patiënten tussen de 35 en 374. Twee onderzoeken includeerden specifiek patiënten zonder slaperigheidsklachten (ESS<11 of <10) (Barbe, 2010; Robinson, 2016). Barbe (2010) nam alleen in de spreekkamer gemeten bloeddruk mee en komt daarom niet terug in onze resultaten. Bij zes studies was de gemiddelde of mediane ESS-score op baseline ≤10. Zes studies includeerden patiënten met moeilijk behandelbaar/therapieresistente hypertensie.
Een studie vergeleek MRA met een niet-werkende MRA (72 patiënten), inclusiecriteria waren AHI≥10 en met een follow-up van 3 maanden.
De evidence tabellen, risk-of bias tabellen en summary-of-findings tabellen zijn te vinden in de Cochrane review, bijlage 3.4, 3.5 en 3.6 (Bergman, 2019).
De update van de literatuursearch op 5 juli 2021 leverde 149 studies op. Hiervan voldeden 2 studies aan de PICO. Omdat een studie slechts 16 patiënten includeerde met OSA, diabetes mellitus en chronische nierschade, wordt deze niet meegenomen in de literatuursamenvatting.
Liu (2021) vergeleek CPAP met geen CPAP bij 92 patiënten met OSA en therapieresistente hypertensie. Ze hadden een AHI≥15, de ESS was geen inclusiecriterium, op baseline was deze gemiddeld onder de 10. De follow-up bedroeg 8 weken. De resultaten zijn toegevoegd aan de meta-analyse van Cochrane.
Resultaten - Hypertensie
Bloeddrukdaling (24-uursmeting)
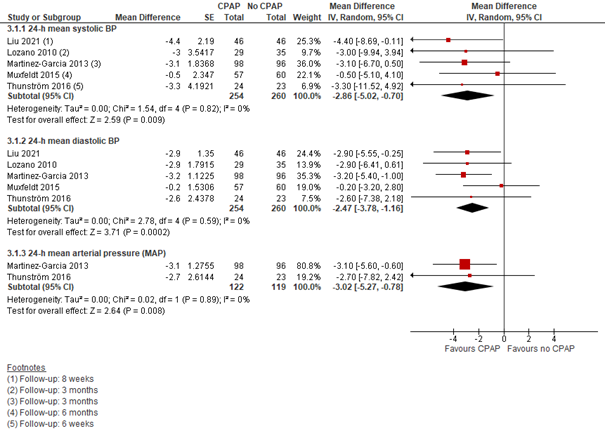
CPAP versus geen CPAP: Voor de vergelijking CPAP versus geen CPAP konden de resultaten van vijf studies worden meegenomen, weliswaar met een variërende follow-up van 6 weken tot 6 maanden (vier studies uit de Cochrane review en Liu, 2021). Het verschil in verlaging van de 24-uurs diastolische bloeddruk was met -2,86 (95%BI -5,02 tot -0,70) in het voordeel van CPAP. Het verschil bij de 24-uurs systolische bloeddruk was -2,47 (95%BI -3,78 tot -1,16), in het voordeel van CPAP (zie Figuur 3). De verlaging van 24-uurs arteriële bloeddruk (MAP) was ook in het voordeel van CPAP, met een verschil van -3,01 (95%BI -5,27 tot -0,78) (Figuur 3).
Meer patiënten bereikten een bloeddrukstreefwaarde van <130/80 mm Hg (24-uurs bloeddruk) in de CPAP-groep dan in de groep die niet met CPAP behandeld werd: RR= 1,43 (95% BI 0,83 tot 2,48). Dit gold ook voor het bereiken van een streefwaarde <140/90 mm Hg (spreekkamer bloeddruk): RR= 1,43 (95% BI 1,02 tot 2,00). Het overall RR bedroeg 1,43 (95% BI 1,07 tot 1,90) in het voordeel van CPAP.
Figuur 3 Forest plot van het verschil in 24-uurs bloeddruk tussen CPAP en geen CPAP onder personen met OSA en hypertensie (op basis van Cochrane review + Liu, 2021)
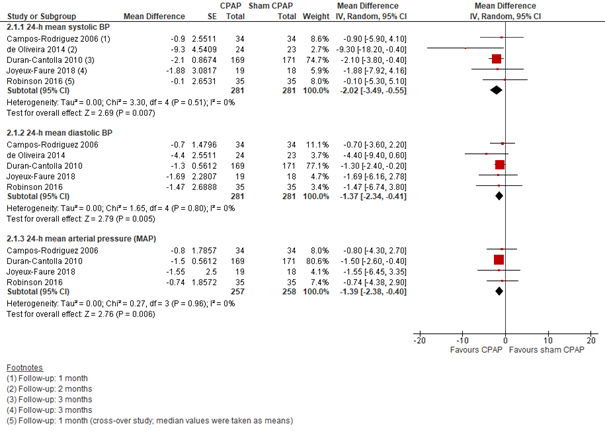
CPAP versus sham-CPAP: Voor de vergelijking CPAP versus sham-CPAP konden de resultaten van 5 studies worden meegenomen (n=575), weliswaar met een variërende follow-up van 3 weken tot 3 maanden. Het verschil in verlaging van de 24-uurs diastolische bloeddruk was met -1,37 (95%BI -2,34 tot -0,41) in het voordeel van CPAP. Het verschil bij de 24-uurs systolische bloeddruk was -2,02 (95%BI -3,49 tot -0,55), ook in het voordeel van CPAP. De verlaging van 24-uurs gemiddelde arteriële bloeddruk (MAP) was ook in het voordeel van CPAP, met een verschil van -1,39 (95%BI -2,38 tot -0,40) (Figuur 4).
Figuur 4 Forest plot van het verschil in 24-uurs bloeddruk tussen CPAP en sham CPAP onder personen met OSA en hypertensie
MRA versus sham-MRA: één studie vergeleek MRA met sham-MRA (Andren, 2013) en vond een gemiddelde daling in 24-uurs systolische bloeddruk, diastolische bloeddruk en MAP van respectievelijk -1,8 (95%BI -5,7 tot 2,1), -1,0 (-3,9 tot 1,9) en -0,7 (95%BI -4,1 tot 2,6).
Nachtelijke bloeddruk
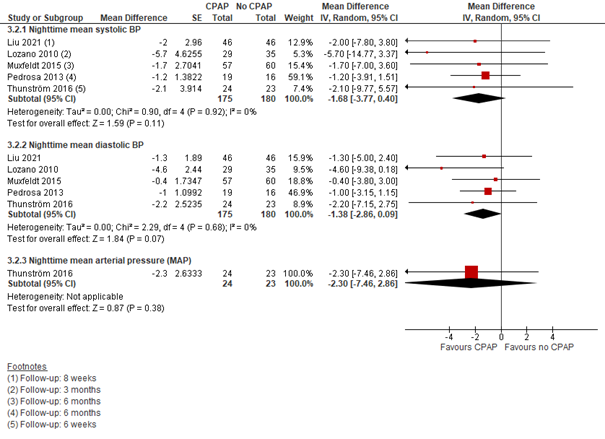
CPAP versus geen CPAP: Tussen CPAP en geen CPAP verschilden de nachtelijke bloeddrukmetingen als volgt: de systolische bloeddruk met -1,68 mmHg (95% BI -3,77 tot 0,40), de diastolische bloeddruk met -1,38 mmHg (95% BI -2,86 tot 0,09) en de MAP met -2,30 mmHg (95% BI -7,46 tot 2,86)) (in het voordeel van CPAP) (Figuur 5).
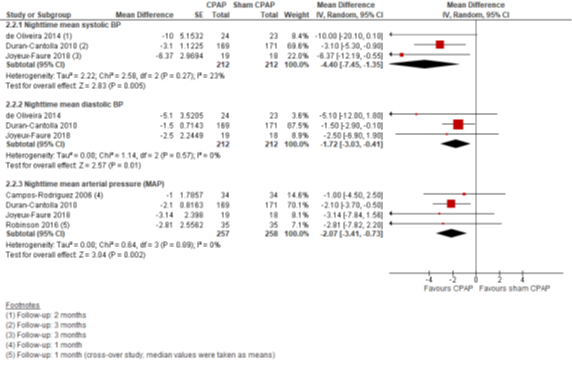
CPAP versus sham-CPAP: Tussen CPAP en sham-CPAP verschilden de nachtelijke bloeddrukmetingen als volgt: de systolische bloeddruk -4,40 mmHg (95% BI -7,45 tot -1,35), de diastolische -1,72 mmHg (95% BI -3,03 tot -0,41) en de MAP -2,07 mmHg (95% BI -3,41 tot -0,73) (in het voordeel van CPAP) (Figuur 6).
MRA versus sham-MRA: het verschil in nachtelijke bloeddruk tussen MRA en sham-MRA was voor de systolische -1,4 (95%BI -5,3 tot 2,5, voor de diastolische -1,3 (95%BI -4,1 tot 1,5) en voor de MAP -0,8 (-4,0 tot 2,5) mmHg).
Figuur 5 Forest plot van het verschil in gemiddelde nachtelijke bloeddruk tussen CPAP en geen CPAP onder personen met OSA en hypertensie (op basis van Cochrane review + Liu, 2021)
Figuur 2.6 Forest plot van het verschil in gemiddelde nachtelijke bloeddruk tussen CPAP en sham-CPAP onder personen met OSA en hypertensie
Bewijskracht van de literatuur
CPAP versus geen CPAP
De bewijskracht voor de uitkomstmaat 24-uurs diastolische en systolische bloeddruk is met 2 niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en imprecisie (betrouwbaarheidsinterval omvat een niet-klinisch relevante reductie).
De bewijskracht voor de uitkomstmaat 24-uurs gemiddelde arteriële druk is met drie niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en imprecisie (confidence interval includes irrelevant reduction en onvoldoende power).
De bewijskracht voor de uitkomstmaat behalen van streefbloeddrukwaarde is met twee niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en imprecisie (betrouwbaarheidsinterval omvat een niet-klinisch relevante reductie, en onvoldoende power).
CPAP versus sham CPAP
De bewijskracht voor de uitkomstmaat 24-uurs diastolische en systolische bloeddruk is met 2 niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en imprecisie (betrouwbaarheidsinterval omvat een niet-klinisch relevante reductie).
De bewijskracht voor de uitkomstmaat 24-uurs gemiddelde arteriële druk (MAP) is met twee niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en imprecisie (betrouwbaarheidsinterval omvat een niet-klinisch relevante reductie, en onvoldoende power).
De bewijskracht voor de uitkomstmaat nachtelijke bloeddruk (systolische, diastolische en MAP) is met drie niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en imprecisie (betrouwbaarheidsinterval omvat een niet-klinisch relevante reductie).
MRA versus sham MRA
De bewijskracht voor de uitkomstmaat nachtelijke bloeddruk (systolische, diastolische en MAP) is met twee niveaus verlaagd vanwege imprecisie (zeer kleine studie, betrouwbaarheidsinterval overlapt met de klinisch relevante grenzen).
Beschrijving studies - Coronaire hartziekten
De zoekactie van Cochrane leverde 1672 artikelen op. Drie RCT’s werden geïncludeerd die CPAP vergeleken met geen CPAP in patiënten met OSA en coronaire hartziekten:
- Liu (2014): Follow-up duur van 3 maanden, 80 patiënten (73% man), inclusie AHI >15 en ODI 4% ≥12.
- Huang (2016): Follow-up van 12 maanden, 78 patiënten (83% man), inclusie AHI ≥15 en ESS <15. In deze studie werd de uitkomstmaat Overlijden niet meegenomen.
- Peker (2016): Follow-up van 36 maanden, 244 patiënten (84% man), inclusie AHI ≥15 en ESS <10.
Er werden geen studies gevonden die het effect van MRA onderzochten.
De evidence tabellen, risk-of bias tabellen en summary-of-findings tabellen zijn te vinden in de Cochrane review (Bergman, 2019), bijlage 4.4, 4.5 en 4.6.
Resultaten coronaire hartziekten
Cardiovasculair overlijden
Twee onderzoeken bestudeerden het effect op cardiovasculair overlijden na wel of geen CPAP behandeling. Na 3 en 36 maanden werd geen verschil gezien tussen de groepen (zie figuur 7).
Figuur 7 Forest plot van het verschil in cardiovasculair overlijden tussen CPAP en geen CPAP onder patiënten met OSA en coronaire hartziekte
Overlijden ongeacht de oorzaak
Eén onderzoek onderzocht het effect van CPAP op overlijden (n=244) en zag geen statistisch significant verschil tussen CPAP-gebruikers en de groep die geen CPAP gebruikte (RR=0,78, 95%BI 0,30 tot 2,02).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat overlijden is met 3 niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias vanwege hoge uitval); en imprecisie (niet voldoende power, betrouwbaarheidsintervallen overlappen klinisch relevante grenzen).
De bewijskracht voor de uitkomstmaat overlijden is met 2 niveaus verlaagd imprecisie (niet voldoende power, brede betrouwbaarheidsintervallen).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is de volgende zoekvraag met bijbehorende PICO opgesteld:
Wat is het effect van behandeling met CPAP of een MRA bij asymptomatische patiënten met OSA én verschillende typen comorbiditeit (diabetes mellitus type 2, atriumfibrilleren, hypertensie of een coronaire hartziekte) op uitkomsten gerelateerd aan de comorbiditeit?
P: (welke patiëntcategorie) Volwassen patiënten met OSA (AHI>5) en met diabetes mellitus type 2, atriumfibrilleren, hypertensie of een coronaire hartziekte;
I: (welke interventie) CPAP of MRA;
C: (welke comparison) controlebehandeling, standaardzorg
O: (welke uitkomstmaten) Diabetes mellitus: HbA1c
Hypertensie: verlaging 24-uurs bloeddruk, nachtelijke bloeddruk
Atriumfibrilleren: recidief atriumfibrilleren
Coronaire hartziekten: cardiovasculaire en totale mortaliteit
Studiedesign: RCT’s
Timing: niet a priori gedefinieerd
Klinisch relevante verschillen van uitkomstmaten
- Diabetes mellitus: de werkgroep definieerde een gemiddeld verschil ≥ 0,3% in verbetering van HbA1c als een klinisch relevant verschil (Ismail-Beigi 2012; Look AHEAD 2010).
- Hypertensie: de werkgroep gebruikte de klinisch relevante verschillen zoals gesteld in de AASM richtlijn (2019): een gemiddeld verschil in daling van ≥2 mmHg systolische bloeddruk, en een verschil in daling van ≥1 mmHg op de diastolische bloeddruk als een klinisch relevant verschil (AASM, 2019), gemeten bij een 24-uurs ambulante bloeddrukmeting.
- Atriumfibrilleren: de werkgroep definieerde een RR van 0,8 op recidief atriumfibrilleren als een klinisch relevant verschil, en 20% vermindering van tijd in atriumfibrilleren.
- Coronaire hartziekten: de werkgroep definieerde een RR van 0,8 op cardiovasculaire en totale mortaliteit als klinisch relevant.
Zoeken en selecteren (Methode)
Voor de beantwoording van de zoekvraag is gebruik gemaakt van een reeds bestaande Cochrane review (Bergman, 2019). Deze is in opdracht van het Zorginstituut Nederland uitgevoerd en beantwoordt bovengenoemde PICO.
Referenties
- AASM. Treatment of Adult Obstructive Sleep Apnea with Positive Airway Pressure: An American Academy of Sleep Medicine Clinical Practice Guideline. 2019
- Barbé F, Durán-Cantolla J, Capote F, de la Peña M, Chiner E, Masa JF, et al. Long-term effect of continuous positive airway pressure in hypertensive patients with sleep apnea. Am J Respir Crit Care Med. 2010a Apr 1;181(7):718-26.
- Bergman H, Petkovic J, Cogo E, et al. Onderzoek naar het effect van behandeling met CPAP of MRA bij asymptomatische OSA patiënten met comorbiditeit op uitkomsten gerelateerd aan de comorbiditeit - Deel 2.a. Systematische reviews betreffende diabetes mellitus, atriumfibrilleren, hypertensie en coronaire hartziekte. 2019
- Caples SM, Mansukhani MP, Friedman PA, Somers VK. The impact of continuous positive airway pressure treatment on the recurrence of atrial fibrillation post cardioversion: A randomized controlled trial. Int J Cardiol. 2019 Mar 1;278:133-136.
- Huang Z, Liu Z, Zhao Z, Zhao Q, Luo Q, Tang Y. Effects of Continuous Positive Airway Pressure on Lipidaemia and High-sensitivity C-reactive Protein Levels in Non-obese Patients with Coronary Artery Disease and Obstructive Sleep Apnoea. Heart Lung Circ. 2016 Jun;25(6):576-83.
- Ismail-Beigi 2012; Ismail-Beigi F. Clinical practice. Glycemic management of type 2 diabetes mellitus. N Engl J Med. 2012;366(14):1319–1327.
- Look AHEAD 2010 Look AHEAD, Wing RR. Long-term effects of a lifestyle intervention on weight and cardiovascular risk factors in individuals with type 2 diabetes mellitus: four-year results of the Look AHEAD trial. Arch Intern Med. 2010;170(17):1566–1575.
- Liu (2014) Liu X, Feng L, Cao G, Huang H, Xu Q, Yu J, et al. Cardiac structure and function improvements in coronary artery disease combined with severe obstructive sleep apnea/hypopnea syndrome patients via noninvasive positive pressure ventilation therapy. Coron Artery Dis. 2014 Sep;25(6):516-20.
- Lui MM, Tse HF, Lam DC, Lau KK, Chan CW, Ip MS. Continuous positive airway pressure improves blood pressure and serum cardiovascular biomarkers in obstructive sleep apnoea and hypertension. Eur Respir J. 2021 Nov 4;58(5):2003687. doi: 10.1183/13993003.03687-2020. PMID: 33795324.
- McEvoy RD, Antic NA, Heeley E, et al. CPAP for prevention of cardiovascular events in obstructive sleep apnea. N Engl J Med. 2016;375(10):919–931
- Peker Y, Glantz H, Eulenburg C, Wegscheider K, Herlitz J, Thunström E. Effect of Positive Airway Pressure on Cardiovascular Outcomes in Coronary Artery Disease Patients with Nonsleepy Obstructive Sleep Apnea. The RICCADSA Randomized Controlled Trial. Am J Respir Crit Care Med. 2016 Sep 1;194(5):613-20.
- Robinson GV, Smith DM, Langford BA, Davies RJ, Stradling JR. Continuous positive airway pressure does not reduce blood pressure in nonsleepy hypertensive OSA patients. Eur Respir J. 2006 Jun;27(6):1229-35.
- Traaen GM, et al, Effect of Continuous positive airway pressure on arrhythmia in atrial fibrillation and sleep apnea; a randomized controlled trial. Am J Respir Crit Care Med 2021 Sep 1;204(5):573-582
- Robinson GV, Smith DM, Langford BA, Davies RJ, Stradling JR. Continuous positive airway pressure does not reduce blood pressure in nonsleepy hypertensive OSA patients. Eur Respir J. 2006 Jun;27(6):1229-35.
- West, 2007. West SD, Nicoll DJ, Wallace TM, Matthews DR, Stradling JR. Effect of CPAP on insulin resistance and HbA1c in men with obstructive sleep apnoea and type 2 diabetes. Thorax. 2007;62(11):969–974.
- West SD, Prudon B, Hughes J, Gupta R, Mohammed SB, Gerry S, et al. Continuous positive airway pressure effect on visual acuity in patients with type 2 diabetes and obstructive sleep apnoea: a multicenter randomised controlled trial. The European respiratory journal. 2018;52(4).
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 20-07-2022
Laatst geautoriseerd : 20-07-2022
Geplande herbeoordeling :
Algemene gegevens
In samenwerking met:
- ApneuVereniging
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
- Nederlandse Vereniging van Orthodontisten
- V&VN Longverpleegkundigen
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
In deze richtlijn worden aanbevelingen gedaan over de diagnostiek, chirurgische en niet-chirurgische behandelingen en de begeleiding van patiënten met OSA. Hiermee wordt meer uniformiteit verkregen met betrekking tot de zorg van patiënten met OSA. Voor de patiënt kan deze richtlijn leiden tot een betere en doelgerichtere behandeling/ betere op de patiënt afgestemde zorg.
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met OSA. De gebruikers van de richtlijn betreffen dan ook naast de longartsen, KNO-artsen, neurologen en kaakchirurgen veel andere medische beroepsgroepen zoals geriaters, orthodontisten, anesthesiologen, cardiologen, huisartsen, psychiaters, physician assistants, verpleegkundig specialisten, verpleegkundigen, OSA-consulenten, verzekeringsartsen en bedrijfsartsen.
Samenstelling werkgroep
- Dr. J.P. van Maanen, KNO-arts, Onze Lieve Vrouwe Gasthuis, (voorzitter), NVKNO
- Dr. J. (Jerryll) Asin, Longarts, Amphia ziekenhuis Breda, NVALT, NSVL
- Dr. J.A. (Hans) Hardeman, longarts, Antoniusziekenhuis Nieuwegein, NVALT
- Dr. L.L. (Laurien) Teunissen, neuroloog, Antoniusziekenhuis Nieuwegein, NVN
- Drs. P.H.J.M. van Mechelen, ApneuVereniging
Met ondersteuning van
- Dr. Ir. N.L. van der Zwaluw, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Met dank aan
- Dr. R.J.B. (Raphael) Hemler, KNO-arts, Gelre Ziekenhuizen
- De Slaapgeneeskunde Vereniging Nederland (SVNL) voor het bieden van een overlegplatform
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep-lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
JP van Maanen |
KNO-arts somnoloog, OLVG, voorzitter slaapcentrum
|
- bestuurslid Slaapgeneeskunde Vereniging Nederland - bestuurslid Stichting Slaapcongres Nederland - Voorzitter kerngroep slaapgeneeskunde, NVKNO |
- |
- |
|
J Asin |
Longarts-somnoloog, werkzaam in Amphia, Breda |
Lid NVALT, sectie Ademhalingsstoornissen tijdens de slaap (SAS) (onbetaald) Bestuurslid SNVL (onbetaald) |
- Advisory board Bioproject (vergoeding per bijeenkomst) - SLEMRA studie PRESMO-studie -COMISA-studie -JAZZ-studie |
- |
|
JA Hardeman |
Longarts, st. Antonius ziekenhuis Nieuwegein |
Secretaris sectie ademhalingsstoornissen in de slaap (SAS) onbetaald |
- |
- |
|
LL Teunissen |
Neuroloog, st Antonius ziekenhuis Nieuwegein |
Werkgroep ontwikkeling post-HBO opleiding SVNL ism LOI (tot op heden geen financiële tegemoetkoming, mogelijk in toekomst wel) |
- lid projectgroep namens de NVN voor studie: Z69118163 Een Value Based Healthcare verbetercyclus voor Obstructief Slaapapneu, SKMS subsidie. |
- |
|
PHJM van Mechelen |
Beleidsadviseur ApneuVereniging (onbetaald) |
- |
- |
- |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van een patiëntenvereniging, de ProstaatKankerStichting, in de werkgroep te laten participeren.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie ook het implementatieplan).
De richtlijn is opgenomen in de richtlijnendatabase waarmee hij toegankelijk is voor alle relevante beroepsgroepen en patiënten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org), dat een internationaal breed geaccepteerd instrument is voor de beoordeling van de kwaliteit van richtlijnen. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur mogelijke knelpunten. Tevens werden betrokken partijen uitgenodigd op de Invitational conference om knelpunten aan te dragen. Een verslag hiervan is opgenomen onder aanverwante producten. Tenslotte zijn de modules van de richtlijn uit 2010 beoordeeld of een update nodig was.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter, de vicevoorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn vervolgens verder uitgewerkt door de leden van de werkgroep en tijdens de werkgroepvergadering vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Voor iedere uitgangsvraag werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading of Recommendations Assessment, Development and Evaluation (zie www.gradeworkinggroup.org).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek.
Bij interventievragen verwijst de conclusie niet naar een of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op voor elke interventie. Bij het opmaken van de balans werden door de werkgroep de gunstige en ongunstige effecten voor de patiënt afgewogen. Wanneer er voor een uitgangsvraag geen systematisch literatuuronderzoek werd verricht, is de literatuur niet beoordeeld op kwaliteit en is de kracht van het bewijs niet bepaald.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. Bij het formuleren en graderen van de aanbeveling worden minimaal de volgende vier factoren in ogenschouw genomen: algehele kwaliteit van het wetenschappelijke bewijs; balans tussen voor- en nadelen van de interventie; waarden en voorkeuren van professional en patiënten; en beschikbare middelen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
De werkgroep heeft een procesindicator opgesteld om te bepalen welk percentage patiënten dat start met CPAP-behandeling binnen zes weken een vervolgafspraak heeft in het ziekenhuis (zie indicatoren). Dit zou de begeleiding en uiteindelijk de therapietrouw ten goede moeten komen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html. 2012.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.