Intracranieel Meningeoom - Pathologie
Uitgangsvraag
Aanbeveling
De werkgroep is van mening dat voor de histopathologische beoordeling van een meningeoom de meest recente classificatie (i.e. WHO 2007 classificatie) dient te worden gebruikt.
De werkgroep is van mening dat voor de histopathologische beoordeling van een meningeoom een ruime hoeveelheid tumorweefsel histopathologisch onderzocht moet worden en dat hierbij speciaal aandacht moet worden besteed aan het oppervlak van de tumor in verband met vaststellen van eventuele ingroei in hersenweefsel. Hierbij moet rekening gehouden worden met interpretatieverschillen wat betreft de beoordeling van onder andere het aantal mitosen, het histologisch subtype en het al dan niet bestaan van ingroei van het meningeoom in hersenweefsel.
De werkgroep is van mening dat een beoordelend patholoog bij twijfel over de histologische WHO gradering van een meningeoom, deze twijfel deelt met klinische collega's tijdens het multidisciplinair neuro-oncologie overleg. Hierbij worden eventuele therapeutische consequenties besproken van de WHO graad van het meningeoom, waarbij zo nodig medebeoordeling wordt gevraagd aan een ervaren collega-(neuro)patholoog gespecialiseerd in de neuro-oncologische diagnostiek.
De werkgroep is van mening dat in de dagelijkse praktijk moleculaire diagnostiek nog geen plaats heeft bij de pathologische beoordeling van meningeomen.
Overwegingen
Bij deze module zijn geen overwegingen beschreven.
Onderbouwing
Conclusies
De histologische gradering van meningeomen is gebaseerd op de WHO 2007 classificatie.
Louis 2007 (4)
De WHO graad van een meningeoom is significant gecorreleerd met zowel de progressie-vrije overleving als de totale overleving.
Perry 1997 (1); Mawrin 2010 (2)
Het is moeilijk meningeomen eenduidig te graderen om de volgende redenen:
- verschil in aangeleverde hoeveelheid tumorweefsel en hoe secuur deze wordt onderzocht
- interpretatie van de waarde van één enkel versus meerdere gebiedjes met verhoogd mitosegetal
- ontbreken van definitie van vereiste fractie van bepaald histologisch subtype voor hogere gradering
- interpretatieverschillen over histologische kenmerken (hoge celrijkdom, kleincellige component, etc.)
- interpretatieverschillen over ingroei in hersenweefsel
- behandeling voorafgaand aan resectie met invloed op beoordeling maligniteitsgraad tumor
Ondanks dat er de afgelopen jaren afwijkende genen/eiwitten ontdekt zijn die betrokken zijn bij het ontstaan en de progressie van meningeomen heeft dit tot nu toe in de dagelijkse praktijk nog niet geleid tot invoering van moleculaire testen met diagnostische, prognostische of predictieve waarde voor patiënten met een meningeoom.
Mawrin 2010 (2)
Samenvatting literatuur
Histopathologie
De huidige indeling van meningeomen is gebaseerd op de WHO 2007 classificatie. In deze classificatie worden meningeomen histopathologisch getypeerd en gegradeerd om op basis daarvan een indicatie te kunnen geven over het te verwachten biologisch gedrag. De WHO classificatie onderscheidt drie (maligniteits)graden van het meningeoom: WHO graad I (‘benigne', ruim 90% van de tumoren), WHO graad II (‘atypisch', 5-7%), WHO graad III (‘anaplastisch' of ‘maligne', 1-2%). Hierbij moet worden opgemerkt dat volgens sommige auteurs een atypisch meningeoom niet helemaal synoniem is met WHO graad II meningeoom. Zo hoeft een meningeoom dat ingroei vertoont in het hersenparenchym en daardoor in WHO graad II categorie valt, er histologisch niet atypisch uit te zien. In vergelijking met een WHO graad I meningeoom heeft een patiënt met een WHO graad II meningeoom niet alleen een ongeveer 8 acht keer zo grote kans op recidief tumor, maar ook een significant hoger risico op eerder overlijden (1). Patiënten met een WHO graad III meningeoom hebben ook een sterk verhoogde kans op overlijden door de tumor, niet zelden al binnen twee jaar na het stellen van de diagnose (2).
Er wordt een groot aantal histologische subtypes van het meningeoom herkend (zie ook tabel 1). De meest frequente histologische subtypes van meningeoom zijn het meningotheliomateuze, het fibroblastaire en het transitionele subtype. Meestal heeft het subtype niet direct betekenis voor de inschatting van de maligniteitsgraad. Sommige subtypes zijn echter geassocieerd met meer agressief gedrag en worden op grond daarvan getypeerd als WHO graad II of III meningeoom.
Bij één of meer van de volgende pathologische kenmerken wordt de diagnose WHO graad II meningeoom gesteld:
- 4 tot < 20 mitosen per 1,6 mm2 a)
- aanwezigheid van drie of meer van de volgende vijf criteria: patroonloze groeiwijze, hoge celrijkdom, kleincellig fenotype, macronucleoli, niet-therapie geïnduceerde necrose
- heldercellig of chordoid subtype
- ingroei in hersenweefsel
De diagnose WHO graad III meningeoom wordt gesteld indien 1 of meer van de volgende pathologische criteria aanwezig zijn:
- 20 of meer mitosen per 1,6 mm2
- apert maligne cytologisch/histologisch beeld (beeld gelijkend op carcinoom, hoog-maligne sarcoom of melanoom)
- papillair of rhabdoid subtype
a) Mitosetelling werd in de oorspronkelijke studie van Perry et al. in 10 High Power Fields (HPFs) van elk 0,16 mm2 bij 400x vergroting uitgevoerd (1). Een HPF kan echter per microscoop verschillen. Daarom is in de WHO classificatie 2007 gekozen voor een nieuwe maat: het aantal mitosen per 1,6 mm2 in plaats van HPF. Deze maat is reproduceerbaar voor elke microscoop. Vooral bij studies gepubliceerd vóór 2007 zijn de opgegeven mitosen aantallen niet geheel vergelijkbaar met elkaar.
Tabel 1. Samengevat naar WHO 2007 classificatie van meningeomen (3)
|
WHO classificatie meningeomen |
|||
|
|
WHO graad I |
WHO graad II (‘atypisch meningeoom') |
WHO graad III (‘anaplastisch of maligne meningeoom') |
|
frequentie |
ruim 90% |
5-7% |
1-2% |
|
histologische |
per 1,6mm2 |
bij 1 of meer van de volgende kenmerken:
* aanwezigheid van drie of meer van de volgende vijf criteria: - patroonloze groeiwijze - hoge celrijkdom - kleincellig fenotype - macronucleoli, - niet-therapie geïnduceerde necrose;
*heldercellig of chordoid subtype (indien >50% van de tumor dit fenotype toont) |
bij 1 of meer van de volgende kenmerken:
* 20 of meer mitosen per 1,6 mm2 * apert maligne cytologisch/histologisch beeld (beeld gelijkend op carcinoom, hoog-maligne sarcoom of melanoom);
|
|
histologisch |
● meningotheliaal |
zoals bij graad I, maar ook: ● heldercellig
|
zoals bij graad I: maar ook: ● rhabdoid |
|
herseningroei |
geen (tumor mag wel infiltreren in dura, veneuze sinussen, bot of extracraniële weke delen) |
kan aanwezig zijn (indien aanwezig voldoende voor graad II) |
kan aanwezig zijn |
NB De diagnose WHO graad II meningeoom wordt gesteld indien aan ten minste één van de criteria in de categorieën ‘Mitosen', ‘Histologische kenmerken', ‘Histologisch subtype' of ‘Ingroei in hersenen' is voldaan. Voor de diagnose WHO graad III meningeoom geldt hetzelfde, alleen is ingroei in hersenen op zichzelf geen reden om de tumor als een WHO graad III meningeoom te beschouwen Mitosen worden bepaald in Hematoxyline-Eosine gekleurde coupes. Een Ki-67/MIB-1 kleuring kan gebruikt worden om te achterhalen of een meningeoom veel ‘proliferatiever' is dan verwacht in geval van een WHO graad I meningeoom (proliferatie-index meestal <4%). Mede vanwege inter-laboratorium variatie in de uitvoering van de kleuring en het ontbreken van eenduidige cut-off levels is de Ki-67/MIB-1 labeling-index volgens de vigerende WHO classificatie (nog) geen doorslaggevend criterium om een meningeoom in een hogere maligniteitscategorie te plaatsen.
Interobserver variabiliteit bij gradering meningeomen volgens WHO classificatie 2007
Hoewel het WHO classificatiesysteem voor het graderen van meningeomen gebaseerd is op een grondige analyse van een groot aantal patiënten met een meningeoom en misschien vrij eenduidig lijkt, is het in de dagelijkse praktijk toch soms lastig om een meningeoom eenduidig te graderen. Zo is de kans op het vinden van voldoende mitosen of ingroei in hersenweefsel als teken van een WHO graad II meningeoom groter naarmate meer tumorweefsel wordt aangeleverd en secuur histopathologisch wordt onderzocht. Daarbij kan de vraag worden gesteld of een enkel gezichtsveld met meer dan vier mitosen per 1,6 mm2 in een ruime hoeveelheid tumorweefsel wel een zelfde connotatie heeft als het gemakkelijk vinden van meer dan vier mitosen op verschillende plaatsen in de tumor. Evenmin is precies gedefinieerd wat de minimum-vereisten zijn voor het herkennen van een bepaald histologisch subtype en voor de fractie waarin dit subtype aanwezig moet zijn om de tumor in te schatten als WHO graad II (in geval van heldercellige of chordoïde variant) of als WHO graad III (in geval van papillaire of rhabdoide variant). Gesteld wordt wel dat indien meer dan 50% van de tumor uit een dergelijk subtype bestaat aan de tumor een hogere maligniteitsgraad kan worden toegekend. Indien de fractie minder dan 50% bedraagt wordt geadviseerd dit subtype wel te benoemen (e.g. ‘meningeoom met focaal rhabdoide kenmerken, WHO graad I') omdat de aanwezigheid zou kunnen wijzen op agressiever gedrag, maar dit is niet onomstotelijk bewezen. Zo is het ook de vraag wanneer precies sprake is van voldoende hoge celrijkdom, kleincellige component, prominente macronucleoli, of gebrek aan patroon in groeiwijze om mee te tellen voor de diagnose WHO graad II meningeoom. Behandeling voorafgaand aan resectie (e.g. bestraling, embolisatie) kan het onderscheid tussen ‘spontane' en therapie-geïnduceerde necrose lastig maken en zo een vertroebelend effect hebben op de beoordeling van de maligniteitsgraad van de tumor. Verder kan het door onder andere fragmentatie van het uitgenomen materiaal lastig zijn om ondubbelzinnige ingroei van meningeoom in hersenweefsel (met doorbraak van pia mater) te onderscheiden van enige ingroei in ruimte van Virchow-Robin zonder intraparenchymateuze groei in het hersenweefsel. De neurochirurg kan een belangrijke bijdrage leveren aan de beoordeling van ingroei in hersenweefsel door de patholoog in geval van een ‘lastig klievingsvlak' met hersenen tijdens operatie dit expliciet te vermelden bij de aanvraag voor pathologisch onderzoek en zo mogelijk ook het betreffende gebied in het aangeleverde materiaal te markeren.
Ten slotte: voordat de WHO gradering van meningeomen ingevoerd werd, werden andere graderingssystemen toegepast. Dit betekent dat een in het verleden toegekende maligniteitsgraad niet zomaar correspondeert met dezelfde graad in de WHO 2007 classificatie.
Moleculaire pathologie
In de afgelopen jaren is veel informatie beschikbaar gekomen over moleculaire afwijkingen die ten grondslag liggen aan of geassocieerd zijn met maligne progressie van meningeomen. Het neurofibromatosis 2 (NF2) gen op chromosoom 22q, een tumor-suppressor gen dat codeert voor het eiwit merlin/schwannomin (behorend tot de 4.1 eiwit familie), is relatief vaak aangedaan: in 40-70% van de sporadische en bijna alle NF2-geassocieerde meningeomen wordt loss of heterozygosity (LOH) gevonden van 22q12, i.e. de regio waarop dit gen zich bevindt. Daarnaast wordt in 60% van de tumoren een 2e hit gevonden van het NF2-gen in de vorm van een mutatie. Er is geen opvallend verschil in frequentie van NF2-mutaties tussen WHO graad I, II en III meningeomen. Wel komen deze mutaties duidelijk vaker voor in het fibroblastaire, transitionele en psammomateuze subtype dan in het meningotheliomateuze en secretoire subtype meningeomen. Ook van andere genen op de chromosoom 22q arm (BAM22, BCR, TIMP3) is gerapporteerd dat zij een rol kunnen spelen bij de initiatie (e.g. TIMP3) of progressie van meningeomen. Daarnaast zijn er sterke aanwijzingen dat bij het ontstaan en/of de progressie van meningeomen genen betrokken zijn die coderen voor andere eiwitten behorend tot de ‘4.1 eiwit familie' (i.e. de eiwit-familie die bijdraagt aan de connectie tussen membraaneiwitten en het cytoskelet; bijvoorbeeld DAL1 en eiwit 4.1R) of voor eiwitten behorend tot de 14-3-3 groep (i.e. een groep van celgroei-regulerende eiwitten waarmee de 4.1 eiwitten interacteren). Op cytogenetisch niveau zijn zowel bepaalde ‘losses' als ‘gains' van delen van een chromosoom geassocieerd met een atypisch of anaplastisch meningeoom (‘losses': 1p, 6q, 9p, 10, 14q, 18q; ‘gains': 1q, 9q, 12q, 15q, 17q, 20q). Vermoedelijk speelt wat betreft het 9p verlies een verstoorde werking van de tumor-suppressor genen op chromosoom 9p21 als CDKN2A (p16INK4a), p14ARF en/of CDKN2B (p15INK4b) een rol. Ook defecten in de intracellulaire signaalroutes zoals de beta-catenine/wnt en hedgehog signaalroutes leveren vermoedelijk een bijdrage aan de oncogenese en/of maligne progressie van (een deel van de) meningeomen (2).
Al deze informatie heeft tot nu toe in de dagelijkse praktijk nog niet geleid tot invoering van moleculaire testen met diagnostische, prognostische of predictieve waarde voor patiënten met een meningeoom. Desondanks is te verwachten dat in de nabije toekomst moleculaire diagnostiek, gericht op detectie van bepaalde moleculaire afwijkingen of DNA profielen van een meningeoom, behulpzaam zal gaan zijn bij de voorspelling van het biologisch gedrag van een meningeoom (2).
Referenties
- 1 - Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. Meningioma grading: an analysis of histologic parameters. Am J Surg Pathol 1997 Dec;21(12):1455-1465.
- 2 - Mawrin C, Perry A. Pathological classification and molecular genetics of meningiomas. J Neurooncol 2010 Sep;99(3):379-391.
- 3 - Louis D, Scheithauer B, Budka H, von Deimling A, Kepes J. Meningiomas. Pathology and genetics of tumours of the nervous system. In: Kleihues P, Cavenee W, editors. World Health Organization classification of tumours Lyon: IARC Press; 2000. p. 176-184.
- 4 - Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007 Aug;114(2):97-109.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 04-01-2015
Laatst geautoriseerd : 04-01-2015
Geplande herbeoordeling :
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal 5 jaar na vaststelling) wordt vanuit IKNL bewaakt.
Ook de Landelijke Werkgroep Neuro-Oncologie (LWNO) toetst jaarlijks de actualiteit van de richtlijn. Het bestuur van de landelijke werkgroep draagt de verantwoordelijkheid om de behoefte voor herziening van de huidige richtlijn bij de beroepsgroepen te peilen. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. Als dat aan de orde is, verzoekt de LWNO de meest bij het desbetreffende onderwerp betrokken vereniging[en] de revisie te financieren, bijvoorbeeld door middel van een hierop gericht beroep op SKMS gelden. Uiterlijk in 2018 zal een nieuwe multidisciplinaire werkgroep worden geïnstalleerd om de richtlijn te reviseren.
Algemene gegevens
In 2011 heeft de Landelijke Werkgroep Neuro-Oncologie (LWNO) het Integraal Kankercentrum Nederland (IKNL) verzocht om een richtlijn Meningeoom te ontwikkelen. Naar aanleiding hiervan is een landelijke richtlijnwerkgroep Meningeoom opgericht. De multidisciplinaire werkgroep is in juli 2012 gestart met de ontwikkeling van de richtlijn Meningeoom. IKNL zorgde voor methodologische begeleiding en secretariële ondersteuning van het proces.
Naast de autoriserende verenigingen heb de volgende verenigingen ingestemd met de inhoud:
Nederlandse Vereniging van Meningeoom Patiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)
Patiëntenvereniging Cerebraal (via Leven met Kanker Beweging (voorheen NFK)
Doel en doelgroep
Doelstelling
De richtlijn is een document met aanbevelingen ter ondersteuning van de praktijkvoering van zorgverleners die betrokken zijn bij patiënten met een intracranieel meningeoom. De aanbevelingen zijn gebaseerd op een zo hoog mogelijke graad van wetenschappelijk bewijs en consensus binnen de werkgroepleden. De richtlijn biedt de gebruikers inzicht in het tot stand komen van de aanbevelingen. Uitgangspunt zijn de knelpunten die in de dagelijkse praktijk bij patiënten met een intracranieel meningeoom worden gesignaleerd.
Doel van de richtlijn
Het verbeteren van de kwaliteit van zorg voor volwassen patiënten met een meningeoom. De richtlijn behelst het traject van diagnostiek, behandeling, voorlichting en begeleiding van patiënten met een intracranieel meningeoom. De richtlijn beoogt hiermee de kwaliteit van de zorgverlening te verbeteren, het klinisch handelen meer te baseren op bewijs dan op ervaringen en meningen, de transparantie van keuze voor behandelingen te vergroten en de diversiteit van handelen door professionals te verminderen.
De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en biedt aanknopingspunten voor transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, klinische besluitvorming, behandeling en begeleiding van patiënten met een intracranieel meningeoom, zoals neurologen, neurochirurgen, radiotherapeuten, (neuro)pathologen, (neuro)radiologen, klinisch genetici, revalidatieartsen, huisartsen, psychologen, neuro-oncologieverpleegkundigen en verpleegkundig specialisten.
Deze richtlijn is primair geschreven voor bovenstaande (groepen) professionals en daardoor mogelijk minder makkelijk leesbaar voor patiënten. KWF Kankerbestrijding geeft patiëntenbrochures uit, die gebaseerd zijn op door IKNL gepubliceerde richtlijnen. Zie voor meer patiënteninformatie de folder ‘Hersentumoren’ van KWF en de website www.hersentumor.nl.
Doelpopulatie
De doelpopulatie betreft patienten van 18 jaar en ouder met een intracranieel meningeoom.
Samenstelling werkgroep
Alle werkgroepleden zijn afgevaardigd namens een wetenschappelijke, beroeps- of patiëntenvereniging en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is getracht rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
De Nederlandse Vereniging van Meningeoompatiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)) is eveneens vertegenwoordigd door middel van afvaardiging van de voorzitter van de patiëntenvereniging, alsmede een ervaringsdeskundige vanuit de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) afkomstig van Vereniging Cerebraal.
De volgende (para)medische disciplines zijn in de werkgroep vertegenwoordigd:
- neurologie
- neurochirurgie
- radiotherapie
- (neuro)pathologie
- neuroradiologie
- neuropsychologie
- revalidatie
- verpleegkunde
Leden van de werkgroep
- Mw. dr. D. Brandsma, neuroloog Nederlands Kanker Instituut / Antoni van Leeuwenhoekziekenhuis en Slotervaartziekenhuis, Amsterdam, voorzitter
- Mw. drs. N.D.B. Gilhuijs, (neuro)patholoog, Westfries Gasthuis, Hoorn
- Dhr. Prof.dr. R.J.M. Groen, neurochirurg, UMCG, Groningen
- Mw. drs. E.J.J. Habets, psycholoog, MC Haaglanden, Den Haag
- Mw. drs. P. Hoenderdaal, patiëntvertegenwoordiger Vereniging Cerebraal
- Mw. dr. A.A. Jacobi - Postma, neuroradioloog MUMC+, Maastricht
- Mw. dr. A. Mendez Romero, radiotherapeut-oncoloog, Erasmus MC, Rotterdam
- Dhr. drs. C.G.J.H. Niël, radiotherapeut-oncoloog, RISO, Deventer
- Mw.dr. S.M. Peerdeman, neurochirurg, VUmc, Amsterdam
- Mw. H. Petersen - Baltussen, nurse practitioner neurochirurgie, Radboud Universitair Medisch Centrum, Nijmegen
- Mw. drs. V.P.M. Schepers, revalidatiearts, UMCU, Utrecht
- Dhr. dr. T.J. Snijders, neuroloog, UMCU, Utrecht
- Dhr. H. van Valkenburg, patiëntvertegenwoordiger
- Dhr. Prof.dr. P. Wesseling, (neuro)patholoog Radboud Universitair Medisch Centrum, Nijmegen, VUmc, Amsterdam
- Mw. J.M.C. Zwinkels, verpleegkundig specialist NO, MC Haaglanden, Den Haag
Dhr. Dr. F.J. Hes, klinisch geneticus, Leids Universitair Medisch Centrum (LUMC), Leiden, heeft een bijdrage geleverd aan de tekst over genetische syndromen.
Ondersteuning
Medewerkers van het IKNL waren verantwoordelijk voor de procesbegeleiding en secretariële ondersteuning.
- Mw. drs. E.J.A Verhoof, procesbegeleider IKNL, locatie Utrecht
- Mw. M.L. van de Kar-van der Meulen, secretariële ondersteuning werkgroep Meningeoom, IKNL, locatie Utrecht
Literatuuronderzoek
Het literatuuronderzoek en het opstellen van de concept conclusies voor het evidence based gedeelte werd uitgevoerd door dr. J. Vlayen [Medical Evaluation & Technology Assessment, ME-TA, België], en mw. dr. L. Veerbeek [IKNL].
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke verenigingen.
Alle werkgroepleden hebben bij aanvang en bij de afronding van het richtlijn traject een belangenverklaring ingevuld. Hiermee geven de werkgroepleden aan onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Potentiële conflicterende belangen zijn door middel van ondervraging van de werkgroepleden opgespoord en besproken. De bevindingen zijn schriftelijke vastgelegd in de belangenverklaring en opvraagbaar via oncoline@iknl.nl.
Daarnaast is conceptrichtlijn ter becommentariëring aangeboden op www.oncoline.nl en aan alle voor de knelpuntenanalyse benaderde wetenschappelijke, beroeps- en patiëntenverenigingen. De werkgroep heeft het commentaar verwerkt waarna de richtlijn door alle relevante betrokken partijen is geautoriseerd
Inbreng patiëntenperspectief
Twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep (één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling). Bij de ontwikkeling van deze richtlijn is tijdens alle fasen gebruik gemaakt van de input van deze patiëntvertegenwoordigers. Deze input is nodig voor de ontwikkeling van een kwalitatief goede richtlijnen. Een goede behandeling voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande methoden is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject is een patiëntenversie van de enquête voor het inventariseren van knelpunten in de zorg voor patiënten met een meningeoom uitgezet bij leden van de NVMP.
- Tijdens het richtlijntraject heeft een gesprek plaatsgevonden waarbij de patiëntvertegenwoordigers, de verpleegkundigen, de neuropsycholoog, de procesbegeleider en de voorzitter aanwezig waren om het patiëntenperspectief te inventariseren met behulp van het ICF-model. Het gesprek vond plaats ten tijde van het literatuuronderzoek van de evidence based uitgangsvragen. Hierdoor kon het patiëntperspectief worden meegenomen in de overige overwegingen bij het bespreken van de conclusies die volgden uit het literatuuronderzoek. De gestructureerde inventarisatie maakte de bijdrage vanuit het patiëntperspectief inzichtelijk en is vooral terug te vinden in de overige overwegingen en in de aanbevelingen.
- De NVMP en Vereniging Cerebraal zijn geconsulteerd in de externe commentaarronde.
Inventarisatie patiëntenperspectief middels het ICF-model
Het patiëntenperspectief is geïnventariseerd door de invloed van het hebben/hebben gehad van een meningeoom op het gehele leven, in al de dimensies van het ICF-model, te beschrijven.
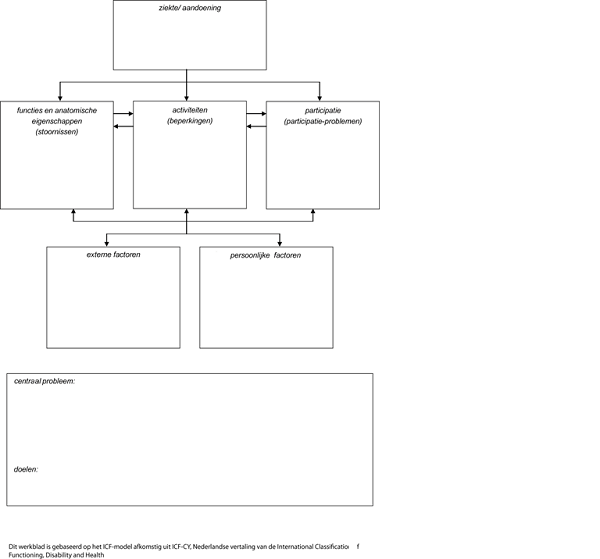
Ziekte/aandoening: mogelijkheden en beperkingen t.a.v.:
- Mentale functies
- Sensorische functies en pijn
- Stem en spraak
- Functies van hart en bloedvatenstelsel, hematologisch systeem, afweersysteem en ademhalingsstelsel
- Functies van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Functies van urogenitaal stelsel en reproductieve functies
- Functies van bewegingssysteem en aan beweging verwante functies
- Functies van huid en verwante structuren
Mogelijkheden en beperkingen door de ziekte/aandoening voor patiënten met een meningeoom: medisch inhoudelijke zaken worden reeds in de richtlijn beschreven.
Functies en anatomische eigenschappen: mogelijkheden en beperkingen t.a.v.:
- Anatomische eigenschappen van zenuwstelsel
- Anatomische eigenschappen van oog, oor en verwante structuren
- Anatomische eigenschappen van structuren betrokken bij stem en spraak
- Anatomische eigenschappen van hart en bloedvatenstelsel, afweersysteem en ademhalingsstelsel
- Anatomische eigenschappen van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Anatomische eigenschappen van urogenitaal stelsel
- Anatomische eigenschappen van structuren verwant aan beweging
- Anatomische eigenschappen van huid en verwante structuren
Mogelijkheden en beperkingen van functies en anatomische eigenschappen voor patiënten met een meningeoom:
- Epilepsie
- Vermoeidheid
- Cognitie
- Focale neurologische uitvalverschijnselen
- (Hoofd)Pijn
- Veranderingen van persoonlijkheid, emotie en gedrag
Activiteiten en participatie: mogelijkheden en beperkingen t.a.v.:
- Leren en toepassen van kennis
- Algemene taken en eisen
- Communicatie
- Mobiliteit
- Zelfverzorging
- Huishouden
- Tussenmenselijke interacties en relaties
- Belangrijke levensgebieden
- Maatschappelijk, sociaal en burgerlijk leven
Mogelijkheden en beperkingen van activiteiten en participatie voor patiënten met een meningeoom:
- Intermenselijke interactie en relaties
- Communicatie en mobiliteit
- Onderhouden van relaties
- Financiële afhankelijkheid
- Werkrelaties
- ADL
- Oudertaken
- Huishoudelijke taken
- Participatieproblemen
- Vrijetijdsbesteding
- Autorijden
- In een vliegtuig zitten
Externe factoren: mogelijkheden en beperkingen t.a.v.:
- Producten en technologie
- Natuurlijke omgeving en door de mens aangebrachte veranderingen daarin
- Ondersteuning en relaties
- Attitudes
- Diensten, systemen en beleid (bijv. binnen de maatschappij of gezondheidszorg)
Mogelijkheden en beperkingen van externe factoren voor patiënten met een meningeoom:
- Sociale omgeving
- Maatschappelijk functioneren
- Rol in gezin en relaties
- Beperkte toegankelijkheid van professionele hulp. Oorzaak hiervan is onvoldoende bekendheid met het aanbod en de beperkte vergoedingen van de verzekeraar
- Nazorgmogelijkheden voor partner zijn beperkt (i.v.m. vergoeding verzekeraar)
- UWV, Jobcoach
- Toegang tot nazorg/revalidatie is soms complex
De deelnemers aan de telefonische vergadering geven het volgende aan:
Wanneer er geen primaire revalidatie-indicatie is, is nazorg (te) beperkt, omdat de restverschijnselen niet gezien worden door zorgverleners. Met name de cognitieve beperkingen worden niet voldoende herkend. Screening gericht op cognitieve functies zouden hiervoor uitgevoerd moeten worden. Ook de patiënt en diens omgeving herkennen cognitieve dysfunctie pas op een later moment.
Na een half en een heel jaar postoperatief zou screening op cognitieve verschijnselen moeten plaatsvinden. Preoperatieve screening zou i.v.m. onderzoeksdoeleinden waardevol kunnen zijn. Een screeningsinstrument dat ingezet kan worden (als hulpmiddel): CLCE (niet gevalideerd). Het heeft mogelijk de voorkeur om een instrument te kiezen dat door de patiënt zelf wordt ingevuld, i.v.m. efficiëntie. Zorgverlener kan de patiënt daarnaast actief aanspreken om kritisch naar het eigen functioneren te kijken en de patiënt bewust te maken van eventuele uitvalsverschijnselen, om daar vervolgens passende ondersteuning/nazorg bij te bieden.
Persoonlijke factoren: mogelijkheden en beperkingen t.a.v.:
- factoren binnen het individu
Niet besproken
Patiëntenperspectief bij de vijf evidence based uitgangsvragen:
-
Bij het maken van een keuze voor de behandeling is rekening houden met wat de invloed is van het meningeoom op het functioneren. Ondanks dat er sprake is van een asymptomatisch meningeoom is het belangrijk te realiseren dat patiënten heel verschillend om kunnen gaan met het feit dat er een tumor in het hoofd is gediagnosticeerd. De patiënt moet een beeld geschetst worden wat de gevolgen zijn van wel/niet behandelen. De psychische gesteldheid moet worden meegewogen in de keuze voor het wel/niet behandelen.
-
De keuzes voor behandeling zijn vooral medisch ingegeven. De patiënt moet wel goed geïnformeerd worden over de gevolgen van therapie zoals chirurgie en radiotherapie. Er is weinig landelijk voorlichtingsmateriaal voor deze specifieke doelgroep beschikbaar. In de richtlijn kan opgenomen worden dat de patiënt bij het bespreken van het behandelplan een mantelzorger dient mee te nemen.
-
De keuze voor aanvullende radiotherapie is vooral medisch ingegeven. Omdat er sprake is van een lage bewijskracht, is het nut van aanvullende radiotherapie niet geheel duidelijk. Hierdoor is er mogelijk meer ruimte voor de wens van de patiënt bij het vaststellen van het behandelplan, echter zal de uiteindelijke keuze met name van de arts afhankelijk zijn en is het aan de arts de voor- en nadelen duidelijk te bespreken met de patiënt.
-
Een duidelijke uitleg moet gegeven worden over de wijze en frequentie van follow-up bij een meningeoom. De patiënt moet goed geïnstrueerd worden bij welke klachten met welke zorgverlener contact opgenomen moet worden. De zorgverlener moet in het gehele (na)zorgtraject expliciet aandacht hebben voor angst, onzekerheid en depressie en zorgdragen voor adequate doorverwijzing.
-
Herhaaldelijke screening op neuropsychologische klachten is wenselijk. Hoe en door wie deze screening plaats moet vinden kan per centrum bepaald worden. Op indicatie kan een neuropsychologisch onderzoek uitgevoerd worden. Neuropsychologisch onderzoek kan van waarde zijn bij begeleiding bij re-integratie in het arbeidsproces.
Methode ontwikkeling
Consensus based
Implementatie
Het bevorderen van het gebruik van de richtlijn begint met een brede verspreiding van de richtlijn. Er wordt een mailing verstuurd onder de professionals via de (wetenschappelijke) verenigingen en de werkgroepen van IKNL. Ook is de richtlijn gepubliceerd op www.oncoline.nl/richtlijn Intracranieel Meningeoom. Tevens zal er een artikel of manuscript ter publicatie aangeboden worden aan het Nederlands Tijdschrift voor Geneeskunde. Ook in andere tijdschriften of bij bijvoorbeeld nascholingsbijeenkomsten wordt de richtlijn onder de aandacht gebracht. Om het gebruik in de dagelijkse praktijk te bevorderen zal er een samenvattingskaart van de richtlijn gemaakt worden. Daarnaast beschikt IKNL over een toolbox ter ondersteuning van de IKNL adviseurs netwerken c.q. professionals in het veld voor de implementatie van de richtlijn. De toolbox bevat:
-
Een overzicht van de aanbevelingen.
-
De kernboodschappen (belangrijkste inhoudelijke boodschappen).
-
Een basis PowerPointpresentatie voor IKNL adviseurs netwerken en werkgroepleden van deze richtlijn.
-
Een implementatieplan voor deze richtlijn (incl. indicatoren voor evaluatie van de richtlijn). Dit plan bevat voor de belangrijkste aanbevelingen uit de richtlijn een overzicht van belemmerende en bevorderende factoren voor de implementatie. Op basis hiervan beschrijft het plan de belangrijkste doelgroepen en (adviezen voor) concrete acties om implementatie te bevorderen.
- Een training aan de IKNL adviseurs netwerken.
Werkwijze
Werkwijze
De richtlijnwerkgroep bestaat uit zorgverleners van verschillende (para)medische disciplines (bijlage 1). Ook twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep: één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling. Een overzicht van alle leden van de werkgroep is opgenomen in bijlage 2.
De werkgroep is op 11 juli 2012 voor de eerste maal bijeengekomen. Op basis van een eerste inventarisatie van de knelpunten door de werkgroepleden is, door middel van een enquête onder professionals die betrokken zijn bij patiënten met een meningeoom, een knelpunteninventarisatie gehouden. Na het versturen van de enquête hebben 168 professionals gerespondeerd en knelpunten geprioriteerd en/of ingebracht. De meest relevante knelpunten zijn uitgewerkt tot vijf uitgangsvragen (bijlage 11) die evidence based zijn uitgewerkt.
Voor iedere uitgangsvraag werd uit de richtlijnwerkgroep een subgroep geformeerd.
Bij de evidence based beantwoording van de vijf uitgangsvragen verzorgde een externe methodoloog het literatuuronderzoek, in overleg met de betreffende subgroep. Dit betrof het uitvoeren van een systematische literatuursearch, het kritisch beoordelen van de literatuur en het verwerken van de literatuur in evidence tabellen (bijlage 9). Daarnaast werd door de methodoloog een concept literatuurbespreking met bijbehorende conclusies aangeleverd voor deze uitgangsvragen. De werkgroepleden stelden overige overwegingen en aanbevelingen op volgens de checklist ‘overige overwegingen en formuleren van aanbevelingen’ (bijlage 7).
Voor de consensus-based delen in de richtlijn raadpleegden de werkgroepleden zelf de relevante bestaande literatuur. Op basis hiervan hebben de werkgroepleden de conclusies, overige overwegingen en aanbevelingen geformuleerd. Voor de consensus based beantwoording is geen systematisch literatuuronderzoek verricht en zijn de artikelen niet methodisch beoordeeld door een externe methodoloog.
De werkgroep heeft gedurende een periode van 18 maanden gewerkt aan de tekst van de conceptrichtlijn. Alle teksten zijn tijdens plenaire en telefonische vergaderingen besproken en na verwerking van de commentaren door de werkgroep geaccordeerd.
