Initiële behandeling bij volwassenen met epilepsie
Uitgangsvraag
Wat is de initiële behandeling van een gegeneraliseerde convulsieve status epilepticus bij volwassenen?
Aanbeveling
Indien een intraveneuze toegangsweg beschikbaar is, gebruik bij voorkeur intraveneus lorazepam of intraveneus midazolam als initiële behandeling bij gegeneraliseerde convulsieve status epilepticus bij volwassenen.
Indien geen intraveneuze toegangsweg beschikbaar is, gebruik dan bij voorkeur midazolam nasaalintramusculair.
Gebruik intraveneus fenytoïne, intraveneus levetiracetam of intraveneus valproaat om een voortdurende convulsieve status epilepticus te couperen.
Volg het stroomschema, zie bijlage.
Overwegingen
In de literatuur analyse is gekeken naar de behandeling bij een gegeneraliseerde convulsieve status epilepticus bij volwassenen, hierbij werden vijf studies (waarvan twee systematic reviews, drie RCTs) gevonden. Een breed scala aan medicijnen worden in deze studies met elkaar vergeleken (bijvoorbeeld diazepam, lorazepam, fenytoïne, valproaat, levetiracetam). De studiepopulaties in de gevonden studies zijn relatief klein, met enkele methodologische beperkingen (risk of bias, inconsistentie, imprecisie). De bewijskracht van de literatuur is daardoor zeer laag voor de cruciale uitkomstmaat seizure cessation en zeer laag voor de cruciale uitkomstmaat termination of SE after drug administration. Dit betekent dat nieuwe studies kunnen leiden tot nieuwe inzichten. Derhalve kunnen er op basis van de literatuur geen sterke conclusies worden getrokken over welk middel het meest effectief is en de voorkeur heeft bij de initiële behandeling bij een gegeneraliseerde convulsieve status epilepticus bij volwassenen. Opsommingen van middelen in onderstaande tekst staan op alfabetische volgorde.
Eerstelijns behandeling
Bij de behandeling van een status epilepticus bestaat de eerstelijns behandeling uit een benzodiazepine. Zowel uit oudere als recente gerandomiseerde studies komt naar voren dat benzodiazepines effectiever zijn dan placebo in terminatie van een epileptische aanval (Alldredge, 2001; Spencer, 2020). Midazolam, lorazepam en diazepam zijn de meest onderzochte benzodiazepines, waarbij diverse toedieningsvormen onderzocht zijn. Diazepam intraveneus lijkt minder effectief dan lorazepam intraveneus (Kobata, 2020). In het geval dat er nog geen intraveneuze toegang is, heeft midazolam intramusculair de voorkeur boven lorazepam intraveneus, aangezien onnodig veel tijd verloren gaat aan het verkrijgen van een intraveneuze toegang (Silbergleit, 2012). Als een intraveneuze toegang wel beschikbaar is, kan gekozen worden voor midazolam of lorazepam. Relevant direct vergelijkend onderzoek tussen deze twee benzodiazepines ontbreekt, maar het is niet heel waarschijnlijk dat die middelen op klinische relevante wijze verschillen in effectiviteit bij de behandeling van een status epilepticus. Derhalve beschouwt de werkgroep midazolam als eerste keus benzodiazepine voor gebruik in het ziekenhuis (intraveneus, intramusculair, buccaal, of nasaal) en wanneer een intraveneuze toegangsweg beschikbaar is kan ook lorazepam intraveneus gebruikt worden.
In de Nederlandse situatie wordt clonazepam geregeld gebruikt als eerste keus benzodiazepine. Clonazepam heeft als nadeel dat het bij herhaald gebruik kan resulteren in stapeling in vetweefsel, omdat het vetoplosbaar is. Helaas is vrijwel geen literatuur beschikbaar over de werkzaamheid van clonazepam, hoewel in een observationele studie wel melding wordt gemaakt van vergelijkbare effectiviteit tussen clonazepam en midazolam (Alvarez, 2015). Vanwege het ontbreken van gerandomiseerde studies wordt dit middel vooralsnog niet als eerste keus benzodiazepine beschouwd.
In de situatie buiten het ziekenhuis kan gekozen worden voor midazolam neusspray of diazepam rectiole. Vanwege het mogelijke sociale ongemak door de toedieningswijze van diazepam rectiole lijkt midazolam neusspray wenselijker als keuzemiddel buiten het ziekenhuis. Maar vergelijkend onderzoek tussen deze twee toedieningsvormen ontbreekt en midazolam is slechts beperkt houdbaar.
Tweedelijns behandeling
De tweedelijns behandeling van een status epilepticus bestaat uit de toediening van een oplaaddosis van een anti-epilepticum. De werkzaamheid van de anti-epileptica fenytoïne, levetiracetam en valproaat werd onderzocht in een gerandomiseerde studie (Kapur, 2019). Er bleek geen verschil in effectiviteit in deze studie tussen de drie middelen. Er is derhalve geen voorkeur voor één van de drie middelen. Verdere onderbouwing hiervoor komt uit een meta-analyse met data uit enkele kleinere gerandomiseerde studies, waar eveneens geen verschil in effectiviteit werd gevonden tussen de drie middelen (Chu, 2020). De keuze voor één van de drie middelen kan deels bepaald worden door bepaalde (relatieve) contra-indicaties; valproaat wordt ontraden als onderhoudsbehandeling bij vrouwen in de vruchtbare leeftijd en ook bij patiënten met een (mogelijke) mitochondriële ziekte (EMA, 2018; Finsterer, 2010). Fenytoïne wordt ontraden bij bekende cardiale geleidingsstoornissen, zoals een sinusbradycardie, sinoatriaal blok, of tweede- en derdegraads AV-blok (Guldiken, 2016), hoewel in de gerandomiseerde studie van Kapur (2019) niet meer bijwerkingen werden gevonden in de groep patiënten die met fenytoïne werden behandeld (Kapur, 2019). Desondanks wordt geadviseerd om fenytoïne alleen te geven onder hartritmebewaking (Guldiken, 2016). Wanneer de convulsieve status epilepticus effectief is onderdrukt en men alleen snel wil opladen met een anti-epilepticum is fenytoïne geen voor de hand liggende keuze, omdat het geen eerste keus onderhouds-anti-epilepticum is.
Vooralsnog ontbreekt bewijs voor de effectiviteit van niet-medicamenteuze behandelingen van status epilepticus. In 2016 werd in een gerandomiseerde studie aangetoond dat geïnduceerde hypothermie gedurende 24 uur bij patiënten met status epilepticus niet geassocieerd was met een betere uitkomst na 90 dagen (Legriel, 2016).
Kosten (middelenbeslag)
Er zijn geen grote kostenverschillen in de verschillende typen benzodiazepines en anti-epileptica. Er zijn derhalve geen grote verschillen in directe kosten te verwachten. Momenteel zijn de meeste middelen niet gepatenteerd, waardoor de kosten van de middelen relatief laag zijn en geen groot aandeel vormen in de totale kosten van de behandeling. Er zijn geen economische evaluaties bekend met betrekking tot deze uitgangsvraag.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep is niet bekend met grote barrières in de praktijk op het gebied van aanvaardbaarheid, haalbaarheid en implementatie. Qua effectiviteit worden er geen grote verschillen tussen de beschikbare middelen gedetecteerd, dus naar verwachting zal voorkeur van de behandelende zorginstelling danwel het gebruikersgemak voor patiënten een rol spelen in de keuze voor middelen. Bij het toedienen van fenytoïne is het belangrijk dat mogelijkheden voor hartritmebewaking en adequate monitoring van vitale functies beschikbaar zijn, maar die zijn veelal standaard aanwezig in zorginstellingen. Vanwege frequente leveringsproblemen van de intraveneuze vorm van lorazepam in de afgelopen jaren is dit middel beperkt beschikbaar, maar met adequate beschikbaarheid van midazolam komt hiermee de zorg niet in het geding.
Figuur 1 Stroomschema: Behandeling status epilepticus bij volwassen in de ziekenhuissetting
Zie bijlage
Onderbouwing
Achtergrond
The International League Against Epilepsy (ILAE) task force on classification of status epilepticus defined ‘Convulsive Status Epilepticus’ (CSE) as a condition resulting either from the failure of the mechanisms responsible for seizure termination or from the initiation of mechanisms, which lead to abnormally and prolonged seizures (after time point t1; 5 minutes). CSE is a condition, which can have long-term consequences (after time point t2; 30 minutes), including neuronal death, neuronal injury, and alteration of neuronal networks, depending on the type and duration of seizures (Trinka, 2015). Initial treatment of a convulsive status epilepticus consists of first-line therapy with benzodiazepines, followed by second-line therapy with anti-epileptic drugs. Whereas evidence for first-line therapy with benzodiazepines is rather strong, large, randomized trials studying the effect of anti-epileptic drugs were lacking until 2019.
This module evaluates which initial treatment is most effective and beneficial for generalized convulsive status epilepticus in adults. This module contains an update of the module ‘Status Epilepticus bij volwassenen: initiële behandeling’ dated from June 2020 (including a search strategy dated from 1 January 2019).
Conclusies
1. Intravenous levetiracetam versus intravenous phenytoin
1.1. Seizure cessation (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam on seizure cessation when compared with phenytoin in adults with status epilepticus.
Sources: Chu, 2020 |
1.2. Termination of SE after drug administration (critical), 1.4. Requirement of ventilatory support (important), 1.5. Hypotension (important), 1.6. Length of stay (important)
| - GRADE | The outcome measures ‘termination of status epilepticus after drug administration’, and ‘requirement of ventilatory support’, ‘hypotension’, ‘length of stay’ were not graded.
Sources: - |
1.3. Mortality (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam on mortality when compared with phenytoin in adults with status epilepticus.
Sources: Chu, 2020 |
2. Intravenous levetiracetam versus intravenous valproate
2.1. Seizure cessation (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam on seizure cessation when compared with valproate in adults with status epilepticus.
Sources: Chu, 2020; Kapur, 2019 |
2.2. Termination of SE after drug administration (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam on termination of SE after drug administration when compared with valproate in adults with status epilepticus.
Sources: Chu, 2020; Kapur, 2019 |
2.3. Mortality (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam on mortality when compared with valproate in adults with status epilepticus.
Sources: Chu, 2020; Kapur, 2019 |
2.4. Requirement of ventilatory support (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam on the requirement for ventilatory support when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
2.5. Hypotension (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam on hypotension when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
2.6. Length of stay (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam on length of stay when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
3. Intravenous fosphenytoin versus intravenous valproate
3.1. Seizure cessation (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of fosphenytoin on seizure cessation when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
3.2. Termination of SE after drug administration (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of fosphenytoin on termination of SE after drug administration when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
3.3. Mortality (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of fosphenytoin on mortality when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
3.4. Requirement of ventilatory support (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of fosphenytoin on the requirement for ventilatory support when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
3.5. Hypotension (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of fosphenytoin on hypotension when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
3.6. Length of stay (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of fosphenytoin on length of stay when compared with valproate in adults with status epilepticus.
Source: Kapur, 2019 |
4. Intravenous lorazepam versus intravenous diazepam
4.1. Seizure cessation (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam on seizure cessation when compared with diazepam in adults with status epilepticus.
Source: Kobata, 2020 |
4.3. Mortality (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam on mortality when compared with diazepam in adults with status epilepticus.
Source: Kobata, 2020 |
4.4. Requirement of ventilatory support (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam on the requirement for ventilatory support when compared with diazepam in adults with status epilepticus.
Source: Kobata, 2020 |
4.5. Hypotension (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam on hypotension when compared with diazepam in adults with status epilepticus.
Source: Kobata, 2020 |
4.2. Termination of SE after drug administration (critical) and 4.6 Length of stay (important)
| - GRADE | The outcome measures ‘termination of se after drug administration’ and ‘length of stay’ were not graded.
Sources: - |
5. Intravenous levetiracetam versus intravenous lorazepam
5.1. Seizure cessation (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam on seizure cessation when compared with levetiracetam in adults with status epilepticus.
Source: Chu, 2020 |
5.2. Termination of SE after drug administration (critical), 5.3 Mortality (important), and 5.6 Length of stay (important)
| - GRADE | The outcome measures ‘termination of se after drug administration’, ‘mortality’, and ‘length of stay’ were not graded.
Sources: - |
5.4. Requirement of ventilatory support (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam on the requirement for ventilatory support when compared with levetiracetam in adults with status epilepticus.
Source: Chu, 2020 |
5.5. Hypotension (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam on hypotension when compared with levetiracetam in adults with status epilepticus.
Source: Chu, 2020 |
6. Intravenous lorazepam + intravenous valproate versus intravenous lorazepam + intravenous levetiracetam
6.1. Seizure cessation (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam + valproate on seizure cessation when compared with lorazepam + levetiracetam in adults with status epilepticus.
Source: Nene, 2019 |
6.2. Termination of SE after drug administration (critical), 6.4. Requirement of ventilatory support (important), 6.5. Hypotension (important)
| - GRADE | The outcome measures ‘termination of se after drug administration’, ‘requirement of ventilatory support’, and ‘hypotension’ were not graded.
Sources: - |
6.3. Mortality (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam + valproate on mortality when compared with lorazepam + levetiracetam in adults with status epilepticus.
Source: Nene, 2019 |
6.6. Length of stay (important)
| VERY LOW GRADE | The evidence is very uncertain about the effect of lorazepam + valproate on length of stay when compared with lorazepam + levetiracetam in adults with status epilepticus.
Source: Nene, 2019 |
7. Intravenous levetiracetam + clonazepam versus intravenous placebo + clonazepam
7.1. Seizure cessation (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam + clonazepam on seizure cessation after drug administration when compared with placebo + clonazepam in adults with status epilepticus.
Sources: Chu, 2020 |
7.2. Termination of SE after drug administration (critical), 7.4. Requirement of ventilatory support (important), and 7.5. Hypotension (important)
| - GRADE | The outcome measures ‘termination of se after drug administration’, ‘requirement of ventilatory support’, and ‘hypotension’ were not graded.
Sources: - |
7.3. Mortality (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam + clonazepam on mortality when compared with placebo + clonazepam in adults with status epilepticus.
Sources: Chu, 2020 |
7.6. Length of stay (critical)
| VERY LOW GRADE | The evidence is very uncertain about the effect of levetiracetam + clonazepam on length of stay when compared with placebo + clonazepam in adults with status epilepticus.
Sources: Chu, 2020 |
The conclusions below remain maintained (2020), as no new literature was found for the following comparisons:
intravenous diazepam vs. intravenous valproate
| VERY LOW GRADE | Er zijn beperkte aanwijzingen dat valproaat i.v. en diazepam i.v. een vergelijkbaar effect hebben op terminatie van een status epilepticus en op het opnieuw optreden van aanvallen. Het risico op hypotensie lijkt iets lager bij gebruik van valproaat.
Source: Chen, 2011 (from Prasad, 2014). |
intravenous diazepam + intravenous phenytoin vs. intravenous phenobarbital
| VERY LOW GRADE | Er zijn beperkte aanwijzingen dat behandeling met diazepam i.v. in combinatie met fenytoïne i.v. een vergelijkbaar effect heeft op terminatie van een status epilepticus als behandeling met fenobarbital i.v. Het effect op bijwerkingen, nodig hebben van ademhalingsondersteuning en overlijden lijkt voor beide behandelingen eveneens gelijk.
Source: Shaner, 1988; Treiman, 1998 (from Prasad, 2014). |
intravenous lorazepam vs. intravenous phenytoin
| MODERATE GRADE | Het lijkt waarschijnlijk dat lorazepam i.v. bij een groter aantal patiënten leidt tot terminatie van een status epilepticus in vergelijking met fenytoïne i.v.
Source: Treiman, 1998 (from Prasad, 2014). |
intravenous lorazepam vs. intramuscular midazolam
| MODERATE GRADE | Het lijkt waarschijnlijk dat midazolam i.m. bij een groter aantal patiënten met een status epilepticus buiten het ziekenhuis tot terminatie van de aanval leidt vergeleken met lorazepam i.v. Dit lijkt eveneens te gelden voor het risico op ICU opname of opname elders in het ziekenhuis. Beide middelen lijken een vergelijkbaar risico te geven op het opnieuw optreden van aanvallen, op bijwerkingen en op de noodzaak tot endotracheale intubatie.
Source: Silbergleit, 2012 (from Prasad, 2014). |
intravenous valproate vs. intravenous phenytoin
| VERY LOW GRADE | Er zijn beperkte aanwijzingen dat valproaat i.v. en diazepam i.v. een vergelijkbaar effect hebben op terminatie van een status epilepticus
Source: Brigo, 2016a (using Agarwal; 2007; Chakravarthi et al. 2015; Gilad; 2008; Mundlamuri, 2015) |
intravenous valproate vs. intravenous phenobarbital
| LOW GRADE | Er zijn aanwijzingen dat fenobarbital i.v effectiever is in het beëindigen van een convulsieve status epilepticus dan valproaat i.v. Hierbij moet rekening worden gehouden met een groter risico op ernstige bijwerkingen bij gebruik van fenobarbital i.v.
Source: Su, 2016 |
intravenous valproate vs. intravenous phenytoin
| VERY LOW GRADE | Er zijn beperkte aanwijzingen dat valproaat i.v. en fenytoïne i.v. een vergelijkbaar effect hebben op het beëindigen van een convulsieve status epilepticus. Hierbij moet rekening worden gehouden met een groter risico op cardiovasculaire bijwerkingen bij gebruik van fenytoïne.
Source: Amiri-Nikpour, 2018 |
Samenvatting literatuur
Description of studies
Chu (2020) performed a systematic review and meta-analyses to evaluate the efficacy and safety of intravenous levetiracetam in patients with status epilepticus. Only RCTs, comparing intravenous levetiracetam to other antiepileptic drugs were included in this systematic review. Six RCTs with a total of 543 patients were included. The definition of ‘convulsive status epilepticus’ varied slightly from study to study. All studies included generalized convulsive status epilepticus participants, whereas three studies (Gujjar, 2017; Misra, 2012; Chakravarthi, 2015) included several patients presenting with focal or subtle convulsive status epilepticus. Four comparisons were available:
- intravenous levetiracetam vs. intravenous phenytoin (Gujjar, 2017; Chakravarthi, 2015);
- intravenous levetiracetam vs. intravenous valproate (Tripathi, 2009);
- intravenous levetiracetam vs. intravenous lorazepam (Misra, 2012); and
- intravenous levetiracetam plus clonazepam vs. intravenous placebo plus clonazepam (Mundlamuria, 2015).
The dose, maintenance dose, and injection timing of levetiracetam and control drugs varied between studies. Mundlamuri (2015) followed their participants for one month after discharge from hospital), and in other studies patients were followed only during their hospital stay. Regarding risk of bias, in five RCTs was selection bias detected and in five RCTs was selective reporting bias detected, but all studies mentioned adequate blinding.
Relevant outcome measures included drug administration to seizure cessation (critical), termination of status epilepticus after drug administration (critical), mortality (important), and requirement for ventilatory support (important).
Kobata (2020) performed a systematic review to compare intravenous diazepam and intravenous lorazepam for the emergency treatment of adult status epilepticus. Two RCTs (Leppik, 1983; Alldredge, 2001) with a total of 204 adult status epilepticus patients at an emergency setting were included. Leppik (1983) compared intravenous diazepam (10 mg) to intravenous lorazepam (4 mg) and Alldredge (2001) compared intravenous diazepam (5 mg) to intravenous lorazepam (2 mg). For both RCTs, when the seizures did not terminate or recurred, second injections of identical doses of the same benzodiazepines were given. The study populations differed: Leppik (1983) included convulsive and non-convulsive SE, whereas Alldredge (2001) included only generalized tonic-clonic seizure. Risk of bias was assessed as ‘high’ for Leppik (1983) and assessed as ‘low’ for Alldredge (2001). Relevant outcome measures include seizure cessation (critical), mortality (important), hypotension (important), respiratory depression (important).
Kapur (2019) performed an RCT to compare the efficacy and safety of intravenous levetiracetam, intravenous fosphenytoin, and intravenous valproate in children and adults with convulsive status epilepticus that were unresponsive to treatment with benzodiazepines. Patients (n=384) were randomized into the intravenous levetiracetam group (n=145, mean age ± SD: 33.3 ± 26.0, 53% male), intravenous fosphenytoin group (n=118, mean age ± SD: 32.8 ± 25.4, 60% male), or intravenous VPA group (n=121, mean age ± SD: 32.2 ± 25.4, 54% male). A total of 39% of the patients who were enrolled were children and adolescents (up to 17 years of age), 48% were adults (18 to 65 years of age), and 13% were older adults (>65 years of age). To answer our clinical question, we extracted the results from the adult subgroup analysis intention to treat analyses were performed. Relevant outcome measures include seizure cessation (critical), mortality (important), hypotension (important), respiratory depression (important).
Nene (2019) conducted an RCT to compare the efficacy of valproate and levetiracetam following initial intravenous lorazepam in elderly patients (>60 years) with generalized convulsive status epilepticus. Intravenous lorazepam was followed by administration of intravenous valproate or levetiracetam based on the treatment arm to which the patient was randomized. All patients received initial intravenous lorazepam (0.1 mg/kg) followed by one of the two antiepileptic drugs: parenteral valproate (20-25 mg/kg) or intravenous levetiracetam (20-25 mg/kg). A total of 118 patients who had generalized convulsive status epilepticus were randomized (valproate: n=60, mean age: 66.6 ± 6.7, 31% female; levetiracetam: n=58, mean age: 68.5 ± 8.0, 41% female). A total of 100 patients (valproate: n=50, mean age: 66.6 ± 6.7, 11% female; levetiracetam n=50) completed the study. Intention to treat analyses were performed. Relevant outcome measures include seizure cessation (critical), mortality (important), hypotension (important), respiratory depression (important).
This module is an update from the module dd. June 2020 (including a search until 1 January 2019). No new literature was found regarding the following comparisons:
- intravenous diazepam + intravenous phenytoin vs. intravenous phenobarbital
- intravenous diazepam + intravenous phenytoin vs. intravenous phenytoin
- intravenous diazepam vs. intravenous valproate
- intravenous lorazepam vs. intramuscular midazolam
- intravenous lorazepam vs. intravenous phenobarbital
- intravenous valproate vs. intravenous phenobarbital
- intravenous valproate vs. intravenous phenytoin
Thus, the previous conclusions remain valid. The description of previous included studies is presented as Appendix 1 (2020).
Results
1. Intravenous levetiracetam versus intravenous phenytoin
1.1 Seizure cessation (critical)
For the comparison between levetiracetam and phenytoin, three studies (Chakravarthi, 2015; Mundlamuri, 2015; Gujjar, 2017) with 196 participants were combined by Chu (2020) in a meta-analysis. Analyses showed that seizure cessation was present in 70 out of 94 (74%) patients in the levetiracetam-group and in 71 out of 102 (70%) phenytoin-group patients, resulting in a risk ratio of 1.09 (95%CI 0.92 to 1.29), see Figure 1. The difference between the groups was not statistically significant nor clinically relevant.
1.2 Termination of SE after drug administration (critical)
Not reported for the comparison between levetiracetam and phenytoin.
1.3 Mortality (important)
Chu (2020) defined ‘mortality’ as in hospital mortality. Analyses showed that hospital mortality was present in 9 out of 94 patients (10%) patients in the levetiracetam-group and in 11 out of 102 patients (11%) phenytoin-group patients, ressulting in a risk ratio of 0.88 (95%CI 0.38 to 2.04), see Figure 2. This difference was not statistically significant but clinically relevant.
The outcomes 1.4 Requirement of ventilatory support (important), 1.5 Hypotension (important), and 1.6 Length of stay (important) were not reported for the comparison between levetiracetam and phenytoin.
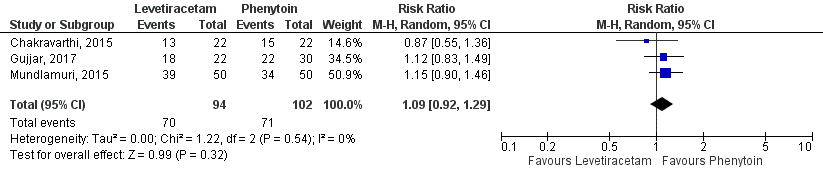
Figure 1 Studies comparing intravenous levetiracetam and intravenous phenytoin: seizure cessation.
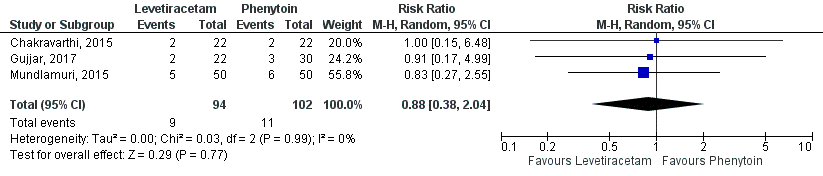
Figure 2 Studies comparing intravenous levetiracetam and intravenous phenytoin: hospital mortality.
2. Intravenous levetiracetam versus intravenous valproate
2.1 Seizure cessation (critical)
For the comparison between levetiracetam and valproate, two studies (Tripathi, 2010; Mundlamuri, 2015) with 182 participants were combined in a meta-analysis (Chu, 2020). One additional RCT (Kapur, 2019) including 266 patients was added to this comparison. Kapur (2020) assessed cessation of seizures within 60 minutes.
Seizure cessation was present in 135 out of 236 (57%) patients in the levetiracetam-group and in 116 out of 212 (55%) patients in the valproate-group, resulting in a risk ratio of 1.08 (95%CI 0.93 to 1.26), see Figure 3. The difference between the groups was not statistically significant nor clinically relevant.
2.2 Termination of SE after drug administration (critical)
For the comparison between levetiracetam and valproate, one RCT (Kapur, 2019) assessed the time to termination of seizures. This outcome was defined as the interval from the start of infusion of the trial drug to the cessation of clinically apparent seizures.
Data were available for 24 patients (n=14 levetiracetam, n=10 valproate). Median time from start of trial-drug infusion to termination of seizures for patients with treatment success was 10.5 minutes (interquartile range: 5.7 to 15.5) in the levetiracetam-group and 7.0 minutes (interquartile range: 4.6 to 14.9) in the valproate-group. If the median is interpreted as a mean value, then there could potentially be a clinically relevant difference. However, since this is a median (data is skewed), no statement can be made about the clinically relevant difference.
2.3 Mortality (important)
Chu (2020) defined ‘mortality’ as in hospital mortality, including two studies (Tripathi, 2010; Mundlamuri, 2015). One additional RCT (Kapur, 2019) assessed mortality at hospital discharge or 30 days, whichever came first.
Mortality was present in 14 out of 241 (5.8%) patients in the levetiracetam-group and in 8 out of 216 (3.7%) patients in the valproate-group, resulting in a risk ratio of 1.56 (95%CI 0.65 to 3.71), see Figure 4. The difference between the groups was not statistically significant but clinically relevant. Herewith, the very low number of events and the wide confidence interval should be considered.
2.4 Requirement of ventilatory support (important).
Kapur (2019) assessed acute respiratory depression at hospital discharge or 30 days, whichever came first. In the levetiracetam-group in 12 out of 150 patients (8%) and in the valproate-group 10 out of 125 patients (8%) experienced acute respiratory depression. This resulted in a risk ratio is 1.00 (95%CI 0.45 to 2.24). This difference was not statistically significant nor clinically relevant. The very low number of events and the wide confidence interval should be considered.
2.5 Hypotension (important)
For the comparison between levetiracetam versus valproate, Kapur (2019) assessed life-threatening hypotension within 60 min after start of trial drug infusion. In the levetiracetam-group in 1 out of 150 patients (1%) and in the valproate-group 2 out of 125 patients (2%) experienced hypotension.
2.6 Length of stay (important)
For the comparison between levetiracetam versus valproate, one RCT (Kapur, 2019) assessed the length of stay. Length of stay was defined as admission to the ICU; the length of ICU stay, and length of hospital stay.
In the levetiracetam-group 87 out of 145 patients (60%) and in the valproate-group 71 out of 121 patients (59%) were admitted to the ICU, resulting in a risk ratio of 1.02 (95%CI 0.84 to 1.25). Median length of ICU stay was 1 day (interquartile range: 0 to 3) for both groups.
Median length of total hospital stay was 3 days (interquartile range: 1 to 7) in the levetiracetam-group and 3 days (interquartile range: 2 to 6) in the valproate-group. These differences were not statistically significant nor clinically relevant.
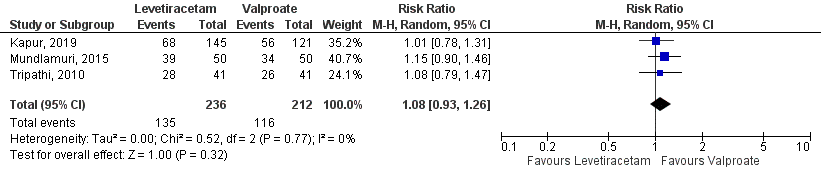
Figure 3 Studies comparing intravenous levetiracetam and intravenous valproate:
seizure cessation.
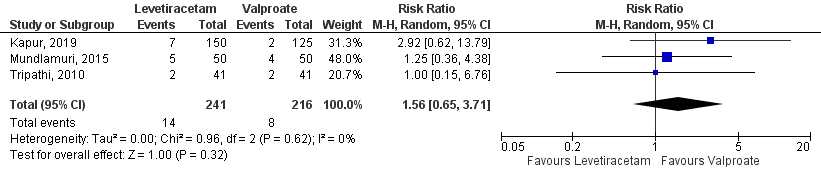
Figure 4 Studies comparing intravenous levetiracetam and intravenous valproate:
hospital mortality.
3. Intravenous fosphenytoin versus intravenous valproate
3.1 Seizure cessation (critical)
For the comparison between fosphenytoin and valproate, one RCT (Kapur, 2019) assessed cessation of seizures within 60 minutes. Seizure cessation was found in 53 of 118 (45%) in the fosphenytoin-group and 56 of 121 (46%) in the valproate-group. This resulted in a risk ratio of 0.97 (95%CI 0.74 to 1.28). This difference was not statistically significant nor clinically relevant.
3.2 Termination of SE after drug administration (critical)
For the comparison between fosphenytoin and valproate, one RCT (Kapur, 2019) assessed the time to termination of seizures. This outcome was defined as the interval from the start of infusion of the trial drug to the cessation of clinically apparent seizures.
Data were available for 25 patients (n=15 fosphenytoin, n= 10 valproate). Median time from start of trial-drug infusion to termination of seizures for patients with treatment success was 11.7 minutes (interquartile range: 7.5 to 20.9) in the fosphenytoin-group and 7.0 minutes (interquartile range: 4.6 to 14.9) in the valproate-group. No statement can be made about the clinically relevant difference as these are median values (data is skewed).
3.3 Mortality (important)
For the comparison between fosphenytoin and valproate, one RCT (Kapur, 2019) assessed mortality at hospital discharge or 30 days, whichever came first. In the fosphenytoin-group 3 out of 125 patients (2%) died and in the valproate-group 2 out of 125 patients (2%) died. When valproateis compared to fosphenytoin, the risk ratio is 1.50 (95%CI 0.26 to 8.82). Herewith, the very low number of events (5 in total) and the wide confidence interval should be considered.
3.4 Requirement of ventilatory support (important).
Kapur (2019) assessed acute respiratory depression at hospital discharge or 30 days, whichever came first. In the fosphenytoin-group 16 out of 125 patients (13%) and in the valproate-group 10 out of 125 patients (8%) experienced acute respiratory depression. When fosphenytoin compared to valproate, the risk ratio is 1.60 (95%CI 0.76 to 3.39). This difference was statistically significant but clinically relevant. Caution is needed due to the wide confidence interval.
3.5 Hypotension (important)
For the comparison between fosphenytoin and valproate, Kapur (2019) assessed life-threatening hypotension within 60 min after start of trial drug infusion. In the fosphenytoin-group 4 out of 125 patients (3%), and in the valproate-group 2 out of 125 patients (2%) experienced hypotension.
3.6 Length of stay (important)
For the comparison between fosphenytoin and valproate, one RCT (Kapur, 2019) assessed the length of stay. Length of stay was defined as admission to the ICU; the length of ICU stay, and length of hospital stay.
In the fosphenytoin-group 70 out of 118 patients (59%) and in the valproate-group 71 out of 121 patients (59%) were admitted to the ICU, resulting in a risk ratio of 1.75 (95%CI 1.31 to 2.34). This difference was not statistically significant but clinically relevant.
Median length of ICU stay was 1 day (interquartile range: 0 to 3) in both groups. Median length of total hospital stay was 3 days (interquartile range: 1 to 6) in the fosphenytoin-group and 3 days (interquartile range: 2 to 6) in the valproate-group. These differences were not statistically significant nor clinically relevant.
4. Intravenous lorazepam versus intravenous diazepam
4.1 Seizure cessation (critical)
For the comparison between diazepam and lorazepam, two studies (Leppik, 1983; Alldredge, 2001) with 204 participants were combined in a meta-analysis (Kobata, 2020).
Seizure cessation was present in 54 out of 101 patients (53%) patients in the diazepam-group and in 72 out of 103 patients (70%) lorazepam-group patients, resulting in a risk ratio of
4.2 Termination of SE after drug administration (critical)
Not reported for the comparison diazepam versus lorazepam.
4.3 Mortality (important)
For the comparison between diazepam and lorazepam, two studies (Leppik, 1983; Alldredge, 2001) with 204 participants were combined in meta-analysis (Kobata, 2020). Kobata (2020) defined ‘mortality’ as mortality at discharge. Mortality at discharge was present in 3 out of 101 patients (3%) in the diazepam-group and in 5 out of 103 patients (5%) lorazepam-group patients, resulting in a risk ratio of 1.72 (95%CI 0.43 to 6.90), see Figure 6. This difference was not statistically significant but clinically relevant. Caution is needed due to the very low number of events and the wide confidence interval.
4.4 Requirement of ventilatory support (important)
Kobata (2020) compared diazepam to lorazepam and assessed ventilatory support based on two studies (Leppik, 1983; Alldredge, 2001), representing 204 patients. Analyses showed that ventilatory support was needed in 10 out of 101 patients (10%) in the diazepam-group and in 11 out of 103 patients (11%) lorazepam-group patients, resulting in a risk ratio of 1.07 (95%CI 0.48 to 2.41), see Figure 7. This difference was not statistically significant nor clinically relevant.
4.5 Hypotension (important)
One study (Leppik, 1983) included in Kobata (2020) assessed ‘hypotension’. Leppik (1983) assessed hypotension in 70 patients. In the levetiracetam-group and diazepam-group, hypotension occurred in 1 out of 37 patients (2.7%) and 0 out of 33 patients (0%), respectively.
4.6 Length of stay (important)
Not reported for the comparison diazepam versus lorazepam.
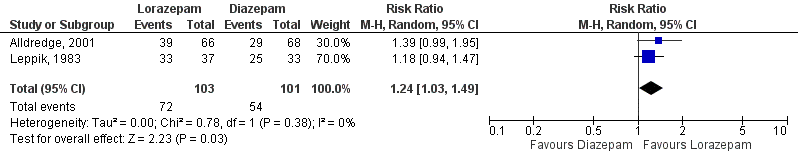
Figure 5 Studies comparing intravenous Lorazepam and intravenous Diazepam:
seizure cessation.

Figure 6 Studies comparing intravenous Lorazepam and intravenous Diazepam:
mortality.
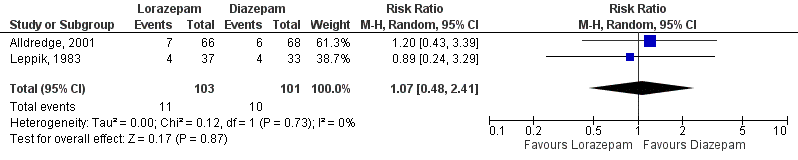
Figure 7 Studies comparing intravenous Lorazepam and intravenous Diazepam:
requirement of ventilatory support.
5. Intravenous levetiracetam versus intravenous lorazepam
5.1 Seizure cessation (critical)
For the comparison between levetiracetam and lorazepam, one study (Misra, 2012) was selected from the meta-analysis (Chu, 2020). Misra (2012) included 79 patients and defined termination after drug administration at 10 minutes. Seizure cessation was present in 29 out of 38 patients (76%) in the levetiracetam-group and in 31 out of 41 patients (76%) in the lorazepam-group patients, resulting in a risk ratio of 1.01 (95%CI 0.79 to 1.29). This difference between the groups was not statistically significant nor clinically relevant.
5.2 Termination of SE after drug administration (critical)
Not reported for the comparison levetiracetam versus lorazepam.
5.3 Mortality (important)
Not reported for the comparison levetiracetam versus lorazepam.
5.4 Requirement of ventilatory support (important)
Analyses showed that in the levetiracetam-group 4 out of 38 patients (11%) and in the lorazepam-group 10 out of 41 patients (24%) used ventilatory support, resulting in a risk ratio of 0.43 (95%CI 0.15 to 1.26). This difference was not statistically significant but clinically relevant. Caution is needed due to the very low number of events.
5.5 Hypotension (important)
Analyses showed that in the levetiracetam-group 2 out of 38 patients (5%) and in the lorazepam-group 8 out of 41 patients (20%) had hypotension, resulting in a risk ratio of 0.27 (95%CI 0.06 to 1.19). This difference was not statistically significant but clinically relevant. Caution is needed due to the very low number of events.
5.6 Length of stay (important)
Not reported for the comparison levetiracetam versus lorazepam.
6. Intravenous lorazepam + intravenous valproate versus intravenous lorazepam + intravenous levetiracetam
6.1 Seizure cessation (critical)
For the comparison between valproate and levetiracetam following initial intravenous lorazepam, one RCT (Nene, 2019) assessed termination of SE as no recurrence of seizures after half an hour of infusion of study drugs. Intention to treat analysis (n=118) showed that valproate following lorazepam led to seizure control in 41 out of 60 patients (68%), while levetiracetam following lorazepam led to seizure control in 43 out of 58 patients (74%).
This resulted in a risk ratio of 0.92 (95%CI 0.73 to 1.16), this difference was not statistically significant nor clinically relevant.
6.2 Termination of SE after drug administration (critical)
Not reported for the comparison lorazepam + valproate versus lorazepam + levetiracetam.
6.3 Mortality (important)
Nene (2019) assessed 1-month mortality comparing valproate and levetiracetam. The 30-day mortality was comparable in both groups (valproate: n=13, 22.4%; levetiracetam: n=10, 18.2%). this difference resulted in a risk ratio of 1.26 (95%CI 0.60 to 2.64). This difference was not statistically significant but clinically relevant. Herewith, the very low number of events and the wide confidence interval should be considered.
6.4 Requirement of ventilatory support (important)
Not reported for the comparison lorazepam + valproate versus lorazepam + levetiracetam.
6.5 Hypotension (important)
Not reported for the comparison lorazepam + valproate versus lorazepam + levetiracetam.
6.6 Length of stay (important)
Nene (2019) assessed the length of hospital stay comparing valproate and levetiracetam. Mean length of hospital stay was 3.6 days (SD: 1.9) in the valproate-group and 4.4 days (SD: 3.9) in the levetiracetam-group.
7. Intravenous levetiracetam + clonazepam versus intravenous placebo + clonazepam
7.1 Seizure cessation (critical)
For the comparison between adding levetiracetam to clonazepam vs. adding placebo to clonazepam, one study (Navarro, 2016) was selected from the meta-analysis (Chu, 2020). Navarro (2016) included 136 patients and defined termination of SE after drug administration within 15 minutes. Status epilepticus was controlled by levetiracetam in 57 out of 68 patients (84%) and by placebo in 50 out of 68 patients (74%), which resulted in a risk ratio of 1.14 (95%CI 0.96 to 1.36). This difference was not statistically significant, but clinically relevant.
7.2 Termination of SE after drug administration (critical)
Not reported for the comparison levetiracetam and clonazepam vs. adding placebo to clonazepam.
7.3 Mortality (important)
Navarro (2016) assessed mortality at 15 days after admission to hospital or earlier if discharged from hospital. Mortality was comparable in both groups (clonazepam plus levetiracetam: n=3, 5%; clonazepam plus placebo: n=4, 6%). This difference resulted in a risk ratio of 0.74 95%CI 0.17 to 3.17). This difference was not statistically significant but clinically relevant. Herewith, the very low number of events and the wide confidence interval should be considered.
7.4 Requirement of ventilatory support (important)
Not reported for the comparison levetiracetam and clonazepam vs. adding placebo to clonazepam.
7.5 Hypotension (important)
Not reported for the comparison levetiracetam and clonazepam vs. adding placebo to clonazepam.
7.6 Length of stay (important)
Navarro (2016) assessed the length of hospital stay comparing levetiracetam and clonazepam vs. adding placebo to clonazepam. Median length of hospital stay was 10 days (range 1 to 15) in the levetiracetam-group and 10 days (range 1 to 15) in the placebo-group.
Median length of ICU stay was 3 days (range 0 to 15) in the levetiracetam-group and 3 days (range 1 to 15) in the placebo-group.
Level of evidence of the literature
1. Intravenous levetiracetam versus intravenous phenytoin
1.1 Seizure cessation (critical)
Regarding the comparison levetiracetam and phenytoin, the level of evidence regarding the outcome measure ‘seizure cessation’ started as high was downgraded by 3 levels to very low because of study limitations (-1; risk of bias), imprecision (-1; confidence interval crosses boundaries of clinical important difference), and conflicting results between studies (-1; heterogeneity).
1.3 Mortality (important)
Regarding the comparison intramuscular levetiracetam and phenytoin, the level of evidence regarding the outcome measure ‘mortality’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; confidence interval crosses boundaries of clinical important difference and relatively small number of patients).
The outcomes 1.2 Termination of SE after drug administration (critical), 1.4 Requirement of ventilatory support (important), 1.5 Hypotension (important), and 1.6 Length of stay (important) were not reported and could not be graded.
2. Intravenous levetiracetam versus intravenous valproate
2.1 Seizure cessation (critical)
Regarding the comparison between levetiracetam and valproate, the level of evidence regarding the outcome measure ‘seizure cessation’ started as high and was downgraded by 3 levels to low because of study limitations (-1; risk of bias) and imprecision (-2; because of crosses boundaries of clinical important difference).
2.2 Termination of SE after drug administration (critical)
Regarding the comparison between levetiracetam and valproate, the level of evidence regarding the outcome measure ‘termination of SE after drug administration’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; because of a small number of patients from only one study).
2.3 Mortality (important)
Regarding the comparison between levetiracetam and valproate, the level of evidence regarding the outcome measure ‘mortality’ started as high and was downgraded by 3 levels to low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, only one study, large confidence interval crosses boundaries of clinical important difference).
2.4 Requirement of ventilatory support (important).
Regarding the comparison between levetiracetam and valproate, the level of evidence regarding the outcome measure ‘ventilatory support’ started as high and was downgraded by 3 levels to low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, only one study, large confidence interval crosses boundaries of clinical important difference).
2.5 Hypotension (important).
Regarding the comparison between levetiracetam and valproate, the level of evidence regarding the outcome measure ‘hypotension’ started as high and was downgraded by 3 levels to low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, a small number of patients from only one study).
2.6 Length of stay (important).
Regarding the comparison between levetiracetam and valproate, the level of evidence regarding the outcome measure ‘length of stay’ started as high and was downgraded by 3 levels to low because of study limitations (-1; risk of bias) and imprecision (-2; confidence interval crosses boundaries of clinical important difference, a small number of patients from only one study).
3. Intravenous fosphenytoin versus intravenous valproate
3.1 Seizure cessation (critical)
Regarding the comparison between fosphenytoin and valproate, the level of evidence regarding the outcome measure ‘seizure cessation’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; because of crosses boundaries of clinical important difference).
3.2 Termination of SE after drug administration (critical)
Regarding the comparison between fosphenytoin and valproate, the level of evidence regarding the outcome measure ‘termination of SE after drug administration’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; because of a small number of patients from only one study).
3.3 Mortality (important)
Regarding the comparison between fosphenytoin and valproate, the level of evidence regarding the outcome measure ‘mortality’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, only one study, large confidence interval crosses boundaries of clinical important difference).
3.4 Requirement of ventilatory support (important)
Regarding the comparison between fosphenytoin and valproate, the level of evidence regarding the outcome measure ‘ventilatory support’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, only one study, large confidence interval crosses boundaries of clinical important difference).
3.5 Hypotension (important)
Regarding the comparison between fosphenytoin and valproate, the level of evidence regarding the outcome measure ‘hypotension’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, a small number of patients from only one study).
3.6 Length of stay (important)
Regarding the comparison between fosphenytoin and valproate, the level of evidence regarding the outcome measure ‘length of stay’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; confidence interval crosses boundaries of clinical important difference, a small number of patients from only one study).
4. Intravenous lorazepam versus intravenous diazepam
4.1 Seizure cessation (critical)
Regarding the comparison between diazepam and lorazepam, the level of evidence regarding the outcome measure ‘seizure cessation’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population).
4.3 Mortality (important)
Regarding the comparison between diazepam and lorazepam, the level of evidence regarding the outcome measure ‘mortality’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, large confidence interval crosses boundaries of clinical important difference).
4.4 Requirement of ventilatory support (important)
Regarding the comparison between diazepam and lorazepam, the level of evidence regarding the outcome measure ‘ventilatory support’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, large confidence interval crosses boundaries of clinical important difference).
4.5 Hypotension (important)
Regarding the comparison between diazepam and lorazepam, the level of evidence regarding the outcome measure ‘hypotension’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; very low number of events, relatively small study population).
The outcomes 4.2 Termination of SE after drug administration (critical) and 4.6 Length of stay (important) were not reported and could not be graded.
5. Intravenous levetiracetam versus intravenous lorazepam
5.1 Seizure cessation (critical)
Regarding the comparison between levetiracetam and lorazepam, the level of evidence regarding the outcome measure ‘seizure cessation’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population, confidence interval crosses boundaries of clinical important difference).
5.4 Requirement of ventilatory support (important)
Regarding the comparison between diazepam and lorazepam, the level of evidence regarding the outcome measure ‘ventilatory support’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population, confidence interval crosses boundaries of clinical important difference).
5.5 Hypotension (important)
Regarding the comparison between diazepam and lorazepam, the level of evidence regarding the outcome measure ‘hypotension’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population, low number of events, confidence interval crosses boundaries of clinical important difference).
The outcomes 5.2 Termination of SE after drug administration (critical), 5.3 Mortality (important), and 5.6 Length of stay (important) were not reported and could not be graded.
6. Intravenous lorazepam + intravenous valproate versus intravenous lorazepam + intravenous levetiracetam
6.1 Seizure cessation (critical)
Regarding the comparison between valproate and levetiracetam, the level of evidence regarding the outcome measure ‘seizure cessation’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population from only one study, confidence interval crosses boundaries of clinical important difference).
6.3 Mortality (important)
Regarding the comparison between valproate and levetiracetam, the level of evidence regarding the outcome measure ‘mortality’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population from only one study).
6.6 Length of stay (important)
Regarding the comparison between valproate and levetiracetam, the level of evidence regarding the outcome measure ‘length of stay’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population from only one study).
The outcomes 6.2. Termination of SE after drug administration (critical). 6.4. Requirement of ventilatory support (important), 6.5. Hypotension (important) were not reported and could not be graded.
7. Intravenous levetiracetam + clonazepam versus intravenous placebo + clonazepam
7.1 Seizure cessation (critical)
Regarding the comparison between adding levetiracetam to clonazepam vs. adding placebo to clonazepam, the level of evidence regarding the outcome measure ‘seizure cessation’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population from only one study, confidence interval crosses boundaries of clinical important difference).
7.3 Mortality (important)
Regarding the comparison between adding levetiracetam to clonazepam vs. adding placebo to clonazepam, the level of evidence regarding the outcome measure ‘mortality’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population from only s study, very low number of events).
7.6 Length of stay (important)
Regarding the comparison between adding levetiracetam to clonazepam vs. adding placebo to clonazepam, the level of evidence regarding the outcome measure ‘length of stay’ started as high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias) and imprecision (-2; relatively small study population from only one study).
The outcomes 7.2. Termination of SE after drug administration (critical), 7.4. Requirement of ventilatory support (important), and 7.5. Hypotension (important) were not reported and could not be graded.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
Which type, dosage and form of medication is most effective in the treatment of status epilepticus in adults with generalized convulsive status epilepticus?
P: adults with status epilepticus
I: anti-epileptic medication (such as diazepam, lorazepam, midazolam, brivaracetam, lacosamide, levetiracetam, phenytoin, valproate and other, new anti-epileptic medication)
C: same medication but other dosage and/or form, other type of medication, no treatment/placebo
O: (time from) drug administration to seizure cessation; (duration of) persistent seizure cessation (dichotomous and continuous); requirement for ventilatory support, hypotension, patient satisfaction, mortality, length of hospital stay
Relevant outcome measures
The working group defined convulsive status epilepticus as stated in the ILAE classification of 2015: “Status epilepticus is a condition resulting either from the failure of the mechanisms responsible for seizure termination or from the initiation of mechanisms, which lead to abnormally, prolonged seizures (after time point t1). It is a condition, which can have long-term consequences (after time point t2), including neuronal death, neuronal injury, and alteration of neuronal networks, depending on the type and duration of seizures.” (Trinka, 2015). For convulsive status epilepticus time point t1 is 5 minutes and time point t2 is 30 minutes.
The working group considered (time from drug administration to) seizure cessation and (duration of) continued seizure cessation as a critical outcome measure for decision making; mortality, requirement for ventilatory support, hypotension, length of hospital stay, and patient satisfaction as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. Patient satisfaction had to be assessed using validated instruments. Length of hospital stay is defined as the overall length of time a patient is hospitalized.
Per outcome, the working group defined the following differences as a minimal clinically (patient) important differences:
Dichotomous outcomes (relative risk; yes/no):
- From drug administration to seizure cessation within a certain time period: ≥10%
- Persistent seizure cessation at least one hour: ≥10%
- Respiratory depression (requirement for ventilatory support): ≥10%
- Mortality: ≥10%
Continuous outcomes:
- Time from drug administration to seizure cessation: ≥2 minutes
- Duration of persistent seizure cessation: ≥30 minutes
- Hypotension: ≥10%
- Patient satisfaction: ≥10% difference on a validated scale
- Length of hospital stay: ≥2 days
Search and select (Methods)
The search strategy, which dated from 01-01-2019 was updated. The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 01-01-2019 (last search) until 21-06-2021. The detailed search strategy is depicted under the tab Methods. One search was conducted for all modules concerning the treatment of status epilepticus. The search was limited to systematic reviews and randomized controlled trials. The systematic literature search resulted in 305 hits. Studies for this module were selected based on the following criteria:
- systematic review (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available) or randomized controlled trial;
- full-text English language publication;
- adults aged ≥ 18 years;
- studies including ≥ 20 (ten in each study arm) patients; and
- studies according to the PICO.
After reading the full text five studies were included in the literature summary of this module.
Results
Five studies were included in the analysis of the literature, of which two systematic reviews and three randomized controlled trials. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Agarwal P, Kumar N, Chandra R, Gupta G, Antony AR, Garg N. Randomized study of intravenous valproate and phenytoin in status epilepticus. Seizure. 2007 Sep;16(6):527-32. doi: 10.1016/j.seizure.2007.04.012. Epub 2007 Jul 9. PMID: 17616473.
- Alldredge BK, Gelb AM, Isaacs SM, Corry MD, Allen F, Ulrich S, Gottwald MD, O'Neil N, Neuhaus JM, Segal MR, Lowenstein DH. A comparison of lorazepam, diazepam, and placebo for the treatment of out-of-hospital status epilepticus. N Engl J Med. 2001 Aug 30;345(9):631-7. doi: 10.1056/NEJMoa002141. Erratum in: N Engl J Med 2001 Dec 20;345(25):1860. PMID: 11547716.
- Alvarez V, Lee JW, Drislane FW, Westover MB, Novy J, Dworetzky BA, Rossetti AO. Practice variability and efficacy of clonazepam, lorazepam, and midazolam in status epilepticus: a multicenter comparison. Epilepsia. 2015 Aug;56(8):1275-85. doi: 10.1111/epi.13056. PMID: 26140660
- Amiri-Nikpour MR, Nazarbaghi S, Eftekhari P, Mohammadi S, Dindarian S, Bagheri M, Mohammadi H. Sodium valproate compared to phenytoin in treatment of status epilepticus. Brain Behav. 2018 Mar 23;8(5):e00951. doi: 10.1002/brb3.951. PMID: 29761006; PMCID: PMC5943732.
- Brigo F, Bragazzi N, Nardone R, Trinka E. Direct and indirect comparison meta-analysis of levetiracetam versus phenytoin or valproate for convulsive status epilepticus. Epilepsy Behav. 2016 Nov;64(Pt A):110-115. doi: 10.1016/j.yebeh.2016.09.030. Epub 2016 Oct 11. PMID: 27736657.
- Chakravarthi S, Goyal MK, Modi M, Bhalla A, Singh P. Levetiracetam versus phenytoin in management of status epilepticus. J Clin Neurosci. 2015 Jun;22(6):959-63. doi: 10.1016/j.jocn.2014.12.013. Epub 2015 Apr 18. PMID: 25899652.
- Chen WB, Gao R, Su YY, Zhao JW, Zhang YZ, Wang L, Ren Y, Fan CQ. Valproate versus diazepam for generalized convulsive status epilepticus: a pilot study. Eur J Neurol. 2011 Dec;18(12):1391-6. doi: 10.1111/j.1468-1331.2011.03420.x. Epub 2011 May 9. PMID: 21557791.
- Chu SS, Wang HJ, Zhu LN, Xu D, Wang XP, Liu L. Therapeutic effect of intravenous levetiracetam in status epilepticus: A meta-analysis and systematic review. Seizure. 2020 Jan;74:49-55. doi: 10.1016/j.seizure.2019.11.007. Epub 2019 Nov 22. PMID: 31830677.
- EMA, 2018. European Medicines Agency 2018; 31/05/2018 EMA/375438/2018. Nieuwe maatregelen ter vermijding van blootstelling aan valproaat bij zwangerschap onderschreven. Link: https://www.ema.europa.eu/en/documents/referral/valproate-article-31-referral-new-measures-avoid-valproate-exposure-pregnancy-endorsed_nl.pdf
- Finsterer, J., & Segall, L. (2010). Drugs interfering with mitochondrial disorders. Drug and chemical toxicology, 33(2), 138-151.
- Gilad R, Izkovitz N, Dabby R, Rapoport A, Sadeh M, Weller B, Lampl Y. Treatment of status epilepticus and acute repetitive seizures with i.v. valproic acid vs phenytoin. Acta Neurol Scand. 2008 Nov;118(5):296-300. doi: 10.1111/j.1600-0404.2008.01097.x. PMID: 18798830.
- Gujjar AR, Nandhagopal R, Jacob PC, Al-Hashim A, Al-Amrani K, Ganguly SS, Al-Asmi A. Intravenous levetiracetam vs phenytoin for status epilepticus and cluster seizures: A prospective, randomized study. Seizure. 2017 Jul;49:8-12. doi: 10.1016/j.seizure.2017.05.001. Epub 2017 May 4. PMID: 28528211.
- Guldiken, B., Rémi, J., & Noachtar, S. (2016). Cardiovascular adverse effects of phenytoin. Journal of neurology, 263(5), 861-870.
- Kobata H, Hifumi T, Hoshiyama E, Yamakawa K, Nakamura K, Soh M, Kondo Y, Yokobori S; Japan Resuscitation Council (JRC) Neuroresuscitation Task Force and the Guidelines Editorial Committee. Comparison of diazepam and lorazepam for the emergency treatment of adult status epilepticus: a systemic review and meta-analysis. Acute Med Surg. 2020 Nov 4;7(1):e582. doi: 10.1002/ams2.582. PMID: 33489240; PMCID: PMC7809602.
- Kapur J, Elm J, Chamberlain JM, Barsan W, Cloyd J, Lowenstein D, Shinnar S, Conwit R, Meinzer C, Cock H, Fountain N, Connor JT, Silbergleit R; NETT and PECARN Investigators. Randomized Trial of Three Anticonvulsant Medications for Status Epilepticus. N Engl J Med. 2019 Nov 28;381(22):2103-2113. doi: 10.1056/NEJMoa1905795. PMID: 31774955; PMCID: PMC7098487.
- Leppik IE, Derivan AT, Homan RW, Walker J, Ramsay RE, Patrick B. Double-blind study of lorazepam and diazepam in status epilepticus. JAMA. 1983 Mar 18;249(11):1452-4. PMID: 6131148.
- Misra UK, Kalita J, Maurya PK. Levetiracetam versus lorazepam in status epilepticus: a randomized, open labeled pilot study. J Neurol. 2012 Apr;259(4):645-8. doi: 10.1007/s00415-011-6227-2. Epub 2011 Sep 6. PMID: 21898137.
- Mundlamuri RC, Sinha S, Subbakrishna DK, Prathyusha PV, Nagappa M, Bindu PS, Taly AB, Umamaheswara Rao GS, Satishchandra P. Management of generalised convulsive status epilepticus (SE): A prospective randomised controlled study of combined treatment with intravenous lorazepam with either phenytoin, sodium valproate or levetiracetam--Pilot study. Epilepsy Res. 2015 Aug;114:52-8. doi: 10.1016/j.eplepsyres.2015.04.013. Epub 2015 May 1. PMID: 26088885.
- Navarro V, Dagron C, Elie C, Lamhaut L, Demeret S, Urien S, An K, Bolgert F, Tréluyer JM, Baulac M, Carli P; SAMUKeppra investigators. Prehospital treatment with levetiracetam plus clonazepam or placebo plus clonazepam in status epilepticus (SAMUKeppra): a randomised, double-blind, phase 3 trial. Lancet Neurol. 2016 Jan;15(1):47-55. doi: 10.1016/S1474-4422(15)00296-3. Epub 2015 Nov 28. PMID: 26627366.
- Nene D, Mundlamuri RC, Satishchandra P, Prathyusha PV, Nagappa M, Bindu PS, Raghavendra K, Saini J, Bharath RD, Thennarasu K, Taly AB, Sinha S. Comparing the efficacy of sodium valproate and levetiracetam following initial lorazepam in elderly patients with generalized convulsive status epilepticus (GCSE): A prospective randomized controlled pilot study. Seizure. 2019 Feb;65:111-117. doi: 10.1016/j.seizure.2019.01.015. Epub 2019 Jan 15. PMID: 30682680.
- NIV, 2014. Richtlijn Diabetes Mellitus - Behandeling ernstige hypoglykemie. Beoordeeld: 20-02-2014. Link: https://richtlijnendatabase.nl/richtlijn/diabetes_mellitus/hypoglykemie/behandeling_ernstige_hypoglykemie.html
- Prasad M, Krishnan PR, Sequeira R, Al-Roomi K. Anticonvulsant therapy for status epilepticus. Cochrane Database Syst Rev. 2014 Sep 10;2014(9):CD003723. doi: 10.1002/14651858.CD003723.pub3. PMID: 25207925; PMCID: PMC7154380.
- Silbergleit R, Durkalski V, Lowenstein D, Conwit R, Pancioli A, Palesch Y, Barsan W; NETT Investigators. Intramuscular versus intravenous therapy for prehospital status epilepticus. N Engl J Med. 2012 Feb 16;366(7):591-600. doi: 10.1056/NEJMoa1107494. PMID: 22335736; PMCID: PMC3307101.
- Shaner DM, McCurdy SA, Herring MO, Gabor AJ. Treatment of status epilepticus: a prospective comparison of diazepam and phenytoin versus phenobarbital and optional phenytoin. Neurology. 1988 Feb;38(2):202-7. doi: 10.1212/wnl.38.2.202. PMID: 3277082.
- Shorvon, S., & Ferlisi, M. (2011). The treatment of super-refractory status epilepticus: a critical review of available therapies and a clinical treatment protocol. Brain, 134(10), 2802-2818.
- Spencer DC, Sinha SR, Choi EJ, Cleveland JM, King A, Meng TC, Pullman WE, Sequeira DJ, Van Ess PJ, Wheless JW. Safety and efficacy of midazolam nasal spray for the treatment of intermittent bouts of increased seizure activity in the epilepsy monitoring unit: A double-blind, randomized, placebo-controlled trial. Epilepsia. 2020 Nov;61(11):2415-2425. doi: 10.1111/epi.16704. Epub 2020 Nov 2. PMID: 33140403.
- Su Y, Liu G, Tian F, Ren G, Jiang M, Chun B, Zhang Y, Zhang Y, Ye H, Gao D, Chen W. Phenobarbital Versus Valproate for Generalized Convulsive Status Epilepticus in Adults: A Prospective Randomized Controlled Trial in China. CNS Drugs. 2016 Dec;30(12):1201-1207. doi: 10.1007/s40263-016-0388-6. PMID: 27878767.
- Treiman DM, Meyers PD, Walton NY, Collins JF, Colling C, Rowan AJ, Handforth A, Faught E, Calabrese VP, Uthman BM, Ramsay RE, Mamdani MB. A comparison of four treatments for generalized convulsive status epilepticus. Veterans Affairs Status Epilepticus Cooperative Study Group. N Engl J Med. 1998 Sep 17;339(12):792-8. doi: 10.1056/NEJM199809173391202. PMID: 9738086.
- Tripathi M, Vibha D, Choudhary N, Prasad K, Srivastava MV, Bhatia R, Chandra SP. Management of refractory status epilepticus at a tertiary care centre in a developing country. Seizure. 2010 Mar;19(2):109-11. doi: 10.1016/j.seizure.2009.11.007. Epub 2010 Jan 19. PMID: 20034814.
- Trinka E, Cock H, Hesdorffer D, Rossetti AO, Scheffer IE, Shinnar S, Shorvon S, Lowenstein DH. A definition and classification of status epilepticus--Report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia. 2015 Oct;56(10):1515-23. doi: 10.1111/epi.13121. Epub 2015 Sep 4. PMID: 26336950.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
| Study reference | Study characteristics | Patient characteristics | Intervention (I) | Comparison / control (C)
| Follow-up | Outcome measures and effect size | Comments |
Chu, 2020
PS. Study characteristics and results are extracted from the SR. | SR and meta-analysis of RCTs.
Literature search up to October 2018.
A: Tripathi, 2010 B: Misra, 2012 C: Chakravarthi, 2015 D: Mundlamuri, 2015 E: Navarro, 2016 F: Gujjar, 2017
A: RCT B: RCT C: RCT D: RCT E: RCT F: RCT
Setting and Country: Various
Source of funding and conflicts of interest: non-commercial / industrial co-authorship
| Inclusion criteria SR: * Randomized, blinded or not blinded, prospectively designed controlled trials. * Trials comparing IV LEV to other AEDs. * Convulsive or non-convulsive SE at any age.
Exclusion criteria SR: * Design of trial was uncontrolled, non-randomized.
6 studies included
Important baseline patient characteristics: No. of patients A: 41 vs. 41 B: 38 vs. 41 C: 22 vs 22 D: 50 vs. 50 vs. 50 E: 68 vs. 68 F: 22 vs. 30
Mean age ± SD A: 21.08 ± 9.7 vs. 26.62 ± 10.1 B: 39.16 ± 21.16 vs. 38.90 ± 23.25 C: 39.00 ± 18.40 vs. 31.82 ± 12.68 D: 34.78 ± 13.64 vs. 33.12 ± 11.99 vs. 33.24 ± 13.39 E: 55 ± 18 vs. 53 ± 18 F: 38 ± 19 vs. 37 ± 19
Sex (M/F) A: 23/18 vs. 19/22 B: 21/17 vs. 30/11 C: 12/10 vs. 15/7 D: 32/18 vs. 28/22 vs. 28/22 E: 49/19 vs. 45/23 F: 13/9 vs. 21/9
SE type A: GCSE (n=82) B: GCSE (n=73), subtle convulsive SE (n=6) C: GCSE (n=41), focal convulsive SE (n=3) D: GCSE (n=150) E: GCSE (n=136) F: GCSE (n=50), partial (n=2)
Groups comparable at baseline? Yes. | A: IV LEV (30 mg/kg at the rate of 5 mg/kg/min IV)
B: IV LEV (20 mg/kg over 15 min IV)
C: IV LEV (20 mg/kg at the rate of 100 mg/min IV)
D: IV LEV (25 mg/kg over 15 min IV)
E: IV LEV + CNP (2.5 g for 5 min IV)
F: IV LEV (30 mg/kg over 30 min IV) | A: VPA (30 mg/kg at the rate of 5 mg/kg/min)
B: LOR (0.1 mg/kg over 2–4min)
C: PHT (20 mg/kg with max rate of 50 mg/min)
D: VPA (30 mg/kg over 15 min IV) vs. (PHT 20 mg/kg over 20 min)
E: placebo + CNP (placebo for 5 min co-intervention: IV CNP 1 mg for 1 min)
F: PHT (20 mg/kg over 30 min co-intervention: IV LOR 4 mg or DZP 5–10 mg over 2 min)
| End-point of follow-up: Time not reported.
A: during hospital stay. B: during hospital stay. C: during hospital stay. D: 1mo after hospital discharge. E: during hospital stay. F: during hospital stay.
For how many participants were no complete outcome data available? N.R.
| Outcome measure 1: Drug administration to seizure cessation (critical) Definition not reported (‘Clinical seizure cessation after drug administration’). *IV LEV vs. IV LOR: N.R. *IV LEV + CNP vs. IV placebo + CNP: N.R.
*IV LEV vs. IV PHT C: 0.87 [95%CI 0.55 to 1.36] D: 1.15 [95%CI 0.90 to 1.46] F: 1.12 [95%CI 0.83 to 1.49] Pooled effect (random effects model): RR 1.09 [95%CI 0.92 to 1.29], favoring IV PHT. Heterogeneity (I2): 0%
* IV LEV vs. IV VPA A: 1.08 [95%CI 0.79 to 1.47] D: 1.15 [95%CI 0.90 to 1.46] Pooled effect (random effects model): RR 1.12 [95%CI 0.93 to 1.36], favoring IV VPA. Heterogeneity (I2): 0%
Outcome measure 2: termination of SE after drug administration (critical) Defined as termination of SE after drug administration (within 10min, 15min, or 24h). *IV LEV vs. IV PHT: N.R. *IV LEV vs. IV VPA: N.R.
* IV LEV vs. IV LOR: B Within 10min à LEV: 29/38 vs. lorazepam: 31/41, p=1.00 Within 24h à LEV: 23/29 vs. LOR: 21/31, p=0.38
*IV LEV + CNP vs. IV placebo + CNP: E Within 15min à LEV: 57/68 vs. placebo: 50/68, RR=0.88 [95%CI 0.71 to 1.05], p= 0.14.
Outcome measure 3: mortality (important) Defined as in hospital mortality. *IV LEV vs. IV LOR: N.R. *IV LEV + CNP vs. IV placebo + CNP: N.R.
* IV LEV vs. IV PHT C: 1.00 [95%CI 0.15 to 6.48] D: 0.83 [95%CI 0.27 to 2.55] F: 0.91 [95%CI 0.17 to 4.99] Pooled effect (random effects model): RR 0.88 [95%CI 0.38 to 2.04], favoring IV LEV. Heterogeneity (I2): 0%
*IV LEV vs. IV VPA A: 1.00 [95%CI 0.15 to 6.76] D: 0.83 [95%CI 0.27 to 2.55] Pooled effect (random effects model): RR 1.17 [95%CI 0.41 to 3.34], favoring IV VPA. Heterogeneity (I2): 0%
Outcome measure 4: requirement for ventilatory support (important) Defined as use assisted breathing.
* IV LEV vs. IV LOR: B LEV: 4/38 vs. lorazepam: 10/41, p=0.03
*IV LEV vs. IV PHT: N.R. *IV LEV vs. IV VPA: N.R. *IV LEV + CNP vs. IV placebo + CNP: N.R. | Facultative: Results suggested that IV LEV was comparable to IV PHT, VPA, or LOR in efficacy, and IV LEV + CNP had no superiority in seizure cessation than CNP + placebo. IV LEV may have a better tolerability than other AEDs do.
Limitations: * Only studies published in journals or in certain trial registers were included. * Included trials varied in terms of trial design, type of comparator drugs, and outcomes. Might be underpowered. * Almost all SE patients had a conscious disturbance during the episode à it was sometimes difficult to obtain informed consent. * The number of included studies and participants was limited and might be underpowered. * Follow-up period of the included studies was relatively short. * Adverse events were not assessed. *Navarro: higher doses of benzodiazepines, lower thresholds for determining cessation of SE, 23% patients excluded due to absence of legally required consent. à likely masked (high risk of bias).
Sensitivity analyses: Random-effects model was converted to fixed-effects model, and RR value was transformed into OR. The research conclusions were consistent, indicating that the results of the meta-analysis were stable.
Heterogeneity: No statistically significant heterogeneity was found for all pooled analysis. |
| Study reference | Study characteristics | Patient characteristics | Intervention (I) | Comparison / control (C) | Follow-up | Outcome measures and effect size | Comments |
Kobata, 2020
PS. Study characteristics and results are extracted from the SR. | SR and meta-analysis of RCTs.
Literature search up to September 2019.
A: Leppik, 1983 B: Alldredge, 2001
A: RCT B: RCT
Setting and Country: A: USA B: USA
Source of funding and conflicts of interest: non-commercial / industrial co-authorship
| Inclusion criteria SR: * RCTs in humans published before September 2019. * Adult SE patients in an emergency setting, including prehospital care. * Studies written in English or Japanese.
Exclusion criteria SR: N.R.
2 studies included
Important baseline patient characteristics: No. of patients A: 37 vs. 33 B: 66 vs. 68
Mean age ± SD A: 50 vs. 56 B: 49.9 vs. 50.4
Definition of SE and inclusion criteria A: Convulsive SE (defined as ≥3 GTC seizures in 1h or ≥2 in rapid succession), absence SE, or complex partial SE B: Continuous or repeated seizure activity >5 min without recovery of consciousness
Sex (M/F) N.R.
SE type N.R.
Groups comparable at baseline? Yes. | A: LOR 4 mg IV B: LOR 2 mg IV
| A: DZP 10 mg IV B: DZP 5 mg IV | End-point of follow-up: N.R.
For how many participants were no complete outcome data available? N.R.
| Outcome measure 1: Drug administration to seizure cessation (critical) *LEZ vs. DZP Effect measure: RR [95% CI] A: 1.39 [95%CI 0.94 to 1.47] B: 1.18 [95%CI 0.9 to 1.95]
Pooled effect (random effects model): RR 1.24 [95%CI 1.03 to 1.49], favoring IV LEZ. Heterogeneity (I2): 0%
Outcome measure 2: termination of SE after drug administration (critical) N.R.
Outcome measure 3: mortality (important) Defined as mortality at discharge.
*LEZ vs. DZP Effect measure: RR [95% CI] A: not estimable B: 1.72 [95% CI 0.43 to 6.90],
Pooled effect (random effects model): RR 1.72 [95% CI 0.43 to 6.90], favoring IV DZP. Heterogeneity (I2): not applicable.
Outcome measure 4: requirement for ventilatory support (important) *LEZ vs. DZP Effect measure: RR [95% CI] A: 0.89 [95%CI 0.24 to 3.29] B: 1.20 [95%CI 0.43 to 3.39]
Pooled effect (random effects model): RR 1.07 [95%CI 0.48 to 2.41], favoring DZP. Heterogeneity (I2): 0%
Outcome measure 5: hypotension (important) *LEZ vs. DZP Effect measure: RR [95% CI] A: 2.68 [95%CI 0.11 to 63.71] B: N.R.
Pooled effect (random effects model): RR 2.68 [95%CI 0.11 to 63.71], favoring DZP. Heterogeneity (I2): not applicable. | Facultative: The results of this meta-analysis of RCTs showed that i.v. LOR was better than i.v. DZP for the cessation of adult SE.
Limitations: * Underlying aetiology and the duration of SE before benzodiazepine treatment were not clarified. * Lack of uniform definitions of SE.
Sensitivity analyses: N.R.
Heterogeneity: No statistically significant heterogeneity was found for all pooled analysis. |
N: number of patients; M/F: male/female; SE: Status Epilepticus; N.R: Not reported; LEV: levetiracetam; DZP: diazepam, PHT: phenytoin; VPA: valproate; LOR: lorazepam; CNP: clonazepam; GCSE: generalized convulsive status epilepticus.
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies
| Study reference | Study characteristics | Patient characteristics | Intervention (I) | Comparison / control (C)
| Follow-up | Outcome measures and effect size | Comments | |
| Kapur, 2019 | Type of study: RCT
Setting and country: USA
Funding and conflicts of interest: Not reported. | Inclusion criteria: *Age ≥ 2 years * Patients had been treated with benzodiazepines for generalized convulsive seizures lasting > 5min, and continued to have persistent or recurrent convulsions in the ED >5min after last dose of benzodiazepine and no more than 30min after the last dose of benzodiazepine. * Minimal cumulative doses benzodiazepines - adults: diazepam 10 mg, lorazepam 4 mg, midazolam 10mg; childres: diazepam 0.3 mg, lorazepam 0.1 mg, midazolam 0.3 mg *At ED: acute precipitant of seizure was major trauma, hypoglycemia, hyperglycemia, cardiac arrest, or postanoxia. *Pregnancy. *Incarcerated. *“ESETT declined”. *Patients that were already treated for current episode of SE with anticonvulsant agents other than benzodiazepines. *Allergies or contraindications to trial drugs. LEV: 145 fPHT: 118 VPA: 121 LEV: 33.3±26.0 fPHT: 32.8±25.4 VPA: 32.2±25.4
N Male (%): LEV: 77 (53.1%) fPHT: 71 (60.2%) VPA: 65 (53.7%)
Groups comparable at baseline? The baseline characteristics of the patients were similar in the 3 groups. | Levetiracetam (50 mg per milliliter).
The weight-based infusion rate: levetiracetam at a dose of 60 mg per kilogram (maximum, 4500 mg).
| Fosphenytoin (16.66 mg phenytoin equivalents [mgPE] per milliliter), Valproate (33.33 mg per milliliter).
The weight-based infusion rate: Fosphenytoin at a dose of 20 mgPE per kilogram (maximum, 1500 mgPE). Valproate at a dose of 40 mg per kilogram (maximum, 3000 mg). | Length of follow-up: hospital discharge or 30 days, whichever came first.
Loss-to-follow-up: N.R.
Incomplete outcome data: ITT analyses LEV: 145 fPHT: 118 VPA: 121
Safety analyses LEV: 150 fPHT: 125 VPA: 125
| Outcome measure 1: Drug administration to seizure cessation (critical) Cessation of seizures and improvement in consciousness at 60min without other AEDs ITT analyses LEV: 68/145 (47%) fPHT: 53/118 (45%) VPA: 56/121 (46%)
Outcome measure 2: of SE after drug administration (critical) Defined as interval from the start of infusion of the trial drug to the cessation of clinically apparent seizures 9(data available of LEV: 14, fPHT: 15, VPA: 10). Mean min (IQR) LEV: 10.5 (5.7-15.5) fPHT: 11.7(7.5-20.9) VPA: 7.0 (4.6-14.9)
Outcome measure 3: mortality (important) LEV: 7/150 (5%) fPHT:3/125 (2%) VPA: 2/125 (2%)
Outcome measure 4: requirement for ventilatory support (important) LEV: 12/150 (8.0) fPHT:16/125 (12.8) VPA: 10/125 (8.0)
Outcome measure 5: hypotension (important) LEV: 1/150 (1%) fPHT:4/125 (3%) VPA: 3/125 (2%)
Outcome measure 6: length of stay (important) Admission to ICU LEV: 87/145 (60.0%) fPHT: 70/118 (59.3%) VPA: 71/121 (58.7%) Median length of ICU stay (IQR) LEV: 1 (0–3) fPHT: 1 (0–3) VPA: 1 (0–3) Median length of hospital stay (IQR) LEV: 3 (1–7) fPHT: 3 (1–6) VPA: 3 (2–6)
| Conclusions: fosphenytoin, valproate, and levetiracetam were effective in approximately half the patients with benzodiazepine-refractory status epilepticus, and they did not differ significantly regarding effectiveness and safety.
Limitations: *Time to cessation of seizures after the start of drug were influenced by the limited number of patients for whom audio recordings were available to corroborate the time of seizure cessation. *Need for unblinding in some instances in order to choose a second anticonvulsant to treat ongoing seizures. *10% of the patients enrolled had psychogenic nonepileptic seizures. *Clinical rather than electroencephalographic criteria were used to determine the primary outcome of seizure cessation. *Different doses may have different efficacy. *Children + adults. *Relatively high percentage of enrolled patients had eligibility deviations related to benzodiazepine | |
| Study reference | Study characteristics | Patient characteristics | Intervention (I) | Comparison / control (C)
| Follow-up | Outcome measures and effect size | Comments | |
| Nene, 2019 | Type of study: RCT pilot study
Setting and country: tertiary care University teaching Hospital, India
Funding and conflicts of interest: No authors reported conflicts of interest. | Inclusion criteria: Elderly patients (age>60 years) with GCSE.
Exclusion criteria: * lack of consent, * patients presenting primarily with nonconvulsive SE, * hepatic or renal failure, cardiac disease, * history of allergy to the study drugs, * administration of any parenteral treatment
N total at baseline: Intervention: 60 Control: 58
Important prognostic factors2: Mean age ± SD I: 66.6 ± 6.7 C: 68.5 ± 8.0
Sex (M:F) I: 39:21 C: 34:24
Type of seizures * Focal with GTCS I: 25 (58.1) C: 18(41.9) * GTCS I: 35 (46.7) C: 40 (53.3)
Groups comparable at baseline? Yes, most of the baseline characteristics were similar except that the VPA arm had a higher frequency of alcohol abuse (p=0.039) and tachycardia (p=0.03) compared to the LEV arm. | Intravenous LEV was followed by administration of intravenous VPA or LEV.
VPA (20–25 mg/kg IV in 100 ml saline) was infused over 15-20 min and this was followed by maintenance dose (20-25 mg/kg/day in two divided doses). | LEV (20–25 mg/kg IV) was infused over 15 min followed by maintenance dose (20-25 mg/kg/day in three divided doses). | Length of follow-up: One month
Loss-to-follow-up: One month follow-up was available for 113/118 patients (missing: 4%).
Out of the 118 patients, 14 patients were excluded after randomization. * n=4 hyponatremia; * n=4 non-ketotic hyperglycemia; * n=3 cluster seizures (that were incorrectly diagnosed as GCSE * n=2 refusal to continue to be a part of the study * n=2 complete heart block * n=4 incorrectly assigned to VPA arm instead of LEV.
Thus 100 patients, including 50 each in the VPA- and LEV-arms, were analyzed for primary outcome of control of SE. All the 118 patients who were randomized (LEV: 58; VPA: 60) were included in Intention to Treat (ITT) analysis.
| Outcome measure 1: Drug administration to seizure cessation (critical) N.R.
Outcome measure 2: of SE after drug administration (critical) ITT analysis VPA: 41/60 (68.3%) LEV: 43/58 (74.1%) p=0.486
Outcome measure 3: mortality (important) ITT analysis Defined as 30-day mortality VPA: 13/60 (22.4%) LEV: 10/58 (18.2%) p=0.93
Outcome measure 4: requirement for ventilatory support (important) N.R.
Outcome measure 5: hypotension (important) N.R.
Outcome measure 6: length of stay (important) VPA: 3.6 ± 1.9 LEV: 4.4 ± 3.9 p=0.733
| Conclusions: The efficacy of VPA and LEV following initial LOR in controlling GCSE in elderly population was comparable.
Limitations *Elderly patients *Small sample size (lack power) *Single blinding *Serum AED levels were not performed which is important before deciding whether the drug is efficacious. *Continuous EEG monitoring was not done. *Study design: use of combination of LOR and another AED rather than LOR alone and then another AED, if seizures remained uncontrolled.
| |
| N: number of patients; M/F: male/female; SE: Status Epilepticus; N.R: Not reported; LEV: levetiracetam; DZP: diazepam, PHT: phenytoin; VPA: valproate; valproate; LOR: lorazepam; CNP: clonazepam; GCSE: generalized convulsive status epilepticus. | ||||||||
Table of quality assessment for systematic reviews of RCTs and observational studies
Study
| Appropriate and clearly focused question?1 | Comprehensive and systematic literature search?2
| Description of included and excluded studies?3 | Description of relevant characteristics of included studies?4 | Appropriate adjustment for potential confounders in observational studies?5 | Assessment of scientific quality of included studies?6 | Enough similarities between studies to make combining them reasonable?7 | Potential risk of publication bias taken into account?8 | Potential conflicts of interest reported?9 |
| Chu, 2020 | Yes Clearly defined aim and inclusion criteria. | Yes Search period and main terms of search strategy described. MEDLINE, EMBASE, and CENTRAL are searched. | Yes Excluded studies are referenced with reasons. | No Study characteristics and differences between RCTs are clearly described. Confounders not reported. | N.A. for RCTs | Yes Risk of bias assessed using Cochrane. | Unclear Assumptions made regarding SE type and definition. sNo heterogeneity was found, sensitivity test indicated stable outcomes. | No Not reported. | Unclear Not assessed for each of the included studies.
Funding: Science and Technology Department of Sichuan Province.
|
| Kobata, 2020 | Yes Clearly defined aim and inclusion criteria. | Yes Search period described and full search strategy available. MEDLINE, CENTRAL, and ICHUSHI are searched. | No Excluded studies are not referenced with reasons. | No Study characteristics and differences between RCTs are clearly described. Confounders not reported. | N.A. for RCTs | Yes Risk of bias assessed using GRADE. Certainty of evidence was rated as low. | Unclear Definition of SE and dosages differed between RCTs. No heterogeneity was found, sensitivity test indicated stable outcomes. | Yes Funnel plots suggested no existence of publication bias. | Unclear Not assessed for each of the included studies
Funding: *Japan Resuscitation Council, *Japan Societies of Neuroemergencies and Critical Care, *Japan Society of Intensive Care Medicine. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention, and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group)
Study reference
| Was the allocation sequence adequately generated? a
| Was the allocation adequately concealed?b
| Blinding: Was knowledge of the allocated interventions adequately prevented?c
| Was loss to follow-up (missing outcome data) infrequent?d
| Are reports of the study free of selective outcome reporting?e
| Was the study apparently free of other problems that could put it at a risk of bias?f
| Overall risk of bias If applicable/ necessary, per outcome measureg
|
| Kapur, 2019 | Probably yes
Reason: Central randomization process via WebDCU. The clinical team accessed an age-stratified trial “use next” medication Box. | Definitely yes
Reason: Nobody at the site (local pharmacy, clinical team, and study team) knew whether the next assignment is FOS, VPA, or LEV. | Probably yes
Reason: double-blinded RCT (blinding of patients, study team members, PIs, clinical coordinating center). Need for unblinding occurred in 200 of 400 enrollments. | Probably no
Reason: Not reported, ITT analyses. | Definitely yes
Reason: All relevant outcomes were reported, study protocol was registered. Funding: National Institute of Neurological Disorders and Stroke. | Probably yes
Reason: No other problems noted.
| SOME CONCERNS |
| Nene, 2019 | Definitely yes
Reason: Computer generated random numbers. | Probably yes
Reason: No specific remarks regarding blinding the randomization process. | Definitely no
Reason: Single-blinded RCT (blinding of healthcare providers, outcome assessors, data collectors, and analysts not reported). | Probably no
Reason: 1-mo follow-up was available for 113 out of 118pt (60 vs 58). 118pt were randomized and 100pt completed the study (50 vs 50). ITT analyses. | Probably yes
Reason: All relevant outcomes were reported, study was registered. Funding: Not reported. | Probably yes
Reason: No other problems noted.
| SOME CONCERNS |
- Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
- If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
- Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the methods section of an article can be compared with those whose results are reported.
- Problems may include: a potential source of bias related to the specific study design used (e.g. lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behavior; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body. Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
- Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favors experimental, or favors comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Table of excluded studies
| Author and year | Reason for exclusion |
| Alamrani, 2021 | Exclusion (wrong design) |
| Angurana, 2021 | Exclusion (wrong population) |
| Anonymous | Exclusion (wrong design) |
| Appleton, 2020 | Exclusion (reused data from Lyttle et al.) |
| Ayuga Loro, 2020 | Exclusion (wrong comparison, not conform PICO) |
| Ben-Menachem, 2019 | Exclusion (wrong population) |
| Brigo, 2019 | Exclusion (wrong population) |
| Brigo, 2019 | Exclusion (wrong population) |
| Brigo, 2020 | Exclusion (wrong design) |
| Celli, 2021 | Exclusion (wrong comparison, not conform PICO) |
| Chamberlain, 2020 | Exclusion (wrong population)) |
| Chiu, 2021 | Exclusion (wrong design) |
| Chung, 2019 | Exclusion (wrong design) |
| Cook, 2019 | Exclusion (wrong design) |
| DeMott, 2020 | Exclusion (wrong intervention) |
| Detyniecki, 2019 | Exclusion (wrong population, wrong intervention) |
| Devinsky, 2018 | Exclusion (wrong population) |
| Devinsky, 2020 | Exclusion (wrong population) |
| Farrokh, 2019 | Exclusion (wrong design, not conform PICO) |
| Galan, 2020 | Exclusion (wrong population) |
| Gulati, 2019 | Exclusion (wrong design, wrong intervention) |
| Gunning, 2021 | Exclusion (wrong population) |
| Hamano, 2019 | Exclusion (no comparison) |
| Hogan, 2020 | Exclusion (wrong population) |
| Huertas Gonzalez, 2019. | Exclusion (wrong design, not conform PICO) |
| Kazl, 2020 | Exclusion (wrong design) |
| Kim, 2020 | Exclusion (wrong design, no comparison) |
| Kim, 2021 | Exclusion (wrong design) |
| Klowak, 2021 | Exclusion (wrong population) |
| Leitinger, 2020 | Exclusion (wrong PICO) |
| Li, 2020 | Exclusion (wrong population) |
| Liampas, 2021 | Exclusion (wrong design) |
| Lu, 2020 | Exclusion (wrong PICO) |
| Maguire, 2021 | Exclusion (wrong intervention) |
| Magureanu, 2019 | Exclusion (wrong population) |
| Mandge, 2020 | Exclusion (wrong design) |
| Manfredonia, 2020 | Exclusion (not conform PICO) |
| Mastroianni, 2020 | Exclusion (wrong design, wrong population) |
| Menon, 2020 | Exclusion (wrong design, wrong population) |
| Minicucci, 2020 | Exclusion (wrong design) |
| Moalong, 2020 | Exclusion (no comparison, not conform PICO) |
| Müller, 2020 | Exclusion (wrong design) |
| Nakamura, 2021 | Exclusion (wrong design) |
| Nalisetty, 2020 | Exclusion (wrong population) |
| Neligan, 2019 | Exclusion (wrong design, not conform PICO) |
| Neligan, 2021 | Exclusion (wrong design) |
| Ochoa, 2021 | Exclusion (wrong population) |
| Panda, 2021 | Exclusion (wrong intervention) |
| Pribish, 2020 | Exclusion (wrong design, population) |
| Rossetti, 2021 | Exclusion (wrong design) |
| Sadeghi, 2020 | Exclusion (wrong design, no comparison) |
| Sanchez Fernandez, 2019 | Exclusion (wrong design) |
| San-Juan, 2019 | Exclusion (wrong intervention) |
| Sathe, 2021 | Exclusion (wrong population) |
| Schoeler, 2021 | Exclusion (niet conform PICO, incorrect P and I) |
| Sharshar, 2021 | Exclusion (wrong design) |
| Sobstyl, 2020 | Exclusion (wrong design, wrong intervention) |
| Specchio, 2020 | Exclusion (wrong design, wrong intervention) |
| Spencer, 2020 | Exclusion (geen status epilepticus studie, maar profylaxe na 2 aanvallen in 6u) |
| Strzelczyk, 2019 | Exclusion (longitudinal, no comparison) |
| Tanimoto, 2020 | Exclusion (wrong population) |
| Taran, 2020 | Exclusion (wrong design, wrong intervention) |
| Verma, 2019 | Exclusion (wrong design) |
| Vossler, 2019 | Exclusion (wrong design) |
| Vossler, 2020 | Exclusion (wrong design; wrong population) |
| Wheless, 2019 | Exclusion (wrong design) |
| Willems, 2020 | Exclusion (wrong population, wrong intervention) |
| Wongjirattikarn, 2019 | Exclusion (wrong design; too small population) |
| Woolfall, 2019 | Exclusion (wrong design; wrong PICO) |
| Xue, 2020 | Exclusion (wrong population) |
| Xue-Ping, 2019 | Exclusion (not conform PICO) |
| Yang, 2018 | Exclusion (wrong population) |
| Yi, 2020 | Exclusion (wrong design; too broad population) |
| Zhang, 2019 | Exclusion (wrong population)) |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 30-05-2023
Laatst geautoriseerd : 21-11-2022
Geplande herbeoordeling : 01-01-2024
In onderstaande tabel is de geldigheid te zien per richtlijnmodule. Tevens zijn de aandachtspunten vermeld die van belang zijn voor een herziening. Het cluster Epilepsie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn.
|
Module |
Geautoriseerd in |
Laatst beoordeeld in |
Geplande herbeoordeling |
Wijzigingen meest recente versie |
|
|
1. Startpagina - Epilepsie |
2022 |
2022 |
Na 1 jaar |
|
|
|
2. Informatie voor patiënten |
2022 |
2022 |
Na 1 jaar |
|
|
|
3. Definities en epidemiologie |
2018 |
2022 |
Na 5 jaar |
|
|
|
4. Classificatie |
2018 |
2022 |
Na 5 jaar |
|
|
|
5. Elektrofysiologisch onderzoek |
2020 |
2022 |
Na 5 jaar |
|
|
|
6. Neuropsychologisch onderzoek |
2020 |
2022 |
Na 5 jaar |
|
|
|
7. Immunologie |
|||||
|
7.1. Diagnostiek |
2019 |
2022 |
Na 1 jaar |
|
|
|
7.2. Therapie |
7.2.1. Immunotherapie |
2019 |
2022 |
Na 3 jaar |
|
|
7.2.2. Anti-epileptica |
2019 |
2022 |
Na 3 jaar |
|
|
|
8. Beeldvormend onderzoek |
2016 |
2022 |
Na 5 jaar |
|
|
|
9. Cardiologisch onderzoek |
2013 |
2022 |
Na 5 jaar |
|
|
|
10. Genetisch onderzoek |
2020 |
2022 |
Na 3 jaar |
|
|
|
11. Anti-epileptica |
|||||
|
11.1. Wanneer starten |
2018 |
2022 |
Na 3 jaar |
|
|
|
11.2. Mono- of combinatie therapie |
2013 |
2022 |
Na 3 jaar |
|
|
|
11.3. Welk anti-epilepticum |
11.3.1. Aanvallen met een focaal begin |
2020 |
2022 |
Na 1 jaar |
2022: Module compleet herzien |
|
11.3.2. Aanvallen met een gegeneraliseerd begin |
2020 |
2022 |
Na 1 jaar |
|
|
|
11.3.3. Aanvallen met een onbekend begin |
2013 |
2022 |
Na 1 jaar |
|
|
|
11.4. Algemene anti-epileptica |
2020 |
2022 |
Na 1 jaar |
|
|
|
11.5. Wanneer staken |
2020 |
2022 |
Na 3 jaar |
|
|
|
11.6. Generiek of specialité |
2020 |
2022 |
Na 1 jaar |
|
|
|
11.7. Cannabidiol |
2020 |
2022 |
Na 3 jaar |
|
|
|
12. Status epilepticus |
|||||
|
12.1. |
12.1.1. Couperen buiten het ziekenhuis en op de spoedeisende hulp |
2022 |
2022 |
Na 3 jaar |
2022: Module compleet herzien |
|
12.1.2. Refractaire status |
2020 |
2022 |
Na 3 jaar |
|
|
|
12.2. |
12.2.1. Initiële behandeling |
2022 |
2022 |
Na 3 jaar |
2022: Module compleet herzien |
|
12.2.2. Refractaire status |
2020 |
2022 |
Na 3 jaar |
|
|
|
12.2.3. Focale status |
2022 |
2022 |
Na 3 jaar |
|
|
|
12.2.4. Non-convulsieve status |
2017 |
2022 |
Na 3 jaar |
|
|
|
13. Bewaking bij anti-epilepticagebruik |
|||||
|
13.1. Monitoren serumspiegels anti-epileptica |
2013 |
2022 |
Na 5 jaar |
|
|
|
13.2. Monitoren klinisch-chemische en hematologische parameters |
2013 |
2022 |
Na 5 jaar |
|
|
|
13.3. Screening op osteoporose |
2020 |
2022 |
Na 3 jaar |
|
|
|
14. Epilepsiechirurgie |
2020 |
2022 |
Na 5 jaar |
2022: tekstuele optimalisatie (n.a.v. herziening vijf modules) |
|
|
15. Neurostimulatie |
|||||
|
15.1. Nervus vagus stimulatie |
2020 |
2022 |
Na 5 jaar |
|
|
|
15.2. Diepe hersen stimulatie |
2020 |
2022 |
Na 5 jaar
|
|
|
|
16. Ketogeen dieet |
2020 |
2022 |
Na 5 jaar |
|
|
|
17. Epilepsiesyndromen (bij kinderen) & anti-epileptica |
|||||
|
17.1. Absence epilepsie
|
17.1.1. Eerste keus medicatie |
2020 |
2022 |
Na 3 jaar |
|
|
17.1.2. Tweede keus medicatie |
2020 |
2022 |
Na 3 jaar |
|
|
|
17.1.3. EEG en medicatie |
2013 |
2022 |
Na 3 jaar |
|
|
|
17.2. Juveniele myoclonus epilepsie |
17.2.1. Eerste keus medicatie |
2020 |
2022 |
Na 3 jaar |
|
|
17.2.2. Tweede keus medicatie |
2018 |
2022 |
Na 3 jaar |
|
|
|
17.2.3. Wanneer staken? |
2020 |
2022 |
Na 3 jaar |
|
|
|
17.3. Rolandische epilepsie |
17.3.1. Behandeling geïndiceerd? |
2018 |
2022 |
Na 3 jaar |
|
|
17.3.2. Eerste keus medicatie |
2018 |
2022 |
Na 3 jaar |
|
|
|
17.3.3. Tweede keus medicatie |
2018 |
2022 |
Na 3 jaar |
|
|
|
17.4. Panayiotopoulos syndroom |
17.4.1. Behandeling geïndiceerd? |
2013 |
2022 |
Na 3 jaar |
|
|
17.4.2. Eerste keus medicatie |
2013 |
2022 |
Na 3 jaar |
|
|
|
17.4.3. Tweede keus medicatie |
2013 |
2022 |
Na 3 jaar |
|
|
|
17.5. Koortsconvulsies |
17.5.1. Preventieve medicatie |
2015 |
2022 |
Na 5 jaar |
|
|
17.5.2. Onderzoek bij recidiven |
2017 |
2022 |
Na 5 jaar |
|
|
|
18. Oudere patiënten |
|||||
|
18.1. Diagnostiek |
2020 |
2022 |
Na 5 jaar |
|
|
|
18.2. Behandeling |
2020 |
2022 |
Na 5 jaar |
|
|
|
19. Verstandelijke beperking |
|||||
|
19.1. Diagnostiek |
2020 |
2022 |
Na 5 jaar |
|
|
|
19.2. Behandeling |
2020 |
2022 |
Na 5 jaar |
|
|
|
20. Zwangerschap en hormonen |
|||||
|
20.1. Anti-epileptica en hormonale anticonceptie |
2020 |
2022 |
Na 3 jaar |
|
|
|
20.2. Anti-epileptica en zwangerschap |
2020 |
2022 |
Na 3 jaar |
|
|
|
20.3. Anti-epileptica en borstvoeding |
2018 |
2022 |
Na 3 jaar |
|
|
|
21. Beroerte |
|||||
|
21.1. Profylactische behandeling |
2015 |
2022 |
Na 5 jaar |
|
|
|
21.2. Behandeling na acuut symptomatische aanval |
2020 |
2022 |
Na 5 jaar |
|
|
|
21.3. Behandeling na laat symptomatische aanval |
2017 |
2022 |
Na 5 jaar |
|
|
|
21.4. Welk anti-epilepticum bij beroerte |
2020 |
2022 |
Na 5 jaar |
|
|
|
22. Oncologie |
|||||
|
22.1. Profylactische behandeling |
2020 |
2022 |
Na 5 jaar |
2022: Twee modules compleet herzien |
|
|
22.2. Welk anti-epilepticum |
2020 |
2022 |
Na 5 jaar |
||
|
23. Psychogene niet-epileptische aanvallen |
2020 |
2022 |
Na 5 jaar |
|
|
|
24. Aanvalsdetectie |
2020 |
2022 |
Na 3 jaar |
|
|
|
25. SUDEP |
2020 |
2022 |
Na 5 jaar |
|
|
|
26. Begeleiding |
2020 |
2022 |
Na 5 jaar |
|
|
|
27. Organisatie van zorg |
|||||
|
27.1. Welke functies in welke lijn |
2020 |
2022 |
Na 3 jaar |
|
|
|
27.2. Wanneer verwijzen |
2020 |
2022 |
Na 3 jaar |
|
|
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Doel
De epilepsiepatiënt in Nederland op eenduidige en wetenschappelijk onderbouwde wijze diagnosticeren en behandelen. Ter ondersteuning van de richtlijngebruiker wordt - daar waar relevant - verwezen naar de module Informatie voor patiënten. De inhoud van de patiënteninformatie valt buiten verantwoordelijkheid van de werkgroep.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie.
De richtlijn wordt vanaf 2013 jaarlijks geactualiseerd. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. Eventuele mutaties in de werkgroepsamenstelling vinden plaats in overleg met de Nederlandse Vereniging voor Neurologie, de werkgroep en de betreffende beroepsvereniging. Nieuwe leden dienen te allen tijden gemandateerd te worden door de betreffende beroepsvereniging. De werkgroep wordt ondersteund door adviseurs van het Kennisinstituut van Medisch Specialisten en door een voorlichter van het Epilepsiefonds.
Clusterstuurgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Drs. M.H.G. Dremmen, radioloog, Erasmus MC Rotterdam
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. J. Nicolai, kinderneuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Maastricht
- Dr. B. Panis, kinderneuroloog, Maastricht UMC+, Maastricht (betrokken tot 16-3-2021)
- Dr. C.M. Delsman-van Gelder, kinderneuroloog, RadboudUMC, Nijmegen (betrokken vanaf 01-01-2022)
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
- Drs. R. van Vugt, anesthesioloog, Sint Maartens Kliniek, Nijmegen
Clusterexpertisegroep
- Drs. F.M.S. Eshuis, AIOS Spoedeisende geneeskunde, Catharina Ziekenhuis, Eindhoven
Met ondersteuning van
- Dr. J. Buddeke senior adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
- Dr. C.T.J. Michels adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
- Dr. M.M.J. van Rooijen, adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Majoie* |
Functie: Neurologie Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe, Maastricht UMC+ |
Relevante commissies
|
Lopende onderzoek- en zorginnovatieprojecten (anders dan contract research) worden gefinancierd uit Erasmusplus, ZonMW, Nationaal epilepsiefonds, stichting vrienden van
Incidenteel financiële ondersteuning aan stichting Kempenhaeghe voor organisatie refereeravonden en workshops/symposia (telkens volgens geldende wet en |
Geen actie |
|
Dremmen |
Functie: Kinderradioloog met subspecialisatie kinderneuroradiologie |
|
Geen |
Geen actie |
|
Klarenbeek |
Functie: Neuroloog Werkgever: Zuyderland te Heerlen/Sittard (vrijgevestigd) |
Geen |
Geen |
Geen actie |
|
Nicolai |
Functie: Kinderneuroloog Werkgever: Maastricht UMC+. Tevens gedetacheerd/ werkzaam in Kempenhaeghe, Heeze; St Jansgasthuis, Weert; Elkerliek, Helmond en Viecuri, Venlo. |
Coördinator Sepion beginnerscursus; vergoeding wordt door Sepion naar AMBI goed doel gestort. Tevens betrokken bij Sepion gevorderden cursus en AVG cursus; vergoeding wordt door Sepion naar AMBI goed doel gestort. |
Boegbeeldfunctie bij een patiënten- of beroepsorganisatie |
Geen actie |
|
Panis |
Functie: Kinderarts, fellow metabole ziekten. Werkgever: Maastricht UMC+ 0.8fte, hiervan 0.2fte gedetacheerd in Radboudumc. |
Geen |
Geen |
Geen actie. Betrokken tot 16-03-2021. |
|
Van Vliet |
Functie: Intensivist Werkgever: Haaglanden Medisch Centrum te Den Haag |
|
Geen |
Geen actie |
|
Van Vugt |
Functie: Anesthesioloog Werkgever: Sint Maartenskliniek te Nijmegen |
Lid commissie kwaliteitsdocumenten NVA (onbetaald) |
Geen |
Geen actie |
Expertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Altinbas |
Functie: Neuroloog-kinderneuroloog |
Lid intern werkgroep epilepsie en genetica SEIN (onbetaald) |
Geen |
Geen actie |
|
Balvers |
Functie: Neuroloog (Behandeling van patiënten met epilepsie; klinisch, poliklinisch en in woonzorg) |
|
|
Mogelijk belangen bij Hoofdpijn. Geen restrictie voor Epilepsie. |
|
De Bruijn |
Functie: neuroloog in opleiding Werkgever: ETZ Tilburg |
Geen |
Geen |
Geen actie |
|
Eshuis |
Functie: AIOS Spoedeisende geneeskunde Werkgever: Catharina Ziekenhuis te Eindhoven |
APLS instructeur candidate, Stichting Spoedeisende Hulp bij Kinderen (onbetaald). |
Geen |
Geen actie |
|
Hofman |
Functie: Radioloog Werkgever: Maastricht UMC+ (1.0fte) |
Voorzitter interne werkgroep epilepsie en genetica SEIN (onbetaald) |
Geen |
Geen actie |
|
Jenniskens |
Functie: Community manager bij EpilepsieNL (voor 1 maart 2021: Epilepsiefonds en Epilepsie Vereniging Nederland (EVN)): 0.8fte |
Geen |
Geen |
Geen actie |
|
Koekkoek |
Functie: Neuroloog Werkgever: Leids Universitair Medisch Centrum (0.8fte), Haaglanden Medisch Centrum (0.2fte) |
|
Geen |
Geen actie |
|
Lazeron |
Functie: Neuroloog, wetenschappelijk onderzoeker Werkgever: neuroloog - Academisch centrum Epileptologie Kempenhaeghe Maastricht UMC+ (voltijds). |
CMIO bij Kempenhaeghe als gespecificeerd onderdeel van de functie bij Kempenhaeghe |
Geen |
Geen actie |
|
Leijten |
Functie: neuroloog Werkgever: UMC Utrecht |
Adviseur LivAssured en ProLira (onbetaald). |
|
Restrictie ten aanzien van besluitvorming met betrekking tot appartaren die aanvallen detecteren (e.g. Nightwatch®, DeltaScan®). |
|
Masselink |
Functie: Ziekenhuisapotheker Werkgever: Medisch Spectrum Twente |
Lid werkgroep Neurologische aandoeningen (inclusief gedrag) Horizonscan Geneesmiddelen, Zorginstituut Nederland (onbetaald). |
Geen |
Geen actie |
|
Reijneveld |
Functie: Neuroloog, Universitair Hoofddocent
Werkgever: 0.8fte Stichting Epilepsie Instellingen Nederland (SEIN) te Heemstede, 0.2fte Universitair Hoofddocent, afdeling Neurologie, Amsterdam UMC te Amsterdam. |
Voorzitter (per september 2020) Quality of Life Group van de European Organisation for Research and Treatment of Cancer (EORTC) (onbetaald) |
Geen |
Geen actie |
|
Ronner |
Functie: Neuroloog Werkgever: 0.8fte Amsterdam UMC |
|
Geen |
Geen actie |
|
Schijns |
Functie: Neurochirurg met specialisatie Epilepsiechirurgie en Neuro-oncologische Chirurgie |
Chairman SectionFunctional Neurosurgery, European Association of Neurosurgical Societies (EANS): onbetaald |
Principal Invetigator (PI) EpiUltra studie. Grantverstrekker Epilepsiefonds Nederland |
Geen actie |
|
Snoeijen |
Functie: Arts Verstandelijk Gehandicapten Werkgever: Kemenhaeghe, fulltime |
Geen |
Geen |
Geen actie |
|
Thijs |
Stichting Epilepsie Instellingen Nederland (1.0 fte) |
Geen |
|
Restrictie ten aanzien van besluitvorming met betrekking tot appartaren die aanvallen detecteren (e.g. Nightwatch®). |
|
Tousseyn |
Academisch Centrum voor Epileptologie (ACE) Kempenhaeghe/Maastricht UMC+, locatie Heeze |
Participeer in landelijke werkgroep Epilepsiechirurgie en de ACE-Werkgroep Epilepsiechirurgie |
Geen |
Geen actie |
|
Uiterwijk |
Functie: Epileptoloog Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe |
Geen |
Geen |
Geen actie |
|
Van 't Hof |
Functie: neuroloog Werkgever: SEIN (Stichting Epilepsie Instellingen Nederland) |
Geen |
Geen |
Geen actie |
|
Van Tuijl |
Functie: Neuroloog |
|
Geen |
Geen actie |
|
Tolboom |
Functie: Nucleair geneeskundige Werkgever: UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Verbeek |
Functie: Klinisch geneticus Werkgever: UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Vlooswijk |
Functie: Neuroloog Werkgever: Maastricht UMC+ |
Geen |
Geen |
Geen actie |
|
Wegner |
Functie: Neuroloog Werkgever: Stichting Epilepsie instellingen Nederland (SEIN) |
Voorts heb ik geen betaalde nevenwerkzaamheden |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van EpilepsieNL in het cluster. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan EpilepsieNL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in februari 2021.
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze module is geprioriteerd door het cluster.
Voor de geprioriteerde modules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model [Review Manager 5.4] werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Netwerk meta-analyse
Voor de beoordeling van de bewijskracht uit een netwerk meta-analyse (NMA) wordt gebruik gemaakt van de CINeMA-tool (Nikolakopoulou, 2020; Papakonstantinou, 2020). Met deze tool wordt op basis van een analyse in R de effectschattingen berekend. Voor het beoordelen van de bewijskracht, op basis van de berekende effectschattingen, worden zes domeinen geëvalueerd, namelijk Risk-of-Bias, publicatiebias, indirectheid, imprecisie, heterogeneteit and incoherentie. Voor het opstellen van de conclusies zijn principes van de GRADE working group gebruikt op basis van grenzen van klinische besluitvorming (Brignardello-Petersen, 2020).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brignardello-Petersen R, Florez ID, Izcovich A, Santesso N, Hazlewood G, Alhazanni W, Yepes-Nuñez JJ, Tomlinson G, Schünemann HJ, Guyatt GH; GRADE working group. GRADE approach to drawing conclusions from a network meta-analysis using a minimally contextualised framework. BMJ. 2020 Nov 11;371:m3900. doi: 10.1136/bmj.m3900. PMID: 33177059.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, Salanti G. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. doi: 10.1371/journal.pmed.1003082. PMID: 32243458; PMCID: PMC7122720.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Papakonstantinou T, Nikolakopoulou A, Higgins JPT, Egger M & Salanti G. CINeMA: Software for semiautomated assessment of the confidence in the results of network meta-analysis. Campbell Systematic Reviews 2020;16:e1080.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
