Type en timing hoestondersteunende technieken
Uitgangsvraag
Welke hoestondersteunende technieken moeten worden ingezet, bij welke patiënten en wanneer?
Aanbeveling
Beoordeel voor een tijdige start met de juiste hoestondersteunende techniek regelmatig (minstens 1 keer per jaar) PCF, VC en hoestfase.
Start met airstacken als:
- hoeststroomsterkte (peak cough flow) < 270 L/min en/of
- FVC van ≤ 50% [1] van de voorspelde waarde of < 1,5 l en/of
- MEP van < 60 cm H2O; en/of
- klinische symptomen van onvoldoende hoestkracht.
Overleg met CTB-arts over inzet hoestmachine als airstacken onvoldoende effectief is.
Start MI-E alleen na overleg met de CTB-arts bij:
- recidiverende luchtweginfecties ondanks maximale conservatieve maatregelen zoals airstacken, manueel comprimeren en vernevelen.
- een PCF < 160 l/min als bronchiaal secreet onvoldoende kan worden opgehoest met andere rekruteringstechnieken of onvoldoende kan worden verwijderd met bronchiaal toilet bij de invasief beademde patiënt.
Stel de MI-E als volgt in:
- Beoordeel per patiënt de juiste instellingen wat betreft druk en lengte inspiratietijd.
- De beste PCF wordt bereikt bij een suboptimale MIC.
- Vermijd hoge drukken en korte inspiratietijden bij patiënten met bulbaire klachten.
[1] Start bij patiënten met Duchenne spierdystrofie bij FVC ≤ 60 % van de voorspelde waarde, zie ook richtlijn Duchenne spierdystrofie
Overwegingen
In Nederland gebruiken we drie ACT-technieken namelijk Airstacken (AS), Mechanische in- /exsufflatie (MI-E) en Manuele assisted cough (MAC).
Met technieken als HFCWO en IPV is in Nederland nauwelijks ervaring en de onderzoeksresultaten geven onvoldoende uitsluitsel over de effectiviteit waardoor niet aanbevolen is deze in te voeren.
Zoals ook in de internationale richtlijnen wordt beschreven bevelen wij aan te starten met ACT als de PCF <270 L/min en /of FVC < 50% van voorspeld (Chatwin ea, 2018), aangezien dit de ondergrens is voor effectieve sputum mobilisatie bij patiënten ouder dan 12 jaar. Dit is een aanbeveling voor neuromusculaire patiënten in het algemeen. Specifiek voor de patiënten met Duchenne spierdystrofie wordt aanbevolen om eerder, dus bij FVC < 60 % van de voorspelde waarde te starten met ACT.
Door insufflatie tijdens AS of MI-E tot de maximale insufflatiecapaciteit in combinatie met manueel ondersteunde hoest (MAC) zal de PCF verbeteren. Het advies is om AS dagelijks twee keer toe te passen en vaker bij veel sputum. Deze frequentie is in de praktijk gebruikelijk en wordt vaak in studies gebruikt. Een onderbouwing hebben wij niet kunnen vinden.
Er is weinig wetenschappelijk bewijs voor inzet van de hoestmachine (Morrow ea 2013, Auger ea 2017, DMD Richtlijn, 2021). Desondanks wordt in de meeste richtlijnen zowel in Amerika, Canada als Europa aanbevolen de hoestmachine in te zetten (McKim ea, 2011, Chatwin ea 2018, Birnkant ea, 2018). Er komen ook steeds meer overwegingen om de hoestmachine pas in te zetten als bijvoorbeeld AS niet meer volstaat. Lacombe ea (2014) hebben drie technieken vergeleken en concludeerden dat de hoestmachine alleen zinvol is als het niet meer lukt om de PCF te verhogen met behulp van insufflatie (AS) en MAC. Bij een PCF > 300l/min kan de hoestmachine de flow van de patiënt niet voldoende ondersteunen. De hoestmachine dient te worden ingezet als AS en MAC niet meer effectief zijn.
In het overzicht van Toussaint ea (2018) wordt dit ook vanuit kosteneffectiviteitsoverwegingen aanbevolen.
In Nederland wordt de hoestmachine nog terughoudend ingezet in afwachting van onderzoek dat in de loop van 2021 gaat starten.
In afwachting van dit onderzoek in 2021 volgen we de mening van de experts. Die luidt als volgt:
- Start met airstacken bij een PCF < 270l/min en/of FVC < 1,5 l.
- Het CTB kan besluiten om de hoestmachine in te zetten als AS niet meer volstaat en/of PCF < 160l/min.
- Meer onderzoek is nodig om het juiste moment van inzet van de hoestmachine te bepalen.
Onderbouwing
Achtergrond
Voor patiënten met een afgenomen respiratoire reserve zoals bij neuromusculaire aandoeningen, (hoge) dwarslaesie en thoracale kyfoscoliose (groep I en II), vormen luchtweginfecties en alveolaire hypoventilatie een belangrijke oorzaak van morbiditeit, ziekenhuisopnames en mortaliteit (Chatwin ea 2018). Vaak hebben deze patiënten een (dreigende) respiratoire insufficiëntie, onvoldoende hoestkracht of een combinatie van beide. Door meer sputum zoals bij een luchtweginfectie, kan de hoestkracht verder gecompromitteerd raken. Hierdoor neemt het risico op een pneumonie, atelectasevorming en hypoventilatie verder toe en zal uiteindelijk ook de mortaliteit verder toenemen (Ambrosino ea, 2009).
Afname van zowel de inspiratoire als ook de expiratoire kracht leidt tot de volgende problemen:
- Verstijving van de borstkas door de verminderde adembeweging waardoor de ademarbeid toeneemt.
- Oppervlakkigere ademhaling, dit vergroot de kans op atelectase.
- Minder effectieve hoest door afname van de kracht van de uitademingsspieren. (Perrin ea, 2004)
Al in 1997 beschreef Bach het belang van hoestondersteunende technieken bij patiënten met neuromusculaire aandoeningen (NMA) en het meten van de Peak Cough Flow (PCF). Een normale PCF is > 360l/min. Bij een PCF < 270l/min is het advies om te starten met hoestondersteunende technieken (Bach 1997).
In de praktijk zijn er veel vragen over wanneer te starten met hoestondersteunende technieken en welke specifieke vorm bij welke patiëntengroep het best kan worden toegepast. Deze module bespreekt de problemen door verminderde sputumevacuatie. Op basis van de huidige stand van onderzoek in combinatie met expert-opinion worden de verschillende hoestondersteunende technieken behandeld en aanbevelingen geformuleerd. Voor de bespreking van de literatuur volgen wij de indeling van Chatwin en Boitane in hoestfasen (Chatwin 2018, Boitane 2006) en de indeling van Chatwin (2018) in Airway Clearance Techniques (ACT’s).
De behandeling van de alveolaire hypoventilatie is chronische beademing. Hierop wordt uitgebreid ingegaan in de modules 'Algemene doelen van chronische beademing' en 'Criteria voor starten chronische beademing'.
Hoestfasen:
Een effectieve hoest kent drie fases (Chatwin 2018, Boitane 2006):
- Een diepe inademing.
- Sluiten van de stembanden. Hierbij is het van belang dat de bulbaire functie intact is.
- Vervolgens wordt er druk opgebouwd door het aanspannen van de uitademingsspieren en op het moment dat de stembanden opengaan wordt er lucht naar buiten verplaatst.
Belangrijk voor het bepalen welke techniek het best ingezet kan worden is een beoordeling van de hoest, zodat duidelijk wordt in welke fase het probleem zit. Afhankelijk van de probleemfase wordt de behandelingstechniek gekozen.
Incidenteel worden patiënten met ernstige meervoudige beperking verwezen naar het CTB. Ook bij deze groep speelt een slechte hoestkracht vaak een belangrijke rol, vanwege slechte instrueerbaarheid en trainbaarheid kan de inzet van hoestondersteunende technieken moeilijker zijn. Inzet van gespecialiseerde fysiotherapeuten kan hierbij een oplossing zijn.
Airway Clearance Techniques, terminologie en indeling:
Er worden in de internationale literatuur verschillende termen gehanteerd. Vaak wordt de overkoepelende term ‘ACT’ (airway clearance techniques) gebruikt. Hierbij worden enerzijds hoestondersteunende technieken (proximale ACT’s) en anderzijds sputummobiliserende technieken (perifere ACT’s) onderscheiden. In deze module gebruiken wij als overkoepelende term hoestondersteunende technieken.
Figuur 1 geeft het overzicht van Chatwin ea (2018) met de verschillende ACT-technieken ingedeeld naar proximaal en perifeer.
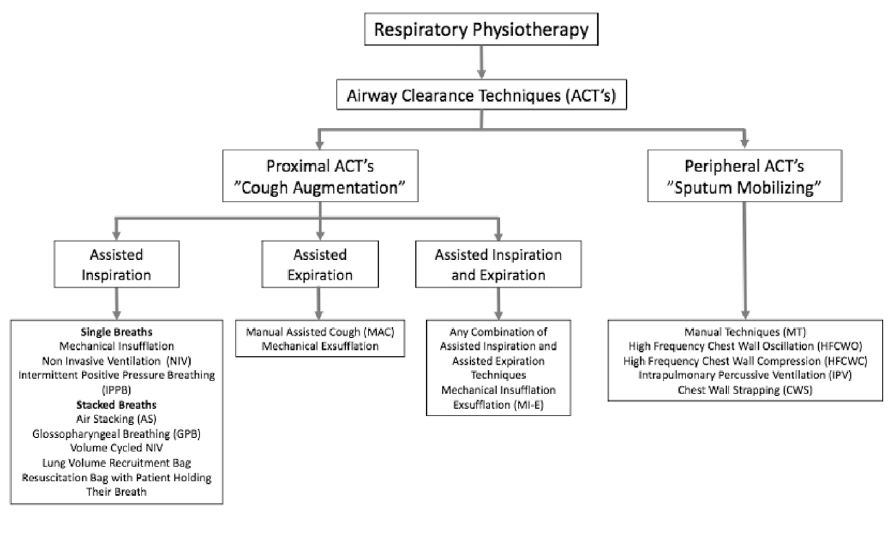
Figuur 1 Overzicht airway clearance techniques (Chatwin ea. 2018)
Proximale ACT’-s
Hoestondersteunende technieken
Hoestondersteuning kan door het vergroten van ingeademde volume (assisted inspiration). Hierbij wordt extra lucht ingeblazen tot de maximale insufflatiecapaciteit (MIC) wordt bereikt. Het inblazen van lucht kan op verschillende manieren met een handbeademingsballon (airstacken), met een beademingsmachine in volume of drukgecontroleerde modus of met de hoestmachine, de mechanische in-/exsufflatie (MI-E). Het kan ook door de patiënt zelf zonder apparaat, door lucht via een speciale techniek in te ademen, het zogenoemde kikkeren. Het kikkeren vereist een speciale vaardigheid en er zijn in Nederland weinig mensen in staat patiënten deze techniek aan te leren.
Kang &Bach (2000) adviseren bij een VC < 50% van de voorspelde waarde of minder dan 1,5 l te starten met airstacken (AS). McKim (2012) onderzocht het effect van airstacken op de FVC bij patiënten met Duchenne spierdystrofie en zag een afname van de daling van de FVC van 4,7% per jaar naar 0,5% door dagelijks airstacken. Door regelmatig de longen maximaal te insuffleren blijft de bewegelijkheid van de borstkas en longen groter. Inmiddels zijn er veel internationale richtlijnen die de start van hoestondersteunende technieken aanbevelen bij een PCF < 270l/min (Birnkant ea, 2018, Buu, 2017).
Belangrijk werk is gedaan door de European Neuromuscular Centre (ENMC). Deze groep bestaande uit 21 experts heeft een overzicht heeft gemaakt van beschikbare hoestondersteunende technieken en de kosten (Toussaint ea, 2017, Chatwin ea, 2018).
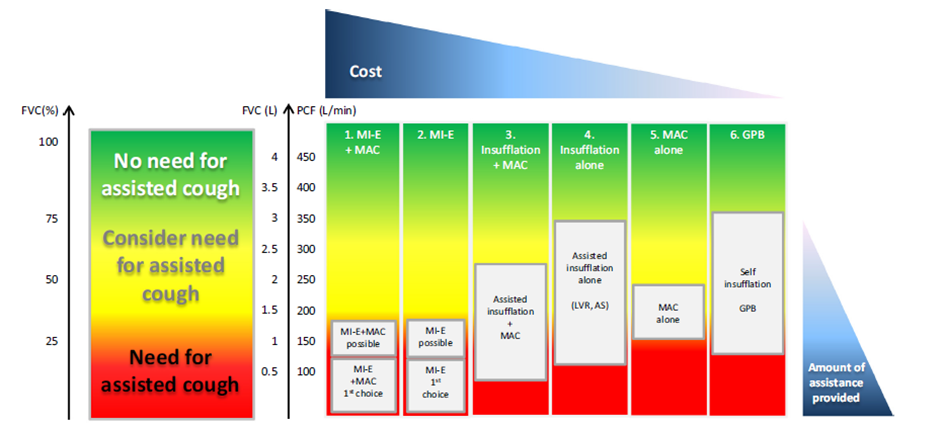
Figuur 2 Toussaint ea 2018. Overzicht hoestondersteunende technieken in relatie tot FVC, PCF en kosten.
Figure 2 seeks to integrate the published literature regarding critical values percent predicted FVC (% FVC, in all individuals), vital capacity (FVC, in adolescents and adults only) and peak cough flow (PCF, in adolescents and adults only), relative cost and the amount of assistance required for the initiation of proximal airway clearance techniques (cough augmentation) (excluding training costs and time). The values on the axes are intended to be used as a guide to practice in neuromuscular disease (NMD) as a group, but not as critical or threshold values in any individual patient with NMD and intact bulbar function. FVC% is the input axis to guide the reader. The ENMC participants considered individualisation of care critical for effective practice in NMD. The clinician can decide on what technique mechanical in-/exsufflation (MI-E), manually assisted cough (MAC), air stacking (AS) lung volume recruitment (LVR) or glossopharyngeal breathing (GPB) to use depending on the following objective measurements: FVC% (in all individuals), and PCF and FVC in individuals 12 years and older. Therapy for the person with NMD must be individualised according to local availability, efficacy, comfort, tolerance and preference. Note that reported PCF values may be measured when patients are either well or unwell.
Mellies ea (2014) heeft de optimale insufflatiecapaciteit voor de hoogste PCF onderzocht. Uit deze studie met 36 adolescenten en jongvolwassenen met NMD en 20 gezonde vrijwilligers bleek dat niet maximale maar submaximale insufflatie tot de beste PCF leidt. Er werd gebruik gemaakt van intermittent positive pressure breathing (IPPB) en lung insufflation assist maneuver (LIAM). IPPB is insufflatie met een drukgecontroleerde machine en bij LIAM wordt er een vast volume ingeblazen. De meest optimale drukken waren tot 30 cmH2O of 90% van de MIC.
Manueel ondersteunde hoest (MAC)
Manueel ondersteunde of geassisteerde hoest (MAC) is comprimeren op buik en/of borst tijdens de hoest. Bij manuele compressie moet wel rekening gehouden worden met eventuele osteoporose zeker bij patiënten die al fracturen hebben gekregen.
Patiënten met expiratoire spierzwakte maar relatief goede inspiratoire spierkracht kunnen baat hebben bij MAC (Boitano, 2006). De kracht van de uitademingsspieren wordt gemeten door de monddrukken (MEP) (Trebbia ea, 2005). Bij een MEP > 34 cmH2O kan comprimeren averechts werken (Toussaint ea, 2009).
Geassisteerde inspiratie en expiratie
Vaak is er een probleem bij zowel de in- als de uitademing. Dan is een combinatie van airstacken en comprimeren het meest effectief. Toussaint ea (2009) geven aan dat in klinisch stabiele patiënten de VC en MEP goede voorspellers kunnen zijn voor de effectiviteit van het airstacken. Patiënten met een VC > 340 ml en MEP < 34 cm H2O kunnen met airstacken en comprimeren de PCF verbeteren waardoor de PCF boven de 180 l/min uitkomt. Overweeg AS met een one-way-valve eventueel gecombineerd met MAC als de MI-E niet beschikbaar is (Gruis & Lechtzin, 2012).
In twee retrospectieve cohortstudies hebben Bach ea (1997) en Tzeng ea (2000) aangetoond dat gebruik van MI-E bij patiënten met neuromusculaire aandoeningen en een saturatie < 95% ziekenhuisopnames verminderd. (Bach ea, 1997 en Tzeng ea, 2000). Toussaint ea (2009) geven aan dat de inzet van MI-E bijna nooit nodig is bij stabiele patiënten met een neuromusculaire aandoening met goede bulbaire functie. MI-E kan overwogen worden bij patiënten waarbij MAC en AS niet effectief is.
Is er sprake van bulbaire problematiek, zoals bijvoorbeeld bij ALS-patiënten dan kan het zinvol zijn om MI-E te proberen maar is de kans van slagen lager. Gruis & Lechtzin (2012) doen de volgende aanbevelingen: zet de hoestmachine in bij ALS patiënten met een PCF <160 l/min zonder symptomen van onvoldoende sputumklaring of bij PCF < 255-270l/min met klachten. Bij patiënten met bulbaire problemen kan het door verminderde glottissluiting moeilijker zijn voldoende longvolume te verkrijgen en te behouden tijdens de insufflatie voor goede sputumklaring. Bovendien kan de negatieve druk, tijdens exsufflatie, ertoe leiden dat de farynx sluit en er een luchtwegobstructie ontstaat (Gruis & Lechtzin, 2012). Dit komt ook overeen met de bevindingen van Anderson ea (2018). Bij ALS-patiënten worden hoge insufflatiedrukken afgeraden, ze werken vaak contraproductief en kunnen leiden tot obstructies. De reactie van de larynx is trager waardoor asynchrony ontstaat. Het advies is daarom bij ALS-patiënten de cycli van de MI-E niet te kort te maken door langere insufflatietijden te gebruiken en de drukken niet te hoog te maken.
De instellingen moeten steeds aangepast worden als de spierzwakte toeneemt. Chatwin ea (2018) geven ook aan dat het instellen van de MI-E individueel moet gebeuren. Zij bevelen aan om ook bij stabiele patiënten de MI-E dagelijks te blijven gebruiken om getraind en vertrouwd te blijven in de handeling zodat de MI-E ingezet kan worden bij luchtweginfecties.
Perifere ACT-technieken
Perifere ACT technieken zoals manuele techniek (MT), high frequency chest wall oscilation (HFCWO), intrapulmonary percussive ventilation (IPV) kunnen effectief zijn bij patiënten met neuromusculaire aandoeningen (NMA), echter belangrijk daarbij is de beschikbaarheid en expertise van de lokale behandelaars (Chatwin ea, 2018). Perifere ACT zorgt voor verbetering van de ventilatie en maakt slijm in de perifere luchtwegen los en transporteert het naar de centrale luchtwegen. Daarna kan met behulp van proximale ACT het secreet verwijderd worden.
HFCWO
Technieken zoals HFCWO hebben vooral effect op de viscositeit van het sputum en bevorderen de sputumevacuatie van distale luchtwegen. Voor patiënten met CF zijn de effecten aangetoond. Bij patiënten met NMA niet (Chaisson ea, 2006). Zij hebben in principe ook geen problemen met de elasticiteit van het sputum behoudens bij luchtweginfecties of door hoge flow tijdens beademing zonder adequate bevochtiging. Yuan ea (2010) lieten een goede tolerantie en therapietrouw zien van de HFCWO maar konden geen significante effecten op ziekenhuisopname en antibioticagebruik aantonen. Verder onderzoek naar de effecten op langere termijn is nodig.
IPV
Toussaint ea (2003) hebben IPV toegepast bij invasief beademde Duchenne-patiënten. Bij de patiënten met hypersecretie werd significant meer sputum verkregen na ACT door fysiotherapie met IPV dan zonder IPV. Dit onderzoek leverde geen duidelijke gegevens op over de effecten op ziekenhuis opname en luchtweginfecties.
Aangezien mensen met een NMA geen primair longprobleem hebben en de expertise en beschikbaarheid ontbreekt voor deze patiëntengroep worden IPV en HFCWO in Nederland nauwelijks ingezet.
Aandacht voor overmatige speekselvloed, vochthuishouding en luchtvochtigheid.
Overmatige speekselvloed door bulbaire dysfunctie en verslikken kunnen samen met verminderde hoestkracht leiden tot aspiraties en recidiverende luchtweginfecties. Het is daarom van belang ook deze problemen in kaart te brengen en te behandelen. Daarnaast zijn een goede vochthuishouding en luchtvochtigheid van invloed op de mucociliaire klaring en dient ook hiervoor aandacht te zijn bij de bestrijding van luchtweginfecties (Sahni &Wolfe, 2018). Verneveling en het toedienen van voldoende vocht spelen hierbij een belangrijke rol, zodat taai slijm wordt voorkomen (McGeachan & McDermott, 2017).
Conclusies
De literatuur bevat vooral studies en reviews waarin het effect op de peak cough flow (PCF) en de vitale capaciteit (VC) wordt beschreven. Er zijn vooral kleine groepen onderzocht met verschillende uitkomstmaten en langetermijneffecten ontbreken.
Uit het bovenstaande in combinatie met expert-opinion trekt de werkgroep de conclusie dat hoestondersteunende technieken zinvol zijn, maar aanvullend onderzoek noodzakelijk is om tot wetenschappelijk onderbouwde aanbevelingen te komen.
Samenvatting literatuur
De geïncludeerde artikelen worden hieronder besproken, zoveel mogelijk ingedeeld naar ingezette hoestondersteunende techniek.
Airstacken (AS)
Toussaint ea onderzochten in een RCT 52 patiënten met Duchenne spierdystrofie (DMD) met niet-invasieve beademing. Het verschil in airstacken met handbeademingsballon en beademingsmachine werd onderzocht. Er was geen verschil in maximale insufflatiecapaciteit (MIC) of PCF tussen beide technieken. De handbeademingsballon is eenvoudig in het gebruik en veel minder duur. Een PCF > 160 L/min is een cruciaal punt voor het voorkomen van tracheotomie. DMD-patiënten die een PCF < 90 L/min hebben zonder hoestondersteuning halen deze kritische grens van een PCF > 160 L/min vaak niet ondanks airstacken en het gebruik van een hoestmachine. Bij patiënten met DMD kan wel in het algemeen gesteld worden dat aanvullende manuele compressie of mechanische exsufflatie met de hoestmachine de hoestkracht verder kan doen toenemen. (Toussaint ea, 2016).
Cleary ea, 2013 deden een cross-over-designonderzoek naar de effecten van hoestondersteunende technieken op de longfunctie. Bij 29 ALS-patiënten werden longfunctietesten afgenomen met en zonder AS met minimaal 24 uur tussen de metingen. Elke meting werd drie keer gedaan, T1 bij start, T2 15 min na wel of niet AS en T3 na 30 minuten. FVC significant hoger op T2 PCF significant hoger in T2 en T3. Hieruit blijkt dat het effect van AS op de hoestkracht enige tijd aanhoudt.
Brito ea, 2009 hebben een RCT gedaan bij 28 patiënten met DMD. Ze vergeleken airstacken met MAC alleen en met een combinatie van AS en MAC. De testen werden op 1 dag uitgevoerd. De volgorde van behandeling met MAC, AS en AS plus MAC werd at random bepaald. De PFC verbeterde in alle gevallen. De verbetering van de PCF was na de gecombineerde behandeling (AS plus MAC) significant hoger dan de verbetering van AS of MAC alleen.
High frequency chest wall oscillation (HFCWO)
Yuan ea, 2010 en Chaisson ea, 2006 hebben gekeken naar de effecten van HFCWO. Yuan ea onderzochten in een RCT bij 28 jongeren met een neuromusculaire aandoening (NMA) of cerebral palsy het gebruik van HFCWO via het vest met standaard fysiotherapie. De therapietrouw was groter in de interventiegroep. De therapie werd goed verdragen. Hoewel de data goede tolerantie en therapietrouw lieten zien zijn grotere studies nodig om de effecten op o.a. sputumevacuatie en ziekenhuisopnames aan te tonen.
Chaisson ea, 2006 onderzochten in een RCT 9 ALS-patiënten. De interventie groep kreeg standaardzorg en HFCWO. De controlegroep kreeg standaardzorg, airstacken en MAC. Er werden geen significante klinische verschillen gevonden ten aanzien van overleving en longfunctie. Overleving was niet beter in de groep die HFCWO kreeg. De groepen waren erg klein en er zat een significant leeftijdsverschil in de groepen. En een deel van de data werd retrospectief verkregen.
Intra pulmonale percussieve ventilatie (IPV)
Toussaint ea, 2003 pasten in een cross-over-design intra pulmonale percussieve ventilatie (IPV) toe bij 8 invasief beademde DMD-patiënten. De patiënten met hypersecretie hoestten significant meer sputum op na behandeling met IPV, dit gold niet voor de patiënten zonder hypersecretie. De onderzoeksgroep was erg klein en de follow up 5 dagen zodat er geen uitspraken over langeretermijneffecten gedaan kunnen worden.
Mechanische in-/exsufflatie (MI-E)
Pallastrini ea (2005) vergeleken in een RCT met een onbekend aantal patiënten de inzet van de hoestmachine met manuele fysiotherapie bij invasief beademde patiënten met een hoge dwarslaesie, en hypersecretie. De FVC, FEV1 en PCF verbeterden duidelijk in de interventiegroep. Lacombe ea (2014) onderzochten in een cross-over-design-studie drie verschillende hoestondersteunende technieken (IPPB+MAC, MI-E en MI-E+ MAC) bij 18 patiënten met een NMA en een PCF < 3 l/sec (180 l/min). Met de IPPB + MAC verbeterde de PCF het meest. Bovendien zagen zij dat inzet van de MI-E + MAC bij patiënten waarbij de PCF met hoestondersteunende techniek steeg boven de 5 l/sec niet zinvol was. Ze adviseren om bij elke patiënt de verschillende hoestondersteunende technieken op effectiviteit te beoordelen. IPPB staat voor intermittent positief pressure breathing en wordt gegeven met een drukgestuurde machine (Alpha 200c Air liquide). Gedurende 5 seconde wordt lucht ingeblazen met een positieve druk tot max 40 cmH2O.
Rafiq ea (2015) vergeleken AS met MI-E bij 40 niet-invasief beademde ALS-patiënten in een RCT. Er is geen significant verschil gevonden in duur van de luchtweginfecties en het gebruik van antibiotica. De overleving was hoger in de AS-groep. Oorzaak hiervan zou kunnen zijn dat belangrijke verschillen zoals PCF en falen NIV niet waren meegenomen in de randomisatie. Zij bevelen AS aan als therapie voor sputummobilisatie en volumerecruitment mede vanwege de lage kosten.
Uit de Cochrane review van Morrow ea (2013) blijkt dat er weinig bewijs is voor de inzet van de hoestmachine.
Ook Auger ea (2017) geven in een systematische review aan dat er nog steeds onvoldoende bewijs is voor de inzet van de hoestmachine bij patiënten met een NMA.
Uit een recente literatuurstudie naar effecten van airstacken en het gebruik van een hoestmachine op behoud van longfunctie en preventie/behandeling van longproblemen bij patiënten met DMD bleken er geen RCT’s te zijn om deze vraag kunnen beantwoorden. (Duchenne Spierdystrofie richtlijn 2021). Als belangrijkste reden voor de zeer lage bewijslast geeft de richtlijn de kennislacune aan, er ontbreken goede methodologische studies. Er zijn geen studies gevonden met betrekking tot de effectiviteit van de LVR-technieken. Verder wordt gesteld dat: “Het gebrek aan studies naar het effect van de longvolume rekruterende technieken, airstacken en het gebruik van een hoestmachine niet betekent dat deze technieken achterwegen gelaten moeten worden bij de behandeling van patiënten met Duchenne spierdystrofie (DMD). Het uitvoeren van een gerandomiseerd gecontroleerd onderzoek waarbij de controlegroep geen interventie krijgt, is onethisch gezien de vergrote kans op een pneumonie bij een inefficiënte hoest”.
McCaughey ea (2016) onderzochten bij een patiënt met een C6-dwarslaesie de inzet van de MI-E in combinatie met de abdominale functionele elektrische stimulatie (AFES). Met AFES werden er grotere effecten op de longfunctie gezien waarmee verondersteld wordt dat de sputumevacuatie groter zal worden. Er zijn geen langere termijneffecten beschikbaar en deze techniek is nog niet verder uitgewerkt. Meer onderzoek is nodig.
Senent ea, 2011 beoordeelden tijdens een poliklinisch consult bij 16 klinisch stabiele ALS-patiënten die niet-invasief beademd werden 6 verschillende hoestondersteunende technieken. Alle instrumentele technieken (AS plus MAC, IPAP (zoals gebruikt voor NIV) plus MAC, IPAP 30 cmH2O met MAC en MI-E gaven een significante verbetering van de PCF. Er werden geen significante verschillen gevonden tussen de bulbaire en niet- bulbaire patiënten. MI-E was niet voor iedere patiënt de beste behandeling. Zij adviseren diverse technieken in te zetten bij een patiënt en individueel te beoordelen welke behandeling het beste effect heeft voor die patiënt.
Zoeken en selecteren
Voor het beantwoorden van de uitgangsvraag is oriënterend literatuuronderzoek gedaan naar de volgende vraag:
Welke hoesttechniek is het meest geschikt voor patiënten met een neuromusculaire aandoening of dwarslaesie ter voorkoming van respiratoire complicaties?
Zoekstrategie
In de database Pubmed is op 17-9-2019 een oriënterende search verricht naar relevante literatuur over hoestondersteunende technieken bij neuromusculaire patiënten en patiënten met een dwarslaesie. Totaal leverde dit 168 titels op.
Hieruit zijn de dubbele verwijderd en de RCT’s, clinical trials, systematische reviews en reviews zijn geselecteerd. De overgebleven 55 artikelen zijn beoordeeld op titel en relevantie. Exclusiecriteria zijn:
- Taal: alle artikelen die niet in het Engels of Nederlands zijn geschreven.
- Niet relevant voor onze uitgangsvraag, niet de juiste populatie
- Artikelen over acute zorg
- Artikelen over kinderen.
- Niet full-tekst beschikbaar
Na toepassing van de exclusiecriteria zijn er negen RCT’s en twee systematische reviews gevonden. Omdat er zo weinig evidence is zijn ook overige onderzoeken en reviews meegenomen in de bespreking. Veel behandelen verschillende sputumevacuatie en hoestondersteunende technieken. Alle studies bevatten kleine groepen en zijn door het verschil in populatie, therapieën en uitkomstmaten niet onderling te vergelijken.
Referenties
- Ambrosino N, Carpenè N, Gherardi M, 2009. Chronic Respiratory Care for Neuromuscular Diseases in Adults. Eur Respir J. 34 (2), 444-51.
- Anderson TM, Sandnes A, Fondenes O, Nilsen RM, Tysnes O-B, Heimdal J-H, Clemm HH, Halvorsen T, Vollsaeter M, Roksund O, 2018. Laryngeal responses to mechanically assisted cough in progressing Amyotrophic Lateral Sclerosis. Respir Care 63(5):538-549.
- Auger C, Hernando V, Galmiche H. 2017. Use of Mechanical Insufflation-Exsufflation Devices for Airway Clearance in Subjects With Neuromuscular Disease. Respir Care. 2017 Feb;62(2):236-245. doi: 10.4187/respcare.04877. PMID: 28108686.
- Bach JR, Ishikawa Y, Kim H, 1997. Prevention of pulmonary morbidity for patients with Duchenne muscular dystrophy. Chest;112:1024-8
- Birnkrant DJ, Bushby K, Bann CM, Alman BA, Apkon SD, Blackwell A, Case LE, Cripe L, Hadjiyannakis S, Olson AK, Sheehan DW, Bolen J, Weber DR, Ward LM for the DMD Care Considerations Working Group. 2018. Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. Lancet Neurol 17: 347–61.
- Boendert A, Cao M, Maas D, De Mattia E, Falcier E, Goncalves M, Holland V, Katz SL, Orilikowski D, Sannicolo G, Wijkstra P, Hellerstein L, Sanone VA. 2019. Consensus-based care recommendations for pulmonologists treating aduls with myotonic dystrophy type 1. Respiration DOI; 10.1159/000505634.
- Boitano LJ. 2006 Management of airway clearance in neuromuscular disease. Respir Care. 2006 Aug;51(8):913-22; discussion 922-4. PMID: 16867201.
- Brito MF, Moreira GA, Pradella-Hallinan M, Tufik S. 2009. Air stacking and chest compression increase peak cough flow in patients with Duchenne muscular dystrophy. J Bras Pneumol. 2009 Oct;35(10):973-9. English, Portuguese. doi: 10.1590/s1806-37132009001000005. PMID: 19918629.
- Buu, MC. 2017. Respiratory complications, management and treatments for neuromuscular disease in children. Curr Opin Pediatr. 2017 Jun;29(3):326-333. doi: 10.1097/MOP.0000000000000498. PMID: 28338488 Review.
- http://www.canventottawa.ca/EducationModules geraadpleegd 10 maart 2020.
- Chaisson KM, Walsh S, Simmons Z, Vender RL. A clinical pilot study: high frequency chest wall oscillation airway clearance in patients with amyotrophic lateral sclerosis. Amyotroph Lateral Scler. 2006 Jun;7(2):107-11. doi: 10.1080/14660820600640570. PMID: 16753975
- Chatwin M, Simonds AK. 2009. The addition of mechanical insufflation/exsufflation shortens airway-clearance sessions in neuromuscular patients with chest infection. Respir Care. 2009 Nov;54(11):1473-9. PMID: 19863831.
- Chatwin M, Toussaint M, Gonçalves MR, Sheers N, Mellies U, Gonzales-Bermejo J, Sancho J, Fauroux B, Andersen T, Hov B, Nygren-Bonnier M, Lacombe M, Pernet K, Kampelmacher M, Devaux C, Kinnett K, Sheehan D, Rao F, Villanova M, Berlowitz D, Morrow BM. 2018. Airway clearance techniques in neuromuscular disorders: A state of the art review. Respir Med. 2018 Mar;136:98-110. doi: 10.1016/j.rmed.2018.01.012. Epub 2018 Feb 6. PMID: 29501255.
- Cleary S, Misiaszek JE, Kalra S, Wheeler S, Johnston W. 2013. The effects of lung volume recruitment on coughing and pulmonary function in patients with ALS. Amyotroph Lateral Scler Frontotemporal Degener. 2013 Mar;14(2):111-5. doi: 10.3109/17482968.2012.720262. Epub 2012 Sep 12. PMID: 22970725.
- Dwarslaesie richtlijn https://richtlijnendatabase.nl/richtlijn/dwarslaesierevalidatie/voorkomen_pneumonie_bij_hoge_dwarslaesie.html
- Gruis KL, Lechtzin N. 2012. Respiratory therapies for amyotrophic lateral sclerosis: a primer. Muscle Nerve. 2012 Sep;46(3):313-31. doi: 10.1002/mus.23282. PMID: 22907221.
- Kang, SW. Bach, JR. 2000.Maximum insufflation capacity: vital capacity and cough flows in neuromuscular disease. Am J Phys Med Rehabil. May-Jun 2000;79(3):222-7. doi: 10.1097/00002060-200005000-00002.
- Lacombe M, Del Amo Castrillo L, Boré A, Chapeau D, Horvat E, Vaugier I, Lejaille M, Orlikowski D, Prigent H, Lofaso F, 2014. Comparison of three cough-augmentation techniques in neuromuscular patients: Mechanical insufflation combined with manually assisted cough, insufflation-exsufflation alon and insufflation-exsufflation combined with manually assisted cough. Respiration 88:215-222.
- Macpherson CE, Bassile CC. Pulmonary Physical Therapy Techniques to Enhance Survival in Amyotrophic Lateral Sclerosis: A Systematic Review. J Neurol Phys Ther. 2016 Jul;40(3):165-75. doi: 10.1097/NPT.0000000000000136. PMID: 27164308.
- Mahede T, Davis G, Rutkay A, Baxendale S, Sun W, Dawkins HJS, Molster C, Graham CE, 2015. Use of mechanical airway clearance devices in the home by people with neuromuscular disorders: effects on health service use and lifestyle benefits. Orphanet Journal of Rare Diseases 10:54.
- McCaughey EJ, McLean AN, Allan DB, Gollee H. Abdominal functional electrical stimulation to enhance mechanical insufflation-exsufflation. J Spinal Cord Med. 2016 Nov;39(6):720-725. doi: 10.1080/10790268.2015.1114226. Epub 2015 Dec 21. PMID: 26689243; PMCID: PMC5137572.
- McGeachan AJ, Hobson EV, Shaw PJ, McDermott CJ, 2015 Developing an outcome measure for excessive salvia management in MND and an evaluation of salvia burden in Sheffield. Amyotrophic Lateral sclerosis and frontotemporal degeneration; 16:1-2, 108-113.
- McGeachan AJ & McDermott CJ, 2017. Management of oral secretions in neurological disease. Pract Neurol; 17: 96-103.
- McGeachan AJ, Mc Dermot CJ. Management of oral secretions in neurological disease. Pract Neurol 2017;17:96-103.NICE Guideline (NG42). Motor neurone disease: assessment and management. February 2016
- Mellies U, Goebel C. 2014. Optimum insufflation capacity and peak cough flow in neuromuscular disorders. Ann Am Thorac Soc. 2014 Dec;11(10):1560-8. doi: 10.1513/AnnalsATS.201406-264OC. PMID: 25384211 Clinical Trial.
- McKim DA, Road J, Avendano M ea; Canadian Thoracic Society Home Mechanical Ventilation Committee. Home mechanical ventilation: A Canadian Thoracic Society clinical practice guideline. Can Respir J 2011;18(4):197-215.
- McKim DA, Hendin A, LeBlanc C, King J, Brown CR, Woolnough A. 2012 Tracheostomy decannulation and cough peak flows in patients with neuromuscular weakness. Am J Phys Med Rehabil. 2012 Aug;91(8):666-70. doi: 10.1097/PHM.0b013e31825597b8. PMID: 22561386
- Morrow B, Zampoli M, van Aswegen H, Argent A. Mechanical insufflation-exsufflation for people with neuromuscular disorders. Cochrane Database Syst Rev. 2013 Dec 30;(12):CD010044. doi: 10.1002/14651858.CD010044.pub2. PMID: 24374746.
- Perrin C, Unterborn JN, D’Ambrosio C, Hill NS, 2004. Pulmonary complications of chronic neuromuscular diseases and their management. Muscle and nerve29:5-27.
- Pillastrini P, Bordini S, Bazzocchi G, Belloni G, Menarini M. Study of the effectiveness of bronchial clearance in subjects with upper spinal cord injuries: examination of a rehabilitation programme involving mechanical insufflation and exsufflation. Spinal Cord. 2006 Oct;44(10):614-6. doi: 10.1038/sj.sc.3101870. Epub 2005 Dec 13. PMID: 16344851.
- Pryor JA. Physiotherapy for airway clearance in adults. Eur Respir J. 1999 Dec;14(6):1418-24. doi: 10.1183/09031936.99.14614189. PMID: 10624775.
- Rafiq MK, Bradburn M, Proctor AR, Billings CG, Bianchi S, McDermott CJ, Shaw PJ. 2015. A preliminary randomized trial of the mechanical insufflator-exsufflator versus breath-stacking technique in patients with amyotrophic lateral sclerosis. Amyotroph Lateral Scler Frontotemporal Degener. 2015;16(7-8):448-55. doi: 10.3109/21678421.2015.1051992. Epub 2015 Jul 3. PMID: 26140500.
- Reid WD, Brown JA, Konnyu KJ, Rurak JM, Sakakibara BM. Physiotherapy secretion removal techniques in people with spinal cord injury: a systematic review. J Spinal Cord Med. 2010;33(4):353-70. doi: 10.1080/10790268.2010.11689714. PMID: 21061895; PMCID: PMC2964024.
- Rose L, Adhikari NK, Leasa D, Fergusson DA, McKim D. 2017. Cough augmentation techniques for extubation or weaning critically ill patients from mechanical ventilation. Cochrane Systematic Review Cochrane 2017 Jan 11;1(1):CD011833. doi: 10.1002/14651858.CD011833.pub2. PMID: 28075489; PMCID: PMC6353102.
- Sahni AS, Wolfe L, 2018. Respiratory care in neuromuscular diseases. Respir Care 63(5):601-608.
- Senent C, Golmard JL, Salachas F, Chiner E, Morelot-Panzini C, Meninger V, Lamouroux C, Similowski T, Gonzalez-Bermejo J. 2011. A comparison of assisted cough techniques in stable patients with severe respiratory insufficiency due to amyotrophic lateral sclerosis. Amyotroph Lateral Scler. 2011 Jan;12(1):26-32. doi: 10.3109/17482968.2010.535541. Epub PMID: 21091398.
- Toussaint M, De Win H, Steens M, Soudon P. 2003 Effect of intrapulmonary percussive ventilation on mucus clearance in Duchenne muscular dystrophy patients: a preliminary report. Respir Care. 48(10):940-7. PMID: 14525630.
- Toussaint M, Boitano LT, Gathot V, Steens M, Soudon PM, 2009. Limits of Effective Cough-Augmentation Techniques in Patients with Neuromuscular Disease. Respir Care 54(3):359–366.
- Toussaint M, Pernet K, Steens M, Haan J, Sheers N. 2016. Cough Augmentation in Subjects with Duchenne Muscular Dystrophy: Comparison of Air Stacking via a Resuscitator Bag Versus Mechanical Ventilation. Respir Care. 2016 Jan;61(1):61-7. doi: 10.4187/respcare.04033. Epub 2015 Oct 6. PMID: 26443018.
- Toussaint M, Chatwin M, Gonzales J, Berlowitz DJ, ENMC Respiratory Therapy Consortium ea 2018. 228th ENMC International Workshop:: Airway Clearance Techniques in Neuromuscular Disorders Naarden, The Netherlands, 3-5 March, 2017. Neuromusculular Disorders 28; 289-298.
- Trebbia G, Lacombea M, Fermanian C, Falaize L, Lejaille M, Louis A, Devaux C, Raphael, JC, Lofaso F, 2005. Cough determinants in patients with neuromuscular disease. Respiratory Physiology & Neurobiology 146 291–300.
- Tzeng, AC. Bach, JR. 2000. Prevention of Pulmonary Morbidity for Patients With Neuromuscular Disease. Chest 11:1390-1396.
- Yuan N, Kane P, Shelton K, Matel J, Becker BC, Moss RB. Safety, tolerability, and efficacy of high-frequency chest wall oscillation in pediatric patients with cerebral palsy and neuromuscular diseases: an exploratory randomized controlled trial. J Child Neurol. 2010 Jul;25(7):815-21. doi: 10.1177/0883073809350223. Epub 2010 Mar 31. PMID: 20357238.
Evidence tabellen
Exclusietabellen
Zoeken en selecteren
Voor het beantwoorden van deze uitgangsvraag is oriënterend literatuuronderzoek gedaan naar de volgende vraag:
Welke hoesttechniek is het meest geschikt voor patiënten met een neuromusculaire aandoening of dwarslaesie ter voorkoming van respiratoire complicaties?
Pico
Patiënten: neuromuscular disease, neuromuscular disorders, spinal cord injury,
Interventie: ACT OR airway clearance techniques OR lungvolume recruitment OR cough augmentation OR sputum mobilizing, OR sputum mobilization OR MI:E OR Mechanical insufflation-Exsufflation OR cough assist device.
Comparison: no ACT
Outcome: primair: respiratoire complicaties, ziekenhuisopname, Qol, respiratoire insufficiëntie. Secundair: respiratoire infecties, beademing.
In de database Pubmed is op 17-9-2019 gezocht naar relevante literatuur. De volgende zoektermen zijn gebruikt: Airway clearance techniques and neuromuscular disorders or neuromuscular diseases. Dit resulteerde in 72 hits. Daarvan zijn 6 RCT’s en 2 systematische reviews (zie tabel). De zoektermen Lung volume recruitement (LVR) and Neuromuscular disease or neuromusular disorder (NMD) leverden 43 hits op en LVR, NMD and spinal cord injury 53 hits.
Totaal leverde dit 168 titels op. Hieruit zijn de dubbele verwijderd en de RCT’s, clinical trails, systematische reviews en reviews zijn geselecteerd. De overgebleven 55 artikelen zijn beoordeeld op titel en relevantie (zie tabel). Exclusiecriteria zijn:
- Taal: alle artikelen die niet in het Engels of Nederlands zijn geschreven.
- Artikelen over acute zorg
- Artikelen over kinderen.
- Niet full-tekst beschikbaar
- Niet relevant voor onze uitgangsvraag, niet de juiste populatie
Na toepassing van de exclusiecriteria zijn er negen RCT’s en twee systematische reviews gevonden. Omdat er zo weinig evidence is zijn ook overige onderzoeken en reviews meegenomen in de bespreking. Veel behandelen verschillende sputumevacuatie- en hoestondersteunende technieken. Alle studies bevatten kleine groepen en zijn door het verschil in populatie, therapieën en uitkomstmaten niet onderling te vergelijken.
Overzicht studies
|
|
Type onderzoek / aantal patienten |
Interventie |
Geselecteerd ja/nee |
Reden exclusie |
|
Toussaint, 2016 |
RCT- 52 DMD patiënten met NIV |
AS |
Ja |
|
|
Yuan, 2010 |
RCT- kinderen met NMA cerebrale parese |
HFCWO |
Ja |
|
|
Chatwin, 2009 |
RCT- 8 patiënten met een LWI |
MI-E |
Ja |
|
|
Pillastrini, 2005 |
RCT- onbekend aantal patiënten met dwarsleasie |
Effectiviteit sputum klaring MI-E |
Ja |
|
|
Toussaint, 2003 |
RCT- 8 DMD patiënten |
IPV |
Ja |
|
|
Chaisson, 2006 |
RCT- 9 ALS patiënten en NIV |
HFCWO |
Ja |
|
|
Cleary, 2013 |
RCT-cross over design ALS patiënten |
Effect LVR op longfunctie |
Ja |
|
|
De Monte, 2013 |
RCT- honden |
Effecten alveolaire recruitment |
Nee |
Honden, effecten anesthesie, neuromusculaire blokkade |
|
Rafiq, 2015 |
RCT - 40 ALS patiënten |
MI-E versus AS |
Ja |
|
|
Nijs, 2008 |
RCT- patiënten met chronisch vermoeidheidssyndroom |
Breathing retraining |
Nee |
Andere populatie en interventie. Gaat niet over sputumevacuatie |
|
Brito, 2009 |
RCT |
Airstacken en MAC |
Ja |
|
|
Siriwat, 2018 |
RCT- 22 kinderen spastische cerebal palsy |
MI-E |
Nee |
Kinderen |
|
Gonçalves, 2012 |
RCT- 75 geïntubeerde patiënten |
MI-E |
Nee |
Acute patiënten |
|
Wadhwa, 2011 |
Clinical trial- Trauma patiënten |
Tomography |
Nee |
Niet over sputum-evacuatie techniek |
|
Senent, 2011 |
Clinical trial- 16 ALS patiënten |
Hoesttechnieken |
Ja |
|
|
McCaughey, 2016 |
Case study- clinical trial |
MI-E in combinatie met AFES |
Ja |
|
|
Lacombe, 2014 |
Crossover design |
IPPB+MAC, MI-E en MI-E + MAC |
Ja |
|
|
Nunes, 2019 |
Randomised crossover study- 16 critically ill patients |
MI-E plus endotracheaal uitzuigen |
Nee |
IC-patiënten |
|
Rose, 2018 |
Cross-sectional survey- NMA en dwarsleasie patiënten |
Vragenlijsten over inzet hoesttechnieken |
Nee |
Ic-patienten |
|
Leadingham, 2007 |
Case report |
Behandeling in postoperatieve unit |
Nee |
Pseudocholinesterase deficiency |
|
Morrow, 2013 |
Cochrane review- NMA |
MI-E |
Ja |
|
|
Ferreira de Camillis, 2018 |
Cochrane review |
MI-E |
Nee |
ICU patiënten |
|
Kazachkov, 2018 |
Systematische review |
|
Nee |
Andere patiëntengroep: familiaire dysautonomie |
|
Reid, 2010 |
Systematische review- dwarsleasie patiënten |
Sputum evacuatie technieken |
Ja |
|
|
Macpherson, 2016 |
Systematic review- ALS |
Inspiratory muscle training en diaphragmatic breathing (DB) training, AS en MAC |
Nee |
Bevat twee studies over AS en MAC van Senent (2011, case study) en Cleary (2013, RCT). Daar meegenomen, zie boven. |
|
Panitch, 2017 |
Review |
|
Nee |
Kinderen. Niet over hoesttechnieken |
|
Camelia, 2018 |
Review |
Kinderen met DMD |
Nee |
Kinderen |
|
Kazachokov, 2018 |
Review |
Aanpak respiratoire problemen bij NMA- patiënten |
Nee |
Turks |
|
Chatwin, 2018 |
Review |
ACT |
Ja |
|
|
Auger, 2015 |
Review |
MI-E |
Ja |
|
|
Buu, 2017 |
Review |
Respiratoire complicaties |
Nee |
Kinderen |
|
Howard, 2018 |
Review |
Respiratoir falen NMA-patiënten |
Nee |
Vooral over acute opvang NMA-patiënten |
|
Boitano, 2006 |
Review- NMD patiënten |
ACT |
Ja |
|
|
De Boeck, 2008 |
Review- gezonde kinderen met acute respiratoire aandoening |
ACT |
Nee |
Kinderen. Acute zorg |
|
Shi, 2019 |
Review- acuut zieke patiënten |
Expiratoire spierkracht |
Nee |
Andere populatie, acute zorg geen sputumevacuatie |
|
Panitch, 2006 |
Review- kinderen neuromusculaire spierzwakte |
ACT |
Nee |
Kinderen |
|
Hardy, 1996 |
Review |
ACT |
Nee |
Geen full tekst en oud artikel |
|
Racca, 2013 |
Review- NMA patiënten |
Operatieve zorg |
Nee |
Operatieve zorg |
|
Blatter, 2013 |
Review- kinderen met NMA |
Operatieve zorg |
Nee |
Operatieve zorg |
|
Panitch, 2006 |
Review- kinderen met NMA |
Respiratoire issues |
Nee |
Kinderen |
|
Auger 2016 |
Review |
|
Nee |
Frans |
|
Hess, 2012 |
Review- beademde patiënten |
NIV |
Nee |
Over NIV |
|
Perrin, 2006
|
Review- ALS |
ACT |
Nee |
Frans |
|
Geiseler, 2008 |
Review- NMA patiënten |
Management sputum |
Nee |
Duits |
|
Kravitz, 2009 |
Review- DMD |
Respiratoire complicaties |
Nee |
Kinderen |
|
Schramm, 2000 |
Review- centronuclaire myopathies |
Respiratoire complicaties |
Nee |
Kinderen |
|
Smith, 2014 |
Review- centronuclaire myopathies |
Resp. Assessment |
Nee |
Behandeling CM-niet specifiek hoesttechnieken |
|
Kartaloğlu, 2012 |
Review- NMA |
Resp. problemen |
Nee |
Turks |
|
Roper, 2010 |
Review- SMA |
Standard care |
Nee |
Implementatie standard of care bij SMA |
|
Pryor,1999 |
Review |
Fysiotherapie |
Ja |
|
|
Kuru, 2011
|
Review- muscular dystrophie |
Respiratoire management |
Nee |
Japans |
|
Gruis, 2012 |
Review- ALS |
Respiratoire therapie |
Ja |
|
|
Clais, 2006
|
Review- ALS |
invasieve beademing of intuberen |
Nee |
Frans |
|
Shank, 2019
|
Review- dwarsleasie |
Protocol opvang |
Nee |
Acute zorg |
|
Bach, 1991 |
Review- dwarsleasie patiënten |
Beademing |
Nee |
Geen full tekst |
Verklaring afkortingen: RCT: randomized control trial, NIV: niet-invasieve beademing (ventilation), DMD: Duchenne Muscular dystrofie. NMA: neuromusculaire aandoening, HFCWO: High frequency chest wall oscillation. LWI: luchtweginfectie, MIE: mechanische in-/exsufflatie (hoestmachine), IPV intrapulmonale percussie ventilatie, ALS: Amyotrofische laterale sclerose, AS: Airstacken, LVR: long volume recruitment, AFES: Abdominal functional electrical stimulation, ACT: airway clearance techniek, SMA spinale musculaire atrofie.
Lijst geëxcludeerde artikelen
Auger C, Schapiro E, Galmiche H, Denis C. 2016. Avis sur le remboursement de techniques instrumentales d’aide à la toux et à la mobilisation thoracique. Une évaluation de la Haute Autorité de santé (HAS) [Review of reimbursement for instrumental techniques used for assisted coughing and thoracic expansion. A French National Health Authority assessment (HAS)]. Rev Mal Respir. 2016
Dec;33(10):853-864. French. doi: 10.1016/j.rmr.2016.01.006. Epub 2016 Jun 3. PMID: 27266899.
Bach JR. 1991. Alternative methods of ventilatory support for the patient with ventilatory failure due to spinal cord injury. J Am Paraplegia Soc. 1991 Oct;14(4):158-74. doi: 10.1080/01952307.1991.11735849. PMID: 1960533.
Blatter JA, Finder JD. 2013. Perioperative respiratory management of pediatric patients with neuromuscular disease. Paediatr Anaesth. 2013 Sep;23(9):770-6. doi: 10.1111/pan.12214. Epub 2013 Jun 14. PMID: 23763308.
De Boeck K, Vermeulen F, Vreys M, Moens M, Proesmans M. 2008. Airway clearance techniques to treat acute respiratory disorders in previously healthy children: where is the evidence? Eur J Pediatr. 2008 Jun;167(6):607-12. doi: 10.1007/s00431-008-0689-y. Epub 2008 Mar 6. PMID: 18322699.
Buu MC. 2017. Respiratory complications, management and treatments for neuromuscular disease in children. Curr Opin Pediatr. 2017 Jun;29(3):326-333. doi: 10.1097/MOP.0000000000000498. PMID: 28338488.
Camela F, Gallucci M, Ricci G. 2019. Cough and airway clearance in Duchenne muscular dystrophy. Paediatr Respir Rev. 2019 Aug;31:35-39. doi: 10.1016/j.prrv.2018.11.001. Epub 2018 Nov 24. PMID: 30553655.
Ciais JF. 2006. Quelle est la problématique liée à la trachéotomie et l'intubation en urgence? [Questions concerning an endotracheal intubation or a tracheotomy in amyotrophic lateral sclerosis]. Rev Neurol (Paris). 2006 Jun;162 Spec No 2:4S323-4S328. French. PMID: 17128133.
Ferreira de Camillis ML, Savi A, Goulart Rosa R, Figueiredo M, Wickert R, Borges LGA, Galant L, Teixeira C. 2018. Effects of Mechanical Insufflation-Exsufflation on Airway Mucus Clearance Among Mechanically Ventilated ICU Subjects. Respir Care. 2018 Dec;63(12):1471-1477. doi: 10.4187/respcare.06253. Epub 2018 Jul 17. PMID: 30018175.
Geiseler J, Karg O. 2008. Sekretmanagement bei neuromuskulären Erkrankungen [Management of secretion in patients with neuromuscular diseases]. Pneumologie. 2008 Mar;62 Suppl 1:S43-8. German. doi: 10.1055/s-2008-1038098. PMID: 18317984.
Gonçalves MR, Honrado T, Winck JC, Paiva JA. 2012. Effects of mechanical insufflation-exsufflation in preventing respiratory failure after extubation: a randomized controlled trial. Crit Care. 2012 Dec 12;16(2):R48. doi: 10.1186/cc11249. PMID: 22420538; PMCID: PMC3681374.
Hardy KA, Anderson BD. 1996. Noninvasive clearance of airway secretions. Respir Care Clin N Am. 1996 Jun;2(2):323-45. PMID: 9390886.
Hess DR. 2012. The growing role of noninvasive ventilation in patients requiring prolonged mechanical ventilation. Respir Care. 2012 Jun;57(6):900-18; discussion 918-20. doi: 10.4187/respcare.01692. PMID: 22663966.
Howard RS. 2016. Respiratory failure because of neuromuscular disease. Curr Opin Neurol. 2016 Oct;29(5):592-601. doi: 10.1097/WCO.0000000000000363. PMID: 27427990.
Kartaloğlu Z, Okutan O. 2012. Nöromusküler hastalıklardaki solunumsal problemlere güncel yaklaşım [Current approach to respiratory problems in neuromuscular diseases]. Tuberk Toraks. 60(3):279-90. Turkish. doi: 10.5578/tt.3409. PMID: 23030757.
Kazachkov M, Palma JA, Norcliffe-Kaufmann L, Bar-Aluma BE, Spalink CL, Barnes EP, Amoroso NE, Balou SM, Bess S, Chopra A, Condos R, Efrati O, Fitzgerald K, Fridman D, Goldenberg RM, Goldhaber A, Kaufman DA, Kothare SV, Levine J, Levy J, Lubinsky AS, Maayan C, Moy LC, Rivera PJ, Rodriguez AJ, Sokol G, Sloane MF, Tan T, Kaufmann H. 2018. Respiratory care in familial dysautonomia: Systematic review and expert consensus recommendations. Respir Med. 2018 Aug;141:37-46. doi: 10.1016/j.rmed.2018.06.017. Epub 2018 Jun 21. PMID: 30053970; PMCID: PMC6084453.
Kravitz RM. 2009. Airway clearance in Duchenne muscular dystrophy. Pediatrics. 2009 May;123 Suppl 4:S231-5. doi: 10.1542/peds.2008-2952G. PMID: 19420150.
Kuru S. 2011. [Respiratory management in muscular dystrophies]. Brain Nerve. 2011 Nov;63(11):1229-36. Japanese. PMID: 22068475.
Leadingham CL. 2007. A case of pseudocholinesterase deficiency in the PACU. J Perianesth Nurs. 2007 Aug;22(4):265-71; quiz 272-4. doi: 10.1016/j.jopan.2007.05.005. PMID: 17666297.
Macpherson CE, Bassile CC. 2016. Pulmonary Physical Therapy Techniques to Enhance Survival in Amyotrophic Lateral Sclerosis: A Systematic Review. J Neurol Phys Ther. 2016 Jul;40(3):165-75. doi: 10.1097/NPT.0000000000000136. PMID: 27164308.
De Monte V, Grasso S, De Marzo C, Crovace A, Staffieri F. 2013. Effects of reduction of inspired oxygen fraction or application of positive end-expiratory pressure after an alveolar recruitment maneuver on respiratory mechanics, gas exchange, and lung aeration in dogs during anesthesia and neuromuscular
blockade. Am J Vet Res. 2013 Jan;74(1):25-33. doi: 10.2460/ajvr.74.1.25. PMID: 23270342.
Nunes LC, Rizzetti DA, Neves D, Vieira FN, Kutchak FM, Wiggers GA, Peçanha FM. Mechanical insufflation/exsufflation improves respiratory mechanics in critical care: Randomized crossover trial. Respir Physiol Neurobiol. 2019 Aug;266:115-120. doi: 10.1016/j.resp.2019.05.008. Epub 2019 May 13. PMID: 31096012.
Nijs J, Adriaens J, Schuermans D, Buyl R, Vincken W. 2008. Breathing retraining in patients with chronic fatigue syndrome: a pilot study. Physiother Theory Pract. 2008 Mar-Apr;24(2):83-94. doi: 10.1080/09593980701429406. PMID: 18432511.
Panitch HB. 2006. Airway clearance in children with neuromuscular weakness. Curr Opin Pediatr. 2006 Jun;18(3):277-81. doi: 10.1097/01.mop.0000193297.40388.19. PMID: 16721148.
Panitch HB. Respiratory issues in the management of children with neuromuscular disease. Respir Care. 2006 Aug;51(8):885-93; discussion 894-5. PMID: 16867199.
Panitch HB. Respiratory Implications of Pediatric Neuromuscular Disease. Respir Care. 2017 Jun;62(6):826-848. doi: 10.4187/respcare.05250. PMID: 28546380.
Perrin C. 2006. Les techniques de désencombrement bronchique au cours de la Sclérose Latérale Amyotrophique [Techniques favoring airway clearance in patients with amyotrophic lateral sclerosis]. Rev Neurol (Paris). 2006 Jun;162 Spec No 2:4S256-4S260. French. PMID: 17128120.
Racca F, Mongini T, Wolfler A, Vianello A, Cutrera R, Del Sorbo L, Capello EC, Gregoretti C, Massa R, De Luca D, Conti G, Tegazzin V, Toscano A, Ranieri VM. 2013. Recommendations for anesthesia and perioperative management of patients with neuromuscular disorders. Minerva Anestesiol. 2013 Apr;79(4):419-33. Epub 2013 Feb 18. PMID: 23419334.
Roper H, Quinlivan R; Workshop Participants. 2010. Implementation of "the consensus statement for the standard of care in spinal muscular atrophy" when applied to infants with severe type 1 SMA in the UK. Arch Dis Child. 2010 Oct;95(10):845-9. doi: 10.1136/adc.2009.166512. Epub 2009 Oct 8. PMID: 19819869.
Schramm CM. 2000. Current concepts of respiratory complications of neuromuscular disease in children. Curr Opin Pediatr. 2000 Jun;12(3):203-7. doi: 10.1097/00008480-200006000-00004. PMID: 10836153.
Shank CD, Walters BC, Hadley MN. Current Topics in the Management of Acute Traumatic Spinal Cord Injury. Neurocrit Care. 2019 Apr;30(2):261-271. doi: 10.1007/s12028-018-0537-5. PMID: 29651626.
Shi ZH, Jonkman A, de Vries H, Jansen D, Ottenheijm C, Girbes A, Spoelstra- de Man A, Zhou JX, Brochard L, Heunks L. 2019. Expiratory muscle dysfunction in critically ill patients: towards improved understanding. Intensive Care Med. 2019 Aug;45(8):1061-1071. doi: 10.1007/s00134-019-05664-4. Epub 2019 Jun 24. PMID: 31236639; PMCID: PMC6667683.
Siriwat R, Deerojanawong J, Sritippayawan S, Hantragool S, Cheanprapai P.2018. Mechanical Insufflation-Exsufflation Versus Conventional Chest Physiotherapy in Children With Cerebral Palsy. Respir Care. 2018 Feb;63(2):187-193. doi: 10.4187/respcare.05663. Epub 2017 Oct 24. PMID: 29066586.
Smith BK, Goddard M, Childers MK. 2014. Respiratory assessment in centronuclear myopathies. Muscle Nerve. 2014 Sep;50(3):315-26. doi: 10.1002/mus.24249. Epub 2014 Aug 5. PMID: 24668768; PMCID: PMC4140950.
Wadhwa R, Shamieh S, Haydel J, Caldito G, Williams M, Nanda A. 2011. The role of flexion and extension computed tomography with reconstruction in clearing the cervical spine in trauma patients: a pilot study. J Neurosurg Spine. 2011 Mar;14(3):341-7. doi: 10.3171/2010.11.SPINE09870. Epub 2011 Jan 21. PMID: 21250811.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 08-07-2021
Laatst geautoriseerd : 08-07-2021
Geplande herbeoordeling : 01-01-2027
Algemene gegevens
De Nederlandse Vereniging voor Neurologie (NVN) heeft de modules 'Verwijzen en indicatie stellen' en 'Instellen op chronische beademing' geautoriseerd
De ontwikkeling van deze richtlijn is verricht door de inzet van het VSCA-bestuur samen met veel betrokken artsen, verpleegkundigen en patiënten. Zij werden ondersteund door het bureau van de VSCA en de Onderzoekerij. De richtlijn is gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en door de VSCA.
Met ondersteuning van:
- De Onderzoekerij
- Bureau Vereniging Samenwerkingsverband Chronische Ademhalingsondersteuning
Financiering
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en de Vereniging Samenwerkingsverband Chronische Ademhalingsondersteuning.
SKMS heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Doel en doelgroep
Doel
In de afgelopen jaren is er veel veranderd in de zorg in zijn algemeenheid en de zorg voor chronisch beademde patiënten in het bijzonder. Er zijn indicatiegebieden bij gekomen (COPD, complex slaapapnoe) en voor de verschillende bestaande indicatiegebieden is er meer wetenschappelijke onderbouwing gekomen. Daarom was er behoefte aan de doorontwikkeling van de huidige veldnorm.
In de jaren na publicatie van de veldnorm zijn er allerlei nieuwe eisen gesteld aan de ontwikkeling van richtlijnen in de zorg, waaronder een grotere betrokkenheid van het patiëntenperspectief. De term veldnorm wordt ook niet meer gebruikt.
Deze nieuwe richtlijn chronische beademing heeft tot doel de zorg rond de chronisch beademde patiënt verder te optimaliseren zodat er een effectieve en veilige behandeling gewaarborgd kan blijven. Dit kan worden bereikt door tijdige en accurate doorverwijzing en diagnostiek, tijdig en adequaat onderzoek en instelling op chronische beademing, een op de individuele patiënt afgestemde begeleiding en een optimaal georganiseerd zorgnetwerk.
Om de zorg uitvoerbaar te houden zijn er ook klassieke indicaties die de CTB’s op termijn moeten afschalen. Dat betekent dat die mensen niet uitsluitend en elke keer door een CTB gezien hoeven te worden, of wellicht geheel niet. Deels zal de wetenschappelijke onderbouwing hiervoor nog geleverd moeten worden door de CTB’s. Belangrijke extra voorwaarde voor minderen is wel dat hier een goed landelijk dekkend systeem samen met perifere centra zal moeten worden gerealiseerd.
Deze indicaties voor afschalen of niet doen zijn:
- Slaapapneu, zowel centraal als obstructief
- Obesitas hypoventilatie syndroom (onderdeel van de thoraxwandoeningen).
De CTB’s zijn in gesprek met de werkgroep SAS (Sectie Ademhalingsstoornissen tijdens de slaap) van de NVALT om hier voor de toekomst bestendige afspraken over te maken.
De aanbevelingen zijn gebaseerd op een zorgvuldige weging van de laatste wetenschappelijke inzichten, expert opinion en patiëntenvoorkeuren. De richtlijn ondersteunt zorgprofessionals in hun klinische besluitvorming en biedt transparantie naar patiënten en derden. De richtlijn heeft niet tot doel het hele zorgproces omvattend te beschrijven.
Deze richtlijn is ontwikkeld in samenwerking met de vele betrokken partijen. Dit gezamenlijk ontwikkelen van een norm voor het veld zal hopelijk weer leiden tot nieuwe samenwerkingen en impulsen tot nog meer gericht wetenschappelijk onderzoek. De implementatie van gezamenlijk gemaakte afspraken versterkt naar verwachting de zorgketen ten behoeve van de chronisch beademde patiënt.
Doelgroep
Deze richtlijn is bedoeld voor alle zorgverleners en zorgorganisaties die permanent of tijdelijk bij de behandeling en begeleiding van patiënten van 18 jaar en ouder met chronische beademing zijn betrokken. Ook voor patiënten met chronische beademing biedt deze richtlijn relevante informatie.
Deze richtlijn vervangt de Veldnorm Chronische Beademing 1.0 (2012).
Na publicatie van deze richtlijn zal er ook een patiëntvriendelijke cliëntenversie ontwikkeld worden.
Het ligt in de bedoeling om aparte onderdelen van deze richtlijn specifiek voor kinderen te ontwikkelen.
Wanneer wordt gesproken over ‘de patiënt’ wordt bedoeld de patiënt of cliënt. Waar ‘hij’ staat kunt u ook hij/zij lezen.
Hier kunt u meer informatie vinden:
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een stuurgroep samengesteld onder leiding van een onafhankelijk voorzitter. Vanuit deze stuurgroep zijn vijf multidisciplinaire werkgroepen samengesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met chronische beademing. De leden van de wetenschappelijke verenigingen en van andere organisaties zijn gemandateerd door hun beroepsverenigingen en organisaties. De stuurgroep is verantwoordelijk voor de integrale tekst van de richtlijn.
Stuurgroep
- Dhr. dr. M.A. (Michael) Gaytant, internist, Universitair Medisch Centrum Utrecht, Centrum voor Thuisbeademing, Utrecht (voorzitter), bestuurslid VSCA
- Dhr. prof. dr. P.J. (Peter) Wijkstra, longarts, hoogleraar longziekten en tuberculose in het bijzonder chronische ademhalingsondersteuning, medisch hoofd Centrum voor Thuisbeademing UMC Groningen (mede-voorzitter), bestuurslid VSCA, gemandateerd vanuit de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose Nederland
- Mw. drs. J.H. (Rineke) Jaspers Focks, revalidatiearts NMA/ ALS, Roessingh centrum voor Revalidatie, Enschede, bestuurslid VSCA (vanaf september 2020)
- Mw. K.S. (Carla) Smedema MMI, manager zorg Santé Partners, bestuurslid VSCA
- Dhr. drs. M.F.TH. (Marcel) Timmen, directeur Spierziekten Nederland, bestuurslid VSCA
- Mw. drs. L.P. (Laura) Verweij, verpleegkundig Specialist chronische beademing bij kinderen WKZ kinder-IC UMC Utrecht, bestuurslid VSCA
- Mw. Em. prof. dr. M. (Marianne) de Visser, neuroloog, Amsterdam UMC, locatie AMC, voorzitter VSCA
- Dhr. P.W. (Peter) van der Vlist, bestuurslid VSCA
- Dhr. ir. R. (Rens) Wientjes, klinisch fysicus, UMC Utrecht
Projectleider
- Mw. I.C. (Inge) Ruys, MBA, beleidsadviseur VSCA
Werkgroepen
- Mw. J. (Jolanda) Bakkers, coördinerend verpleegkundige Verpleeghuis Kalorama, Nijmegen
- Mw. A. (Atty) van Beest, teammanager Zorg en Welzijn, de Viermaster, NAH de Spreng, Hospice, Zorggroep Apeldoorn
- Mw. M. H. (Marleen) den Besten, patiënt en patiëntvertegenwoordiger
- Dhr. drs. W. W. (Weibel) Braunius, KNO-arts Hoofd-Hals Chirurg-Oncoloog, UMC Cancer Center Utrecht, gemandateerd namens Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied
- Mw. drs. N. (Naomi) van den Broek, AVG en somnoloog, Kempenhaeghe, gemandateerd namens de Nederlandse Vereniging van Artsen voor Verstandelijk Beperkten
- Dhr. M. (Marc) van Bueren, patiënt en patiëntvertegenwoordiger
- Dhr. D. (Dick) Cochius, patiënt en patiëntvertegenwoordiger
- Dhr. K. (Kees) Cové, Business development manager Ventilation & Respiration Vivisol Ned BV
- Mw. drs. I. (Ina) Diermanse, directeur ADL-assistentie Noord- en OostNederland, Fokus Wonen
- Mw. M. (Monique) Drenthen, senior begeleidster, Interaktcontour, WL De Stuwwal
- Dhr. mr. drs. P.E.J. (Peter) Driessen, patiënt en patiëntvertegenwoordiger
- Dhr. A. (Arno) Elbrecht, Adviseur Mobiliteit RTD Arnhem, onderdeel van Kersten hulpmiddelen
- Dhr. J. (Jan) Elemans, patiënt en patiëntvertegenwoordiger
- Mw. B. (Betsie) Elemans-Schiks, mantelzorgvertegenwoordiger
- Mw. dr. T. (Tessa) Frankena, Productspecialist LG & coördinator medische dienst Siza Arnhem
- Mw. A. (Annette) Groenenberg, verpleegkundig casemanager Emma Thuis team, UMC Amsterdam
- Mw. dr. I.J.M. (Imelda) de Groot, associate professor, (kinder)revalidatiearts, senior onderzoeker revalidatiegeneeskunde, Radboudumc, Nijmegen, (per 1 mei 2021 met pensioen) gemandateerd namens de Nederlandse Vereniging van Revalidatieartsen
- Mw. R. (Rianne) ter Haar-Schoonhoven, verpleegkundige in de wijk Buurtzorg Nederland
- Mw. J.H.(Annelien) Hartman, patiënt en patiëntvertegenwoordiger
- Mw. M. (Martha) van Hattem-Hummel, transferverpleegkundige UMC Utrecht, gemandateerd namens V&VN Transferverpleegkundigen
- Mw. dr. A. (Anda) Hazenberg, verpleegkundig specialist CTB UMC Groningen
- Mw. drs. S.A.H.(Saskia) Manders-Heffener, patiënt en patiëntvertegenwoordiger en Junior onderzoeker, Radboudumc, Department of Pediatrics
- Dhr. drs. M.A.W.(Mark) van Iperen, intensivist Ziekenhuis Gelderse Vallei, gemandateerd namens de Nederlandse Vereniging voor Intensive Care
- Mw. drs. L. (Laura) Joosen, specialist ouderengeneeskunde, Rivas Zorggroep, Gorinchem, gemandateerd namens de Vereniging Specialisten Ouderengeneeskunde
- Dhr. drs. J.L. (Hans) Kemming, longarts UMC Utrecht, staflid Centrum voor Thuisbeademing
- Mw. A. (Anja) Kievit-Pieffers, senior begeleider/verpleegkundige Stichting Interakt Contour, Woonvorm De Stuwwal Zwolle
- Dhr. B. (Berend) Kleiker, mantelzorgvertegenwoordiger
- Mw. H. (Hinke) Kleiker-Wolters, patiënt en patiëntvertegenwoordiger
- Mw. W.H. (Wendy) Klinkhamer, instrumentatietechnicus CTB UMC Utrecht
- Mw. drs. D.B.M. (Danielle) Kock-Cordeiro, longarts thuisbeademing Erasmus MC Rotterdam
- Mw. dr. A.J. (Anneke) van der Kooi, neuroloog Amsterdam UMC, gemandateerd namens de Nederlandse Vereniging voor Neurologie
- Mw. dr. E (Elly) van der Kooi, neuroloog Medisch Centrum Leeuwarden, gemandateerd namens de Nederlandse Vereniging voor Neurologie
- Mw. A. (Anita) Krans, verpleegkundig specialist AGZ, Leliezorggroep en Izer, gemandateerd namens V&VN Verpleegkundig Specialisten – netwerk VS VPH (verpleeghuis)
- Dhr. A. (André) Kroos, senior verpleegkundig consulent Erasmus MC Rotterdam
- Mw. drs. E. (Esther) Kruitwagen-van Reenen, revalidatiearts, UMC Utrecht, gemandateerd namens de Nederlandse Vereniging van Revalidatieartsen
- Dhr. P. (Piet) van Lingen MSc, verpleegkundig specialist CTB UMC Utrecht
- Mw. B. (Betty) Oost, verpleegkundig consulent/kwaliteitsmedewerker CTB, UMC Groningen
- Dhr. J. (Jos) Schulpen, instrumentatietechnicus/Technisch adviseur, CTB Maastricht
- Mw. I.R. (Irma) Sinnema, verpleegkundig specialist CTB UMC Groningen
- Dhr. D. (Dick) van der Sluijs, complexe mobiliteit, Kersten Hulpmiddelen
- Mw. L (Leonie) Terpstra-Durinck, Verpleegkundig adviseur/lid expertiseteam Fokus Wonen
- Mw. drs. N.E.J. (Nicole) Tromp, patiënt en patiëntvertegenwoordiger
- Dhr. J. (Joost) ter Velde, teamleider Siza, projectleider Academy het Dorp
- Mw. M.A.T.M. (Monique) Vial, verpleegkundig consulent CTB UMC Utrecht
- Mw. J. (Jolanda) de Visser-de Jong, IC verpleegkundige/consulent CTB volwassenen, Erasmus MC Rotterdam
- Dhr. J. (Jasper) Volbeda, verkoopadviseur speciale rolstoelaanpassingen Focal Meditech BV
Met medewerking van
- Mw. Em. prof. dr. I.D. (Inez) de Beaufort, Erasmus MC- hoogleraar medische ethiek
- Mw. I. (Ina) van de Streek, verpleegkundig consulent Chronische beademing, CTB, UMC Utrecht
Met ondersteuning van
- Dhr. dr. P (Pieter) Broos, beleidsmedewerker kwaliteit NVALT (tot april 2019)
- Mw. T. (Tessa) Dingelhoff, secretaresse VSCA
- Dhr. dr. J. (Joppe) Tra, beleidsmedewerker kwaliteit NVALT, (vanaf april 2019)
- Mw. dr. A. (Annemarie) Venemans-Jellema, methodoloog, de Onderzoekerij
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de VSCA.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bakkers |
Coördinerend verpleegkundige Verpleeghuis Kalorama |
n.v.t. |
Geen |
Geen |
|
Beaufort, de |
Erasmus MC- hoogleraar medische ethiek |
Raad van Toezicht-HMC ziekenhuis, Ned Ver van Cardiologie. Gezondheidsraad-erelid ZonMV-commissies, mede-initiatiefnemer Ethiek in Richtlijnen |
Geen |
Geen |
|
Beest, van |
Teammanager bij De Viermaster - NAH en De Spreng - Hospice Zorggroep Apeldoorn |
n.v.t. |
Geen |
Geen |
|
Besten, den |
Patiënt en patiëntvertegenwoordiger |
n.v.t. |
Geen |
Geen |
|
Braunius |
KNO-arts Hoofd-Hals Chirurg-Oncoloog |
n.v.t. |
Geen |
Geen |
|
Broek, van den |
AVG (arts verstandelijk gehandicapten) en somnoloog bij Kempenhaeghe (Centrum voor Epilepsiewoonzorg en Centrum voor Slaapgeneeskunde). |
Betaald:
Onbetaald:
|
Geen |
Geen |
|
Bueren, van |
Patiënt en patiëntvertegenwoordiger Expert opinion - FSHD type ll |
n.v.t. |
Geen |
Geen |
|
Cové |
Business Development Manager Ventilation & Respiratory Care Vivisol |
n.v.t. |
Geen |
Besproken- geen deelname aan beslissingen met commerciële invloed
|
|
Cochius |
Patiënt en patiëntvertegenwoordiger |
Voorzitter Arnhems platform Chronisch Zieken en gehandicapten div. functies E-hockey AMHC Upward Secr st. Orange & Wheels Bondscoach Team NL Powerchairhockey |
Geen |
Geen |
|
Diermanse |
Directeur ADL-assistentie Noord- en Oost Nederland, Fokus wonen |
n.v.t. |
Geen |
Geen |
|
Drenthen |
Senior begeleidster, Interaktcontour, WL De Stuwwal |
Betaald:
|
Geen |
Geen |
|
Driessen |
Patiënt en patiëntvertegenwoordiger |
Onbetaald:
|
Geen |
Geen |
|
Elbrecht |
Adviseur Mobiliteit RTD Arnhem, onderdeel Kersten hulpmiddelen |
|
Geen |
Besproken- geen deelname bij beslissingen met commerciële invloed |
|
Elemans |
Patiënt en patiëntvertegenwoordiger |
Vacatiegeld
|
Geen |
Geen |
|
Elemans-Schiks |
Mantelzorgvertegenwoordiger |
Onbetaald:
|
Geen |
Geen |
|
Frankena |
Productspecialist LG & coördinator medische dienst Siza Arnhem |
Onbetaald:
|
Geen |
Geen |
|
Gaytant |
lnternist UMCU, staflid Centrum voor Thuisbeademing Utrecht |
|
Geen |
Geen |
|
Groenenberg |
Verpleegkundig casemanager Emma Thuis team, UMC Amsterdam |
n.v.t. |
Geen |
Geen |
|
Groot, de |
Associate professor, (kinder)revalidatiearts, senior onderzoeker revalidatiegeneeskunde, Radboudumc, Nijmegen (gepensioneerd per 1 mei 2021) |
|
Geen |
Geen |
|
Haar-Schoonhoven, ter |
verpleegkundige in de wijk Buurtzorg Nederland |
Betaald:
|
Geen |
Geen |
|
Hartman |
Patiënt en patiëntvertegenwoordiger |
Onbetaald:
Beademing |
Geen |
Geen |
|
Hattem-Hummel, van |
transferverpleegkundige UMC Utrecht |
n.v.t. |
Geen |
Geen |
|
Hazenberg |
Verpleegkundig specialist Centrum voor Thuisbeademing UMCG |
n.v.t. |
Geen |
Geen |
|
Iperen, van |
lntensivist, Ziekenhuis Gelderse Vallei
|
|
Geen |
Geen |
|
Jaspers Focks |
Revalidatiearts NMA/ ALS, Roessingh centrum voor Revalidatie |
Onbetaald: bestuurslid VSCA |
Geen |
Geen |
|
Joosen |
Specialist ouderengeneeskunde, Rivas Zorggroep |
Betaald:
|
Geen |
Geen |
|
Kemming |
Longarts, UMC Utrecht, staflid Centrum voor Thuisbeademing |
n.v.t. |
Geen |
Geen |
|
Kievit-Pieffers |
Senior begeleid/verpleegkundige, Stichting Interakt Contour, Woonvorm De Stuwwal Zwolle |
n.v.t. |
Geen |
Geen |
|
Kleiker |
Mantelzorgvertegenwoordiger |
Gepensioneerd, voorheen betaald:
|
Geen |
Geen |
|
Kleiker- Wolters |
Patiënt en patiëntvertegenwoordiger |
|
Geen |
Geen |
|
Klinkhamer |
Instrumentatietechnicus CTB UMC Utrecht |
n.v.t. |
Geen |
Geen |
|
Kock-Cordeiro |
Longarts thuisbeademing Erasmus MC |
Onbetaald:
|
Geen |
Geen |
|
Krans |
Verpleegkundig specialist AGZ, Leliezorggroep en Izer |
|
Geen |
Geen |
|
Kooi, van der A.J. |
neuroloog Amsterdam UMC, voorzitter SCN |
Onbetaald: voorzitter ANV |
Geen |
Geen |
|
Kooi, van der, E. |
neuroloog Medisch Centrum Leeuwarden en Harlingen |
n.v.t. |
Geen |
Geen |
|
Kroos |
Senior verpleegkundig consulent Erasmus MC Rotterdam |
n.v.t. |
Geen |
Geen |
|
Kruitwagen |
Revalidatiearts, UMC Utrecht |
Onbetaald:
|
Geen |
Geen |
|
Lingen, van |
Verpleegkundig specialist chronische beademing, CTB, UMC Utrecht |
n.v.t. |
Geen |
Geen |
|
Manders-Heffener |
Patiënt en patiëntvertegenwoordiger en Junior onderzoeker, Radboudumc, Department of Pediatrics |
Onbetaald:
|
Geen |
Geen |
|
Oost |
Verpleegkundig consulent/kwaliteit medewerker, CTB UMCG |
n.v.t. |
Geen |
Geen |
|
Ruys |
Zelfstandig Interim manager/ beleidsadviseur/coach Beleidsadviseur VSCA |
Betaald:
|
Geen |
Geen |
|
Schulpen |
Instrumentatietechnicus/ Technisch adviseur, CTB Maastricht |
n.v.t. |
Geen |
Geen |
|
Sinnema |
Verpleegkundig specialist, CTB, UMCG |
n.v.t. |
Geen |
Geen |
|
Sluijs, van der |
Complexe mobiliteit, Kersten Hulpmiddelen |
n.v.t. |
Geen |
Geen |
|
Smedema |
Manager zorg Santé Partners
|
Betaald:
Onbetaald: Bestuurslid VSCA |
Geen) |
Geen |
|
Streek, van |
Verpleegkundig consulent Chronische beademing, CTB, UMC Utrecht |
n.v.t. |
Geen |
Geen |
|
Terpstra-Durinck |
Verpleegkundig Adviseur/lid expertiseteam - Fokus |
Onbetaald:
|
Geen |
Geen |
|
Timmen |
Directeur Spierziekten Nederland |
Onbetaald:
|
Geen |
Geen |
|
Tra |
Senior adviseur/ beleidsondersteuner, Kennisinstituut van de Federatie Medisch Specialisten |
Onbetaald:
|
Geen |
Geen |
|
Tromp |
Patiënt en patiëntvertegenwoordiger |
Onbetaald:
|
Geen |
Geen |
|
Velde, ter |
teamleider Siza, projectleider Academy het Dorp |
n.v.t. |
Geen |
Geen |
|
Venemans |
Methodoloog, De Onderzoekerij |
n.v.t. |
Geen |
Geen |
|
Verwey-vd Oudenrijn |
Verpleegkundig specialist chronische beademing bij kinderen, WKZ Kinder-IC, UMC Utrecht |
Onbetaald:
|
Geen |
Geen |
|
Vial |
Verpleegkundig consulent Chronische beademing, UMCUtrecht |
n.v.t. |
Geen |
Geen |
|
Visser, de |
Neuroloog Amsterdam UMC WRR
|
Betaald:
Onbetaald:
|
Geen |
Geen |
|
Visser-de Jong, de |
IC verpleegkundige/consulent, Erasmus MC Rotterdam |
Betaald:
|
Geen |
Geen |
|
Vlist, van der |
Onbetaald:
|
Geen |
Geen |
|
|
Volbeda |
Verkoopadviseur speciale rolstoelaanpassingen, Focal Meditech BV |
n.v.t. |
Geen |
Besproken- geen deelname aan beslissingen met commerciële invloed |
|
Wientjes |
Klinisch fysicus, UMC Utrecht |
n.v.t. |
Geen |
Geen |
|
Wijkstra |
Longarts, medisch hoofd, hoogleraar longziekten en tuberculose in het bijzonder chronische ademhalingsondersteuning, UMCG |
Niet betaald: Bestuurslid VSCA Betaald:
|
Geen |
Geen |
Inbreng patiëntenperspectief
Er is uitgebreid aandacht besteed aan het patiëntenperspectief door participatie van patiënten zelf en Spierziekten Nederland in de richtlijnwerkgroepen. Bij de inventarisatie van de knelpunten in de zorgverlening zijn naast zorgverleners ook patiënten en mantelzorgers geënquêteerd. Zij namen deel aan de Invitational Conference en zijn vertegenwoordigd in iedere werkgroep. De resultaten van de enquête en de Invitational Conference zijn verwerkt in het opstellen en prioriteren van de knelpunten en uitgangsvragen. Spierziekten Nederland nam als gemandateerd vertegenwoordiger van de Patiëntenfederatie Nederland deel aan de stuurgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvertegenwoordiging in meerdere bijeenkomsten.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fases van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Er is een onderscheid gemaakt tussen de aanbevelingen waarvan verwacht wordt dat zij binnen een jaar na publicatie van de richtlijn geïmplementeerd kunnen worden en tussen aanbevelingen waarvan te verwachten is dat de implementatie in geheel Nederland langer gaat duren. De implementatie van die laatste categorie heeft meer tijd nodig vanwege een gebrek aan middelen, expertise en/of juiste organisatie van de zorg. Of deze aanbevelingen daadwerkelijk in de praktijk gerealiseerd kunnen worden, hangt van de medewerking van meerdere (stakeholder)partijen af. Het implementatieplan vindt u in de bijlagen. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Werkwijze
Deze richtlijn beschrijft de beademingszorg of het overwegen van beademingszorg voor (potentieel) chronisch beademde patiënten. Chronische beademingszorg is ketenzorg waar zeer veel verschillende zorgverleners in participeren. Een groot aantal van de modules is gericht op de organisatie van de zorg.
In deze richtlijn is dankbaar gebruik gemaakt van en doorgebouwd op het pionierswerk dat door de ontwikkelaars van de Veldnormen (VSCA 2012 en 2015) verricht is.
Stuurgroep en werkgroepen
Voorbereiding door knelpuntenanalyse
Voorjaar 2018 is de stuurgroep gestart met de ontwikkeling van de richtlijn.
Tijdens de voorbereidingsfase werden de knelpunten gezamenlijk met het veld geïnventariseerd, allereerst door een enquête uitgezet onder patiënten, mantelzorgers en betrokken beroepsbeoefenaars (zie bijlage Enquête).
Stakeholders vulden in een Invitational Conference in oktober 2018 de knelpunten aan (zie bijlage Invitational Conference). Vanuit deze knelpunten stelde de werkgroep een longlist met knelpunten op en werden deze geprioriteerd op basis van het aantal keer dat zij genoemd werden, de te verwachten impact op patiëntveiligheid en welbevinden en beschikbaarheid van nieuwe evidentie/literatuur.
Daarbij is een keuze gemaakt om de volgende onderwerpen uit te werken in de richtlijn:
- Verwijzen en indicatie stellen chronische beademing
- Instellen op chronische beademing
- Transitie naar verblijfssituatie
- Chronische beademing in de verblijfssituatie
- Afstemming in de zorgketen voor chronische beademing
- Apparatuur en disposables
- Scholing ten behoeve van chronische beademing
- Vervoer/ambulance/reizen
- Transitie chronisch beademde kinderen naar volwassenen zorg
- Beëindigen van de chronische beademing
Op basis van de uitkomsten zijn door de stuurgroep conceptuitgangsvragen opgesteld. Voor ieder onderwerp werd een werkgroep geformeerd. De conceptuitgangsvragen zijn besproken in werkgroepen waarna definitieve uitgangsvragen zijn vastgesteld door de stuurgroep.
Vervolgens is bij de relevante modules systematisch literatuuronderzoek volgens de evidence-based methodiek verricht. Op basis van de uitkomsten van het literatuuronderzoek pasten de werkgroepleden na interne discussie zo nodig de conceptliteratuurbespreking en conclusies aan en stelden overwegingen en aanbevelingen op.
De werkgroepen zijn begin 2019 voor de eerste maal bijeengekomen. Alle teksten zijn tijdens bijeenkomsten besproken en na verwerking van de commentaren door de stuurgroep geaccordeerd en aan alle werkgroepleden nogmaals ter commentaar aangeboden in november 2020. De conceptrichtlijn is in maart 2021 ter becommentariëring aangeboden aan alle voor de zorg voor patiënten met chronische beademing relevante wetenschappelijke, beroeps- en patiëntenverenigingen. Dit commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de conceptrichtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren.
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II, Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap-beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het Stappenplan Ontwikkeling Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Waar mogelijk is gebruik gemaakt van internationale richtlijnen. Ook is aangesloten bij Nederlandse richtlijnen die op dit moment ontwikkeld worden, de richtlijn ‘zorg voor mensen met ALS’, de richtlijn Duchenne Spierdystrofie en de Kwaliteitsstandaard versterken Transitiezorg.
Keuze voor systematisch literatuuronderzoek, een oriënterende literatuursearch of expert-opinion.
De werkgroep identificeerde op basis van recente literatuur een aantal vragen die uitgebreid onderzocht zijn, omdat zij mogelijk geheel nieuwe ontwikkelingen of inzichten zouden bieden. Deze vragen worden bij de desbetreffende modules aangegeven.
De werkgroep heeft die uitgangsvragen verder uitgewerkt in PICO’s (Patiënten/Populatie, Interventie, Controle, Uitkomst (Outcome)).
Bij de beantwoording van de uitgangsvragen van een aantal modules is gekozen voor een oriënterende literatuursearch in plaats van systematisch literatuuronderzoek. Bij een oriënterende literatuursearch is gebruik gemaakt van de aangedragen literatuur door experts.
In een module is aangesloten bij zeer recent systematisch literatuuronderzoek.
Bij een aantal uitgangsvragen was het niet mogelijk om onderzoek te doen, of waren geen onderzoeksresultaten beschikbaar. De aanbeveling werd dan geformuleerd op basis van expert-opinion.
Voor alle modules heeft de werkgroep de recente en relevante literatuur doorgenomen.
Beoordelen van de kracht van het wetenschappelijke bewijs
Na een systematische literatuuranalyse werd de kracht van het wetenschappelijke bewijs bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Het wetenschappelijk bewijs werd samengevat in een of meerdere Nederlandstalige literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek.
Overwegingen
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, beschikbaarheid van voorzieningen, kosten en organisatorische zaken.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Organisatie van zorg
De zorg rondom chronische beademing is een typisch voorbeeld van ketenzorg waarbij de organisatie van de zorg een belangrijke plaats inneemt. Bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Tijdens het schrijven van de richtlijn werden wij geconfronteerd met veranderingen in wet- en regelgeving die ook impact hebben op deze richtlijn (Vb. code VVR- rolstoelvervoer). Er is zoveel mogelijk aangesloten bij de meest actuele regelgeving.
Indicatorontwikkeling
Er werden geen interne kwaliteitsindicatoren ontwikkeld om de administratieve belasting van de zorg niet te vergroten.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de stuurgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en patiëntorganisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Biggelaar van den R, Hazenberg A, Cobben NAM, et al. A randomized trial of Initiation of chronic non-invasive mechanical ventilation at home vs in-hospital in patients with Neuromuscular Disease and thoracic cage disorder. The Dutch Homerun Trial Chest 2020 Dec 158(6): 2493-501.
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ 182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Duiverman ML, Vonk JM, Bladder G, et al. Home initiation of chronic non-invasive ventiltion in COPD patients with chronic hypercapnic respiratory failure: a randomised controlled trial. Thorax 2020; 75(3): 244-52.
Inspectie Voor de Gezondheidszorg en Jeugd (voorheen IGZ)-Chronische beademing vereist betere afstemming- 2010
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schouten L ea. Chronisch beademd, levenslang kwetsbaar. Medisch Contact, nummer 2, 13 januari 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Schwarz SB, Windisch W. Outpatient Noninvasive Ventilation: Can the Dutch Setting Serve as a Blueprint for Other Countries? Chest. 2020 Dec;158(6):2255-2257. doi: 10.1016/j.chest.2020.08.004. PMID: 33280741.
Vereniging samenwerkingsverband chronische ademhalingsondersteuning (VSCA). Veldnorm Chronische Beademing 1.0. Baarn 2012
Vereniging samenwerkingsverband chronische ademhalingsondersteuning (VSCA). Veldnorm Chronische Beademing bij kinderen versie 1.0. Baarn 2015
Vereniging samenwerkingsverband chronische ademhalingsondersteuning (VSCA). Een beetje lucht, leven met chronische beademing. Baarn 2015
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
