De gevolgen van ongecontroleerd astma op neonatale uitkomsten
Uitgangsvraag
Wat zijn de gevolgen van ongecontroleerd astma tijdens zwangerschap op het kind?
Aanbeveling
Wees bedacht op mogelijke negatieve uitkomsten bij het kind als gevolg van ongecontroleerd astma tijdens de zwangerschap en streef naar een goed gecontroleerd astma bij de zwangere om negatieve neonatale uitkomsten en de kans op ontwikkeling van astma bij het kind te reduceren.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de huidige beperkte evidence is er geen goede uitspraak te doen over de gevolgen van ongecontroleerde astma tijdens zwangerschap op het kind in vergelijking met gecontroleerd astma. Neonatale uitkomsten waren gedefinieerd als cruciale uitkomstmaat. De bewijskracht hiervoor is beoordeeld als zeer laag, waardoor geen richting kan worden geven aan de besluitvorming.
Overwegingen bij uitkomstmaten ‘neonatale uitkomsten (vroeggeboorte, klein voor zwangerschapsduur, geboortegewicht, spontane abortus, doodgeboorte, opname op de neonatale intensive care unit, congenitale afwijkingen)’
Voor de cruciale uitkomstmaten ‘vroeggeboorte’ en ‘klein voor zwangerschapsduur’ zijn er 3 studies gevonden. Samenvattend werd in de studie van Bakhireva (2008) het effect van zwangeren met een gecontroleerd astma en ongecontroleerd astma op vroeggeboorte en foetale groei vergeleken. Er werd alleen in het eerste trimester een klinisch significant verschil in het nadeel van zwangeren met een ongecontroleerd astma op vroeggeboorte gevonden. Tevens was het absolute risico op vroeggeboorte onder de opgenomen zwangeren met astma hoger. In het derde trimester was er een significant nadelig effect op ‘te klein voor de zwangerschapsduur’ bij zwangeren met een ongecontroleerd astma. De studie van Yland (2020) laat ook een klinisch relevant verschil zien in een verhoogde kans op vroeggeboorte bij een zwangere met een ongecontroleerd astma. Dit wordt nogmaals bevestigd in de studie van Robijn (2020) waarbij zwangeren met meerdere exacerbaties een verhoogde kans hadden op vroeggeboorte van het kind. Ook werd er een verhoogde kans op ‘te klein voor de zwangerschapsduur’ gezien in deze groep. Dit risico was ook aanwezig in de groep zwangeren met matig tot ernstig astma die tijdens de zwangerschap een exacerbatie doormaakten. De studie van Robijn (2020) is de enige studie die heeft gekeken naar het geboortegewicht. Zowel bij zwangeren met 1 en/of meerdere exacerbaties, als bij zwangeren met matig tot ernstig astma met 1 exacerbatie werd een lager geboortegewicht bij het kind gezien. Voor de uitkomstmaten spontane abortus, doodgeboorte, opname op de neonatale intensive care unit en congenitale afwijkingen worden in de studie van Yand (2020) geen verhoogd risico gezien bij een zwangere met een ongecontroleerd astma.
Overwegingen bij uitkomstmaat ‘risico op ontwikkeling astma bij het kind’ en uitkomstmaat ‘risico op langere termijneffecten bij het kind’
Voor de belangrijke uitkomstmaten ‘risico op ontwikkeling astma bij het kind’ en ‘risico op langere termijneffecten bij het kind’ zijn geen studies gevonden die aan de PICO voldeden waardoor bewijskracht ontbreekt.
Aanvullende literatuur naar neonatale uitkomstmaten, risico op ontwikkeling van astma en lange termijneffecten bij het kind bij ongecontroleerd astma
Alhoewel er op basis van de PICO voor de systematische literatuuranalyse (vergelijking uitkomsten tussen zwangere vrouwen met goed gecontroleerd t.o.v. zwangere vrouwen met ongecontroleerd astma) maar 3 studies werden gevonden die aan de PICO-criteria voldeden, zijn er wel diverse observationele studies gepubliceerd waarin het effect van ongecontroleerde astma op neonatale uitkomstmaten wordt vergeleken met een gezonde controlegroep bestaande uit vrouwen zonder astma. De gegevens uit deze studies zijn weergegeven in Tabel 3 (zie onder Evidence tabellen).
Samenvattend laten al deze studies nadelige effecten op neonatale uitkomsten zien in zwangeren met ongecontroleerd astma ten opzichte van een gezonde controlegroep. Zo wordt in de systematische review van Murphy (2011) met observationele studies een 46% verhoogd risico gezien op laag geboortegewicht bij zwangeren met astma t.o.v. de gezonde controlegroep (Murphy, 2011). Dit wordt enkele jaren later nogmaals bevestigd in een tweetal observationele cohortstudies (Rejno, 2014; Rejno, 2018). Verder heeft een zwangere met een astma-exacerbatie tijdens de zwangerschap meer kans op een kind met een lager geboortegewicht en te klein voor de zwangerschapsduur (Robijn, 2020; Murphy, 2006 (systematic review)). Dit risico neemt toe wanneer er sprake is van meerdere exacerbaties. Belangrijk is te vermelden dat er een significante reductie van bovengenoemde risico’s werd gevonden bij ‘actief behandeld’ en goed gecontroleerd astma tijdens de zwangerschap (Schatz, 1995; Murphy, 2011).
Het risico op de ontwikkeling van astma bij het kind (zowel vroeg 0-3 jaar, tussen 0-6 jaar en laat 4-6 jaar) is hoger bij een zwangere met astma t.o.v. de gezonde controlegroep in een observationele studie van Liu (2018). Uiteraard heeft dit ook te maken met een erfelijkheidsfactor. Astma wordt vaak gezien binnen een familie en bij ongeveer de helft wordt astma veroorzaakt door genetische gevoeligheid (Palmer, 2000; Duffy, 1990).
Ook bij een ongecontroleerd astma is dit risico verhoogd (Liu, 2018). Dit wordt nogmaals bevestigd in een secundaire analyse van een randomized controlled trial waarin kinderen van zwangeren met astma een verhoogd risico laten zien op het ontwikkelen van astma tot de leeftijd van 3 jaar. Dit risico neemt toe als er sprake is van ongecontroleerd astma bij de moeder (Mirzakhani, 2019).
Waarden en voorkeuren van patiënten
Zorgen met betrekking tot potentieel schadelijke effecten van medicatie op de foetus resulteert vaak in een inadequate behandeling van astma tijdens de zwangerschap. Echter de risico’s van een ongecontroleerd astma bij de zwangere worden vaak onderschat door zowel de zwangere zelf als de behandelaar. Dit kan leiden tot minder goede neonatale uitkomsten. Meer en sterker wetenschappelijk bewijs over de effecten van ongecontroleerd astma op neonatale uitkomsten zou positief kunnen bijdragen aan het besef van zowel de zorgverlener als de patiënt dat goede astmacontrole tijdens de zwangerschap altijd moet worden nagestreefd. Mogelijk kan dit bijdragen aan het voorkomen danwel het reduceren van risico’s op complicaties tijdens de zwangerschap en astma bij de nakomelingen.
Kosten (middelenbeslag)
De hogere zorgkosten en zorggebruik die gerelateerd zijn aan een ongecontroleerd astma, zouden een extra motivatie moeten zijn om een zwangere met astma zo adequaat mogelijk te behandelen. Dit wordt onderbouwd met eerder onderzoek naar ongecontroleerd astma en zorggebruik bij niet zwangere patiënten (Bahadori, 2009). Na een adequate astma assessment, educatie van de patiënt en het instellen op de juiste behandeling zag men een reductie in zorggebruik en dientengevolge lagere zorgkosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Een ongecontroleerd astma is gerelateerd aan meer zorggebruik en hogere zorgkosten. Een ongecontroleerd astma bij een zwangere patiënte zal naar verwachting dezelfde nadelige gevolgen met zich meebrengen en kan daarnaast nog negatieve gevolgen hebben voor de gezondheid van nakomelingen en toekomstige generaties. Derhalve is te verdedigen om juist bij een zwangere patiënt met ongecontroleerd astma een adequate astma assessment te verrichten, monitoring te doen en aandacht te hebben voor educatie van de patiënt om zo een gecontroleerd astma te bereiken.
Rationale
Ondanks het gebrek aan harde evidence door het ontbreken aan RCT’s over de neonatale uitkomsten bij een ongecontroleerd astma t.o.v. een gecontroleerd astma bij zwangere vrouwen met astma, is de werkgroep van mening dat er aandacht moet zijn voor goede astmacontrole tijdens de zwangerschap. In de eerste plaats omdat er in de groep zwangeren met ongecontroleerd astma t.o.v. de groep met gecontroleerd astma nadelige effecten op neonatale uitkomsten worden gevonden. Echter berust deze conclusie op 3 studies. Wanneer dit effect nader wordt bekeken in een subgroep van zwangeren met astma en frequente exacerbaties en/of ziekenhuisopnames, een uiting van ongecontroleerd astma, dan neemt het risico op nadelige neonatale uitkomsten toe (zie Tabel 3 onder Evidence tabellen; Abdullah 2020).
Alhoewel deze resultaten vaak zijn gebaseerd op een retrospectieve analyse van longitidunale cohortstudies en registers, zijn de grote aantallen geincludeerde zwangere vrouwen met astma (bijv. 58.524 vrouwen met astma (103.424 zwangerschappen) in de studie van Abdullah, 2020), en de lange periode (tussen 1975 en 2020) waarover consistente bevindingen worden gerapporteerd (Murphy 2011), een reden om de bevindingen op te waarderen.
In de tweede plaats zijn er aanwijzingen dat er in vergelijking met de gezonde controlegroep een vergroot risico is op de ontwikkeling van astma bij het kind bij zwangeren met astma. Dit heeft deels ook te maken met de erfelijkheidsfactor. Wanneer er binnen deze groep gekeken wordt naar een subgroep van patiënten met ongecontroleerd astma dan neemt dit risico toe. Daarnaast zijn er op basis van indirect bewijs wel aanwijzingen voor reductie op de kans op astma bij het kind, als het astma goed gecontroleerd is.
Tenslotte is het niet te verwachten dat er in de nabije toekomst upgrading van evidence kan plaatsvinden o.b.v. nieuwe gerandomiseerde trials bij zwangere vrouwen met astma. Dit komt door de ethische bezwaren bij het uitvoeren van medisch-wetenschappelijk onderzoek bij zwangere vrouwen. Wel is er steeds meer aandacht voor het realiseren van ethisch verantwoorde inclusie van zwangere vrouwen met gedeelde verantwoordelijkheid van zorgprofessionals, METC leden, onderzoekers, methodologen, sponsoren en regelgevers (PREGMETHICs studie ZonMw). Dit wordt verder uitgebreider toegelicht in de bijlage kennishiaten en onderzoek (https://www.zonmw.nl/nl/onderzoek-resultaten/geneesmiddelen/programmas/project-detail/priority-medicines-ouderen/ethically-sound-inclusion-of-pregnant-women-in-medical-research-pregmethics-study/resultaten/).
Onderbouwing
Achtergrond
Er zijn aanwijzingen dat niet goed gecontroleerd astma en longaanvallen bij astma tijdens de zwangerschap geassocieerd zijn met neonatale complicaties. Ook lijkt ongecontroleerd astma tijdens de zwangerschap geassocieerd met astma bij het nageslacht. Het is van belang om inzicht te krijgen in zowel de neonatale complicaties als het risico op ontwikkelen van astma bij het kind door ongecontroleerd astma tijdens de zwangerschap, omdat adequate behandeling en een goed gecontroleerd astma tijdens de zwangerschap waarschijnlijk kunnen bijdragen aan een reductie van deze risico’s.
Conclusies
|
Very low GRADE |
Preterm birth
The evidence is very uncertain about the association between poorly controlled asthma/asthma exacerbations during pregnancy and preterm birth, compared to well-controlled asthma/no exacerbations.
Sources: Bakhireva, 2008; Yland, 2020; Robijn, 2020 |
|
Very low GRADE |
Small for gestational age
The evidence is very uncertain about the association between poorly controlled asthma/asthma exacerbations during pregnancy with being small for gestational age, compared to well-controlled asthma/no exacerbations.
Sources: Bakhireva, 2008; Yland, 2020; Robijn, 2020 |
|
Very low GRADE |
Birth weight (reduced, low, increased)
The evidence is very uncertain about the association between poorly controlled asthma/asthma exacerbations during pregnancy and reduced or low birth weight, compared to well-controlled asthma/no exacerbations.
Sources: Robijn, 2020 |
|
Very low GRADE |
Spontaneous abortion
The evidence is very uncertain about the association between poorly controlled asthma/asthma exacerbations during pregnancy and spontaneous abortion, compared to well-controlled asthma/no exacerbations.
Sources: Yland, 2020 |
|
Very low GRADE |
Stillbirth
The evidence is very uncertain about the association between poorly controlled asthma/asthma exacerbations during pregnancy and stillbirth, compared to well-controlled asthma/no exacerbations.
Sources: Yland, 2020 |
|
Very low GRADE |
NICU admission
The evidence is very uncertain about the association between poorly controlled asthma/asthma exacerbations during pregnancy and NICU admission, compared to well-controlled asthma/no exacerbations.
Sources: Yland, 2020 |
|
Very low GRADE |
Major congenital malformations
The evidence is very uncertain about the association between poorly controlled asthma/asthma exacerbations during pregnancy and major congenital malformations, compared to well-controlled asthma/no exacerbations.
Sources: Yland, 2020 |
|
- GRADE |
Risk of asthma development in the offspring
No conclusions could be drawn about the effect of well-controlled or poorly controlled asthma on the outcome measure ‘risk of asthma development in the offspring’, because it was not reported in the included studies.
Sources: - |
|
- GRADE |
Long term effects in the offspring
No conclusions could be drawn about the effect of well-controlled or poorly controlled asthma on the outcome measure ‘long-term effects in the offspring’, because it was not reported in the included studies.
Sources: - |
Samenvatting literatuur
Description of studies
Bakhireva (2008) conducted a prospective cohort study evaluating the effect of maternal asthma on preterm delivery and fetal growth. Included were pregnant women with physician-diagnosed asthma. Women had to be at least 18 years old, be in their first part of pregnancy (mean gestational age at enrollment was 13 weeks). In total 719 pregnant women with asthma were included (mean age, 31.4±5.4 years). Structured maternal interviews were conducted at enrollment, at the 26th and 32nd gestational weeks, and within 4 to 6 weeks after delivery and included information on maternal demographic and lifestyle characteristics, medication use, asthma control, and neonatal complications. Asthmatic women were asked at each interview to categorize their symptoms during the previous 2-week period using a (non-validated) 5-point scale. The scale is based on asthma symptoms and their interference with daily activities and sleep. Asthma control was categorized as adequate if no symptoms occurred or symptoms did not interfere with sleep or activity (score, 0–1), fair if symptoms occasionally interfered with sleep or activity (score, 2), and poor if symptoms frequently or constantly interfered with sleep or activity (score, 3–4).
Yland (2020) performed a cohort study within the IBM Health MarketScan Commercial Claims and Encounters Database (2011-2015) and the Medicaid Analytic eXtract (MAX) database (2000-2014). These are databases of commercial and public insurance plans. Pregnancies of women aged 12-55 years were identified in the database on the basis of International Classification of Diseases, 9th revision, Clinical Modification (ICD-9-CM) and current procedural terminology (CPT) codes. Ectopic pregnancies, molar pregnancies and those with unclassified delivery were excluded. Asthma was identified by diagnosis and treatment codes in the databases; asthma severity was based on dispensed medications, and asthma control was based on short-acting β-agonist dispensations and exacerbations. Perinatal outcomes were also identified using algorithms based on ICD-9 and CPT codes. The relative risks of stillbirth, spontaneous abortion, preterm birth (delivery begore 37 weeks gestation), small for gestational age (SGA, birth weight below the 10th percentile for sex and gestational age), neonatal intensive care unit (NICU) admission (within 30 days of birth) and congenital malformations (within 90 days after birth) were estimated, comparing pregnancies with different asthma status (based on asthma severity and asthma control). Also a comparison was made with pregnant women without asthma. In this analysis of literature only comparison between women with well-controlled and poorly controlled asthma will be presented.
Asthma severity was classified according to the Global Initiative for Asthma (GINA) guidelines: asthma diagnosis without treatment (step 0); only short-acting β-agonists (SABA) (step 1); low-dose inhaled corticosteroids (ICS) or leukotriene receptor antagonists (LTRA) or low-dose theophylline (step 2); low-dose ICS in combination with long-acting β-agonists (LABA), low-dose ICS plus LTRA or plus low-dose theophylline, or medium-high-dose ICS (step 3); medium-high-dose ICS in combination with LABA or high-dose ICS alone plus LTRA or plus low-dose theophylline (step 4); and step 4 plus additional therapy with tiotropium, anti-IgE, or low-dose oral corticosteroids (step 5). Yland (2020) categorized asthma severity as mild (GINA steps 0, 1, 2), moderate (GINA step 3) and severe (GINA steps 4, 5).
Asthma control was defined by the use of asthma medications and presence of asthma exacerbations (asthma-related emergency department visit; asthma-related hospitalization or use of oral corticosteroids ≥20 mg prednisone equivalents for 3-28 days). Poor asthma control was defined as 5 or more SABA prescriptions dispensed or 1 or more asthma exacerbations within an ascertainment period. Severe uncontrolled asthma was defined as having both poorly controlled and severe asthma (GINA steps 4 and 5) over 9-month periods during baseline and early pregnancy.
Yland (2020) identified 29,882 pregnant women with asthma in the MarketScan database and 160,638 pregnant women with asthma in Medicaid Analytic eXtract database. There were 22,747 pregnant women with well-controlled asthma and 7,135 pregnant women with poorly controlled asthma in the MarketScan database, and 102,385 pregnant women with well-controlled asthma and 58,280 pregnant women with poorly controlled asthma in the MAX database. In the MarketScan database, the majority of women had mild asthma (n=20,491), moderate and severe asthma was determined in 4,162 and 5,229 pregnant women, respectively. In the MAX database, there were relatively many women with severe asthma (n=43,948), compared to the number of women with moderate (n=20,208) and mild asthma (n=96,482).
Robijn (2020) conducted a population-based cohort study in the Swedish Medical Birth Register (2006-2013) to investigate the association of asthma exacerbations with perinatal outcomes. Asthma was defined in the database based on ICD-10 codes for asthma diagnoses and hospitalizations related to asthma, and using ATC codes for dispensed asthma medication 12-24 months before and during pregnancy.
The pre-pregnancy asthma treatment regime was used as a proxy for severity of asthma. Asthma exacerbations were defined as unplanned emergency department visits for asthma or a short course of oral corticosteroids for asthma during pregnancy. Adjusted odds ratios (aOR) were estimated for the associations between asthma exacerbations during pregnancy and the following neonatal outcomes: SGA (defined as the mean gestational age minus 2 standard deviations), preterm birth (<37 weeks of gestation) and birthweight (low birthweight (⩽2499 g), reduced birthweight (2500–2999 g), normal birthweight (3000–3999 g) and increased birthweight (⩾4000g). The analysis was stratified by preconception treatment regime (including prescriptions for asthma medication within 24 months before pregnancy) and was adjusted for maternal age, BMI, parity, self-reported smoking, education level, country of birth and maternal health problems (Robijn, 2020). Study subjects were placed into 5 groups based on prescriptions for asthma medication: no prescriptions, prescriptions for short-acting β-agonists (SABA) only (“mild asthma”), ICS monotherapy (“mild asthma”), ICS/long-acting β-agonist (LABA) combination therapy (“moderate–severe asthma”), and other combinations of asthma medications (Robijn, 2020). These groups corresponded with treatment steps 1 to 4 of the GINA guidelines during the study period (2006–2013).
A total of 33.829 singleton pregnancies (in 27.081 mothers with asthma) were included, with asthma exacerbations (1.703 asthma exacerbation episodes) occurring in 1.430 of the pregnancies. Multiple exacerbations occurred in 192 pregnancies.
Results
The results are presented by outcome measure. Forrest plots of outcome measures presented in the studies by Robijn (2020) and Yland (2020) are shown in Figure 3.1. and Figure 3.2.
Preterm birth (critical outcome)
Bakhireva (2008) found that the absolute risk of pre-term birth in the adequate asthma control group was 6.3% and 11.4% in the fair to poor asthma control group in the first part of pregnancy, resulting in an unadjusted odds ratio (OR) of 1.90 (95% CI: 1.11 to 3.25). After adjusting for maternal age, body mass index, gravidity, parity, socioeconomic status, smoking in pregnancy, and ethnicity the OR was 1.93 (95% CI: 1.10 to 3.40). This is a clinically relevant difference.
The absolute risk of pre-term birth in the adequate asthma control group was 8.3% and 6.7% in the fair to poor asthma control group at 26 gestational weeks, resulting in an unadjusted OR of 0.81 (95% CI: 0.43 to 1.53). This difference is not clinically relevant or statistically significant. No adjusted effect measure was reported.
The absolute risk of pre-term birth in the adequate asthma control group was 7.9% and 5.7% in the fair to poor asthma control group at 32 gestational weeks, resulting in an unadjusted OR of 0.70 (95% CI: 0.35 to 1.42). This difference is clinically relevant, but not statistically significant. No adjusted effect measure was reported.
Finally, the absolute risk of pre-term birth in hospitalized group was 16.4% and 7.6% in non-hospitalized group during pregnancy, resulting in an unadjusted OR of 2.38 (95% CI 1.14 to 4.98). After adjusting for maternal age, body mass index, gravidity, parity, socioeconomic status, smoking in pregnancy, and ethnicity the OR was 2.29 (95% CI 1.06 to 4.94). This is a clinically relevant difference.
Yland (2020) found that the adjusted relative risk (RR) of preterm birth in the MarketScan database was 1.27 (95%CI: 1.06 to 1.53) in well-controlled vs. poorly controlled asthma (see Evidence tables for confounders used for adjustment in all models). In the MAX database, the adjusted RR for preterm birth in well-controlled vs. poorly controlled asthma was 1.40 (95% CI: 1.32 to 1.48). This is a clinically relevant difference.
Robijn (2020) reported no association between asthma exacerbations and preterm birth, compared to no exacerbations: aOR 1.00 (95% CI: 0.79 to 1.28). This difference is not clinically relevant.
However, in women with multiple exacerbations aOR was 1.38 (95% CI: 0.78 to 2.43), compared to no exacerbations (Robijn, 2020). This is a clinically relevant, but not statistically significant difference.
Women treated with ICS/LABA (“moderate-severe asthma” group) with exacerbations during pregnancy were also at increased risk of preterm birth (aOR 1.28 (95% CI: 0.92–1.79) (Robijn, 2020). This is a clinically relevant, but not statistically significant difference.
Small for gestational age (SGA) (critical outcome)
Bakhireva (2008) found that the absolute risk of SGA in the adequate asthma control group was 5.9% and 5.5% in the fair to poor asthma control group in the first part of pregnancy, resulting in an unadjusted OR of 0.95 (95% CI: 0.50 to 1.81). This difference was not clinically relevant or statistically significant. No adjusted effect measure was reported.
The absolute risk of SGA in the adequate asthma control group was 5.2% and 5.8% in the fair to poor asthma control group at 26 gestational weeks, resulting in an unadjusted OR of 1.17 (95% CI: 0.57 to 2.38). This difference was not clinically relevant. No adjusted effect measure was reported.
The absolute risk of SGA in the adequate asthma control group was 6.3% and 4.7% in the fair to poor asthma control group at 32 gestational weeks, resulting in an unadjusted OR of 0.72 (95% CI: 0.34 to 1.57). This difference is clinically relevant. No adjusted effect measure was reported.
Finally, the absolute risk of SGA in hospitalized group was 6.6% and 5.7% in non-hospitalized group during pregnancy, resulting in an unadjusted OR of 1.18 (95% CI: 0.41 to 3.42). This difference is not clinically relevant. No adjusted effect measure was reported.
Yland (2020) found that adjusted RR for SGA in well-controlled vs. poorly controlled asthma in the MarketScan database was 0.96 (95% CI: 0.66 to 1.39). In the MAX database the adjusted RR for SGA was 1.15 (95% CI 1.03 to 1.29). This difference is not clinically relevant.
Robijn (2020) found that multiple asthma exacerbations increased the odds of infants being born SGA (aOR 2.58 (95% CI: 1.38 to 4.82)). This is a clinically relevant difference.
Robijn (2020) also found an increased odds of having an SGA-infant in women in the ICS/LABA-treated group (“moderate/severe” asthma), who experienced an asthma exacerbation during pregnancy (aOR 1.74 (95% CI: 1.18 to 2.57). This is a clinically relevant difference.
Birth weight (critical outcome)
Robijn (2020) reported that maternal asthma exacerbations were associated with reduced birthweight (aOR 1.45, 95% CI 1.24 to 1.70), compared to no exacerbations. Both one exacerbation and multiple asthma exacerbations increased the odds of reduced birthweight (aOR 1.39 (95% CI 1.17 to 1.65) and aOR 1.89 (95% CI: 1.24 to 2.86), respectively). This is a clinically important difference.
Multiple exacerbations increased the odds of babies being born with a low birth weight (aOR 1.43, 95% CI: 0.69 to 2.96). This is a clinically important difference, but it was not statistically significant.
Robijn (2020) also showed that asthma exacerbations during pregnancy were associated with reduced weight in infants of women on a single treatment regime (SABA only; ‘mild asthma’), compared to no exacerbations: aOR 1.72 (95% CI: 0.99 to 3.00). This is a clinically relevant difference.
In the ICS/LABA treated group (“moderate/severe” asthma), asthma exacerbations during pregnancy increased the odds of having an infant with reduced birth weight (aOR 1.65 (95% CI: 1.29 to 2.24) and a low birth weight (aOR 1.54 (95% CI 1.05 to 2.24)), compared to no exacerbations. This is a clinically relevant difference.
Spontaneous abortion (critical outcome)
Yland (2020) reported that adjusted RR for spontaneous abortion was 1.03 (95% CI: 0.97 to 1.09) in the MarketScan database, and 0.97 (95% CI: 0.94 to 1.00) in the MAX database, comparing pregnant women with well-controlled and poorly controlled asthma. This difference is not clinically relevant.
Stillbirth (critical outcome)
Yland (2020) found that the adjusted RR for stillbirth was 1.14 (95% CI: 0.78 to 1.66) in the MarketScan database and 0.98 (95% CI: 0.88 to 1.10) in the MAX database, comparing pregnant women with well-controlled and poorly controlled asthma. This difference is not clinically relevant.
NICU admission (critical outcome)
In the study by Yland (2020), the authors note that increased risk of NICU admissions in the study is likely mediated through prematurity, because 60% of infants admitted to the NICU were born preterm. The adjusted RR for NICU admission was 1.23 (95% CI: 1.01 to 1.49) in the MarketScan database and 1.26 (95% CI: 0.16 to 1.36) in the MAX database, comparing pregnant women with well-controlled and poorly controlled asthma. This difference is (borderline) clinically relevant (for the MarketScan data).
Major congenital malformations (critical outcome)
Yland (2020) defined major congenital malformations as a structural abnormality with surgical, medical, or cosmetic importance. The analysis of major congenital malformations in children of women with well-controlled vs. poorly controlled asthma was adjusted for multiple confounders, including teratogen use and diseases known to increase the risk of congenital malformations (see Evidence tables for confounders used for adjustment in all models). The adjusted RR for major congenital malformations in the MarketScan database was 1.20 (95% CI: 0.84 to 1.70), and in the MAX database it was 1.08 (95% CI: 0.97-1.19). This difference is not clinically relevant or statistically significant.
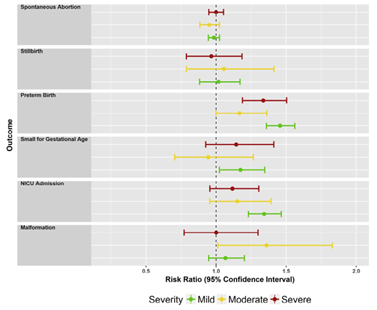
Figure 3.1. RRs and 95% CI’s comparing pregnancies with poorly controlled asthma with those with well-controlled asthma, stratified by asthma severity (mild, moderate, severe). Results in the combined data from the MarketScan and MAX databases (Yland, 2020).
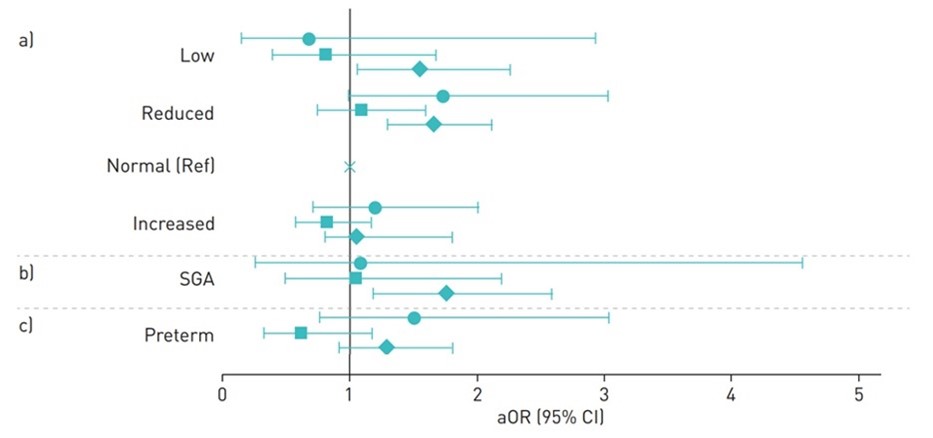
Figuur 3.2. Odds ratios for association between maternal exacerbations and perinatal outcomes among
pregnant women with asthma, stratified by pre-pregnancy asthma treatment (circles: SABA only; squares: ICS
monotherapy/other; diamonds: ICS/LABA). a) Birthweight categories (low ⩽2499 g, reduced 2500–2999 g,
normal 3000–3999 g, increased ⩾ 4000 g); b) small for gestational age (SGA); c) preterm delivery.
SABA, short-acting-β2-agonists; ICS, inhaled corticosteroids; LABA, long-acting-β-agonist; aOR: adjusted odds ratio (Robijn, 2020).
Risk of asthma development in the offspring (important outcome)
None of the included studies assessed the association of controlled vs. uncontrolled asthma during pregnancy with the risk of asthma development in the offspring.
Long-term effects in the offspring (important outcome)
None of the included studies assessed the association of controlled vs. uncontrolled asthma during pregnancy with long-term effects in the offspring.
Level of evidence of the literature
The level of evidence for observational studies starts low. The quality of evidence regarding the outcome measures ‘preterm birth’, ‘small for gestational age’, ‘stillbirth’, ‘spontaneous abortion’, ‘major congenital malformations’, ‘NICU admission’, and ‘birth weight’ was downgraded to a ‘very low’ level, because of the risk of bias (unclear how loss to follow-up was treated in Bakhireva (2008); possible misclassification of the exposure and outcome in database analysis by Yland (2020) and Robijn (2020)).
The level of evidence for the outcome measures ‘risk of asthma development in the offspring’ and ‘long-term effects in the offspring’ could not be assessed due to the absence of relevant studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the consequences of uncontrolled asthma during pregnancy on the offspring?
P (patients)1: Pregnant women with uncontrolled asthma
P (patients)2: Pregnant women with controlled asthma
I (intervention): -
C (control): -
O (outcome measures): Neonatal outcomes (preterm birth, small for gestational age, stillbirth, spontaneous abortion, neonatal intensive care unit (NICU) admission, major congenital malformations, birth weight), risk of asthma development in the offspring, long-term effects in the offspring
Relevant outcome measures
The guideline development group considered neonatal outcomes (preterm birth, small for gestational age, stillbirth, spontaneous abortion, neonatal intensive care unit (NICU) admission, major congenital malformations, birth weight) as critical outcome measures for decision making; and asthma development in the offspring and long-term effects in the offspring as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. Definition of uncontrolled/poorly controlled asthma was based on Global Initiative for Asthma (GINA) treatment guidelines.
The working group defined the GRADE standard limit of 25% difference for dichotomous outcomes (RR <0.8 or >1.25) and 10% for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 1 January 2000 until 14 October 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 891 hits. Studies were selected based on the following criteria: systematic reviews (with meta-analyses), randomized controlled trials (RCT) and observational studies, which answered the PICO. Studies were initially selected based on title and abstract screening. 27 studies were initially selected based on title and abstract screening. After reading the full text, 24 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 3 studies were included. Additionally, 6 studies that were identified by the systematic search but did not directly answer the PICO-question were used as indirect evidence to support the recommendations. These studies were deemed relevant to answer the clinical question by the working group and were summarized in Table 3a.1.
Results
Three studies were included in the analysis of the literature (Bakhireva, 2008; Yland, 2020; Robijn, 2020). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Abdullah K, Zhu J, Gershon A, Dell S, To T. Effect of asthma exacerbation during pregnancy in women with asthma: a population-based cohort study. Eur Respir J. 2020 Feb 12;55(2):1901335. doi: 10.1183/13993003.01335-2019. PMID: 31772000.
- Bahadori, K., Doyle-Waters, M. M., Marra, C., Lynd, L., Alasaly, K., Swiston, J., & FitzGerald, J. M. (2009). Economic burden of asthma: a systematic review. BMC pulmonary medicine, 9(1), 1-16.
- Bakhireva, L. N., Schatz, M., Jones, K. L., Chambers, C. D., & Organization of Teratology Information Specialists Collaborative Research Group. (2008). Asthma control during pregnancy and the risk of preterm delivery or impaired fetal growth. Annals of Allergy, Asthma & Immunology, 101(2), 137-143
- Duffy, D. L., Martin, N. G., Battistutta, D., Hopper, J. L., & Mathews, J. D. (1990). Genetics of Asthma and Hay Fever in Australian Twins1-3. Am rev respir Dis, 142, 1351-1358.
- Liu, X., Agerbo, E., Schlünssen, V., Wright, R. J., Li, J., & Munk-Olsen, T. (2018). Maternal asthma severity and control during pregnancy and risk of offspring asthma. The Journal of allergy and clinical immunology, 141(3), 886892.e3.
- Mirzakhani, H., Carey, V. J., Zeiger, R., Bacharier, L. B., O'connor, G. T., Schatz, M. X., ... & Litonjua, A. A. (2019). Impact of parental asthma, prenatal maternal asthma control, and vitamin D status on risk of asthma and recurrent wheeze in 3?year?old children. Clinical & Experimental Allergy, 49(4), 419-429.Murphy, V. E., Clifton, V. L., & Gibson, P. G. (2006). Asthma exacerbations during pregnancy: incidence and association with adverse pregnancy outcomes. Thorax, 61(2), 169-176.
- Murphy, V. E., Namazy, J. A., Powell, H., Schatz, M., Chambers, C., Attia, J., & Gibson, P. G. (2011). A meta?analysis of adverse perinatal outcomes in women with asthma. BJOG: An International Journal of Obstetrics & Gynaecology, 118(11), 1314-1323.
- Palmer, L. J., Burton, P. R., Faux, J. A., James, A. L., William Musk, A., & Cookson, W. O. (2000). Independent inheritance of serum immunoglobulin E concentrations and airway responsiveness. American journal of respiratory and critical care medicine, 161(6), 1836-1843.
- PREGMETHICs studie, ZonMw:
- https://www.zonmw.nl/nl/onderzoek-resultaten/geneesmiddelen/programmas/project-detail/priority-medicines-ouderen/ethically-sound-inclusion-of-pregnant-women-in-medical-research-pregmethics-study/ [geraadpleegd op 02-05-2022]
- Rejnö, G., Lundholm, C., Gong, T., Larsson, K., Saltvedt, S., & Almqvist, C. (2014). Asthma during pregnancy in a population-based study-pregnancy complications and adverse perinatal outcomes. PloS one, 9(8), e104755.
- Rejnö, G., Lundholm, C., Larsson, K., Larsson, H., Lichtenstein, P., D'Onofrio, B. M., ... & Almqvist, C. (2018). Adverse pregnancy outcomes in asthmatic women: a population-based family design study. The Journal of Allergy and Clinical Immunology: In Practice, 6(3), 916-922.
- Robijn, A. L., Brew, B. K., Jensen, M. E., Rejnö, G., Lundholm, C., Murphy, V. E., & Almqvist, C. (2020). Effect of maternal asthma exacerbations on perinatal outcomes: a population-based study. ERJ open research, 6(4).
- Yland JJ, Bateman BT, Huybrechts KF, Brill G, Schatz MX, Wurst KE, Hernández-Díaz S. Perinatal Outcomes Associated with Maternal Asthma and Its Severity and Control During Pregnancy. J Allergy Clin Immunol Pract. 2020 Jun;8(6):1928-1937.e3. doi: 10.1016/j.jaip.2020.01.016. Epub 2020 Jan 22. PMID: 31981730.
Evidence tabellen
1. Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Thuot 2013 |
Type of study: Retrospective observational cohort study
Setting and country: Hospital, Canada
Funding and conflicts of interest: Research was funded by a grant from Canadian Institutes for Health Research
No conflicts of interest |
Inclusion criteria: women with asthma between 13 and 50 years of age at the beginning of pregnancy and covered by the RAMQ drug insurance plan for at least one year before and during pregnancy. Women were considered to have had asthma if they filled at least one prescription for an asthma medication and had at least one diagnosis of asthma (International classification of Diseases, Ninth Revision codes 493 except 493.2) two years before or during pregnancy.
Exclusion criteria: Not fulfilling inclusion criteria
N total at baseline: Total women: 1337 Total pregnancies: 1386
Underweight (BMI <18): 149
Normal weight (BMI 18-<25): 739
Overweight (BMI 25-<30): 273
Obese (BMI >30): 225
Important prognostic factors2: Adequate control/Poor to fair control
Maternal age (years); n(%) <25: 29 (7.3)/42 (13.6) 25–34: 240 (60.6)/179 (58.1) >35: 127 (32.1)/87 (28.3)
BMI; n(%) <24: 208 (52.5)/141 (45.8) 24–28: 94 (23.7)/81 (26.3) >28: 94 (23.7)/86 (27.9)
Gravidity >1; n(%) 223 (56.3)/215 (69.8)
Parity >0; n(%) 153 (38.6)/169 (54.9)
Any tobacco use in pregnancy; n(%) 38 (9.6)/38 (12.3)
Any alcohol use in pregnancy; n(%) 187 (50.0)/132 (45.4)
SES status above average; n(%) 304 (77.9)/190 (62.5)
Mean (SD) daily dose of inhaled corticosteroids (µG) 399.3 (314)/481.1 (88) |
Describe intervention: Perinatal outcomes in pregnant women with normal weight (18 -<25) |
Describe control: Perinatal outcomes in pregnant women with underweight (BMI<18), overweight (BMI 25-<30) or obesity (BMI >30) |
Length of follow-up: End of pregnancy
Incomplete outcome data: Not described |
Outcome measures and effect size Small for gestational age; n(%) Underweight: 35/149 (23.5) aOR=1.3 (95% CI 0.8–2.0)
Overweight: 32/273 (11.7) aOR=0.9 (95% CI 0.6–1.4)
Obese: 19/225 (8.4) aOR=0.6 (95% CI 0.4–1.0)
Large for gestational age; n(%) Underweight: 35/149 (23.5) aOR=0.5 (95% CI 0.2–1.5)
Overweight: 14/273 (5.1) aOR=0.7 (95% CI 0.3–1.2)
Obese: 22/225 (9.8) aOR=1.2 (95% CI 0.7–2.1)
Preterm birth; n(%) Underweight: 14/149 (9.4) aOR=0.7 (95% CI 0.4–1.2)
Overweight: 18/273 (6.6) aOR=0.6 (95% CI 0.3–1.1)
Obese: 21/225 (9.3) aOR=0.7 (95% CI 0.4–1.2)
|
The authors conclude that obese asthmatic women were not at a higher risk for perinatal outcomes than normal-weight asthmatic women
|
Notes:
1. Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures .
2. Provide data per treatment group on the most important prognostic factors [(potential) confounders].
3. For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
4. For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
2. Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Thuot, 2013 |
Unlikely |
Likely
Unclear how loss to follow-up was treated in analysis of the data. |
Unlikely
Outcome was defined based on a non-validated 5 points scale based on development of symptoms that interfered with sleep or activities. |
Unlikely
Adjusted for maternal age at the beginning of pregnancy, nullipara, maternal weight gain during pregnancy, low birth weight infant before the current delivery and maternal cigarette smoking during pregnancy |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel 3. Overzicht van studies die hebben gekeken naar het effect op neonatale uitkomsten en het risico op de ontwikkelingen van astma bij het kind bij zwangere vrouwen met ongecontroleerd astma.
|
Studie |
Studie design |
Study size (n) |
Cases |
Controle groep |
Uitkomsten |
|
Rejno, 2018 |
Observationele cohort study |
1.075.153 |
Zwangere vrouwen met astma |
Gezonde broers, zussen, nichten of neven. |
Perinatale uitkomsten
Gemiddeld geboortegewicht Totale populatie: gemiddelde = 3567 g Astma populatie: gemiddelde = 3537 g adjusted MD=47 g (95% CI, 42-51 g)
Gemiddelde zwangerschapsduur Totale populatie: gemiddelde = 39,4 weeks Astma populatie: gemiddelde = 39,3 weeks adjusted MD=0,12 weeks (95% CI, 0,11- 0,13).
Klein voor zwangerschapsduur Totale populatie: n=22.112 (2,1%) Astma populatie: n= 2590 (2,4%) aOR=1,18 (95% CI, 1,12-1,23)
Groot voor zwangerschapsduur Totale populatie: n=41.244 (3,8%) Astma populatie: n= 4294 (4,0%) aOR=0,92 (95% CI, 0,88-0,95) |
|
Rejno, 2014 |
Observationele cohort studie |
266.045 totaal aantal vrouwen
26.586 Vrouwen met astma
257.628 vrouwen zonder astma
284.214 zwangerschappen |
Zwangere vrouwen met astma tussen 1 juli, 2006 en 31 december 2009 die bevallen zijn van een eenling.
|
Zwangere vrouwen zonder astma tussen 1 juli, 2006 en 31 december 2009 die bevallen zijn van een eenling.
|
Perinatale uitkomsten
Klein voor zwangerschapsduur (mean - 2xSD) Totaal: n=6722 (2,4%) Astma= 714 (2,7%) aOR=1,23 (95% CI 1,13–1,33)
Groot voor zwangerschapsduur (mean+ 2xSD) Totaal: n=9639 (3,4%) Astma= 977 (3,7%) aOR=0,93 (95% CI 0,86–0,99)
Apgar score op 5 minuten <7 Totaal: n=6722 (2,4%) Astma= 714 (2,7%) aOR=1,08 (95%CI 0,96–1,20)
Asfyxie of hypoxie Totaal: n=3322 (1,3%) Astma= 384 (1,4%) aOR=1,07 (95% CI 0,94–1,22) |
|
Murphy, 2011 |
Systematische review van observationele studies |
40 studies met in totaal 1.637.180 deelnemers |
Cohort studies gepubliceerd tussen 1975 en maart 2009 die minimaal 1 perinatale uitkomst rapporteerde in zwangere vrouwen met en zonder astma |
- |
Laag geboortegewicht (<2500 gram) 13 studies, 1.109.907 deelnemers RR=1,46 (95% CI 1,22-1,75)
Klein voor zwangerschapsduur (<10 percentiel van foetaal groei ratio <0,85) 11 studies, 1.086.253 deelnemers RR=1.22 (95% CI 1,14-1,31)
|
|
Mirzakhani, 2019 |
Randomized, double‐blind, placebo‐controlled clinical Trial Secundaire analyse van de VDAART trial (de VDAART trial is een gerandomiseerde dubbel blinde placebo gecontroleerde studie naar het effect van vit D suppletie vs placebo bij zwangere vrouwen op preventie van astma bij nakomelingen.) |
806 zwangere vrouwen in totaal
322 zwangere vrouwen met astma
484 zwangere vrouwen zonder astma
|
Vrouwen tussen de 18 en 39 jaar die tussen de 10 en 18 weken zwanger zijn, niet roken en gediagnosticeerd zijn met astma
|
Vrouwen tussen de 18 en 39 jaar die tussen de 10 en 18 weken zwanger zijn, niet roken en geen astma hebben |
Risico op de ontwikkeling van astma in het kind
Risico op de ontwikkeling van astma in het kind in de eerste 3 levensjaren bij vrouwen met ongecontroleerde astma tijdens de zwangerschap in vergelijking met vrouwen met gecontroleerde astma tijdens de zwangerschap aHR=1,60 (95% CI: 1,02‐2,54)
Risico op de ontwikkeling van astma in het kind in de eerste 3 levensjaren bij vrouwen met gecontroleerde astma tijdens de zwangerschap in vergelijking met vrouwen zonder astma. aHR = 1.70, 95% CI: 1.17‐2.40 |
|
Liu, 2018 |
Observationele cohort studie |
675.379 zwangere vrouwen
7824 zwangere vrouwen zonder actief astma tijdens de zwangerschap
7188 zwangere vrouwen met actief astma tijdens de zwangerschap
Actief astma, gedefinieerd als: ≥ 1 voorschrift astmamedicatie of ≥ 1 bezoeken aan huisarts, polikliniek of spoedeisende hulp wegens astma tijdens de zwangerschap.
|
Zwangere vrouwen met astma die resulteerde in eenling bevallingen |
Zwangere vrouwen zonder astma die resulteerde in eenling bevallingen |
Risico op de ontwikkeling van astma in het kind
Diagnose astma met vroege aanvang (0 tot 3 jaar, maar geen behandeling op de leeftijd van 4 tot 6 jaar) Astmatische moeder zonder actief astma Totaal:7826 Cases: 1021 (13%) Adjuste prevalence ratio (aPR)=1,36 (95% CI 1,29-1,45)
Astmatische moeder met actief astma Totaal:7188 Cases: 950 (13,2%) aPR=1,49 (95% CI 1,41-1,58)
Diagnose astma met vroege aanvang (0 tot 3 jaar en gedurende 4-6 jaar) Astmatische moeder zonder actief astma Totaal:7826 Cases: 1016 (13%) aPR=1,76 (95% CI 1,66-1,87)
Astmatische moeder met actief astma Totaal:7188 Cases: 1274 (17,7%) aPR=2,52 (95% CI 2,39-2,65)
Diagnose astma met late aanvang (niet gedurende 0 tot 3 jaar, maar wel gedurende 4-6 jaar) Astmatische moeder zonder actief astma Totaal:7826 Cases: 435 (6,7%) aPR=1,72 (95% CI 1,57-1,88)
Astmatische moeder met actief astma Totaal:7188 Cases: 479 (6,7%) aPR=2.08 (95% CI 1,90-2,27)
|
|
Murphy, 2006 |
Systematische review van case series, historische cohorten en prospectieve studies |
|
Zwangere vrouwen met astma die exacerbaties rapporteerde tijdens de zwangerschap
(en: zwangere vrouwen met astma met een exacerbatie en zwangere vrouwen met astma zonder een exacerbatie tijdens de zwangerschap) |
Zwangere vrouwen zonder astma
|
Vroegtijdige bevalling Exacerbatie tijdens de zwangerschap Astma: 11/126 (8,7%) Controle: 5611/31522 (17,8%) RR=1,46 (95% CI 0,77-2,78)
Geen exacerbatie tijdens de zwangerschap Astma: 14/79 (17,7%) Controle: 5623/31899 (17,6%) RR=0,93 (95% CI 0,74-1,17)
Laag geboortegewicht Exacerbatie tijdens de zwangerschap Astma: 11/126 (8,7%) Controle: 3595/31852 (11,2%) RR=2,54 (95% CI 1,52-4,25)
Geen exacerbatie tijdens de zwangerschap Astma: 82/855 (9,5%) Controle: 3605/31662 (11,4%) RR=1,12 (95% CI 0,89-1,40)
|
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Gaillard, 2017 |
Wrong publication type (narrative review) |
|
Gage, 2015 |
C does not meet PICO |
|
Murphy, 2013 |
C does not meet PICO |
|
Macmullen, 2010 |
C does not meet PICO |
|
Bakhireva, 2008 |
I does not meet PICO |
|
Drombrowski, 2005 |
C does not meet PICO |
|
Bracken, 2003 |
C does not meet PICO |
|
Namazy, 2013 |
O does not meet PICO |
|
Wang, 2020 |
I does not meet PICO |
|
Newman, 2010 |
Does not meet PICO |
|
Murphy, 2011 |
I does not meet PICO |
|
Murphy, 2020 |
I does not meet PICO |
|
Wang, 2014 |
C does not meet PICO |
|
Murphy, 2017 |
O does not meet PICO |
|
Ali, 2016 |
I does not meet PICO |
|
Sande, 2018 |
I does not meet PICO |
|
Sorensen, 2003 |
I does not meet PICO |
|
Macmullen, 2006 |
I does not meet PICO |
|
Wen, 2001 |
I does not meet PICO |
|
Rejno, 2018 |
I does not meet PICO |
|
Czerwinski, 2012 |
I does not meet PICO |
|
Mendola, 2014 |
C does not meet PICO |
|
Mendola, 2013 |
C does not meet PICO |
|
Triche, 2004 |
C does not meet PICO |
|
Mirzakhani, 2018 |
I does not meet PICO |
|
Hendler, 2006 |
C does not meet PICO |
|
Lais, 2014 |
I does not meet PICO |
|
Trønnes, 2014 |
I does not meet PICO |
|
Ali, 2017 |
Wrong publication type (narrative review) |
|
Rejno, 2014 |
C does not meet PICO |
|
Mendes, 2013 |
Wrong language (Portugese) |
|
Blais, 2015 |
O does not meet PICO |
|
Blais, 2008 |
O does not meet PICO |
|
Tata, 2007 |
C does not meet PICO |
|
Fazel, 2018 |
C does not meet PICO |
|
Powell, 2015 |
I does not meet PICO |
|
Ali, 2018 |
O does not meet PICO |
|
Abdullah, 2020 |
I does not meet PICO |
|
Murphy, 2010 |
C does not meet PICO |
|
Enriquez, 2007 |
C does not meet PICO |
|
Blais, 2010 |
C does not meet PICO |
|
Firoozi, 2010 |
I does not meet PICO |
|
Kim, 2015 |
I does not meet PICO |
|
Beckmann, 2003 |
C does not meet PICO |
|
Ali, 2016 |
Wrong publication type (Narrative review) |
|
Firoozi, 2012 |
C does not meet PICO |
|
Rudra, 2006 |
I does not meet PICO |
|
Kemppainen, 2018 |
C does not meet PICO |
|
Murphy, 2003 |
I does not meet PICO |
|
Aly, 2011 |
C does not meet PICO |
|
Shaked, 2019 |
C does not meet PICO |
|
Vaezi, 2017 |
C does not meet PICO |
|
Grzeskowiak, 2016 |
I does not meet PICO |
|
Johnston, 2012 |
C does not meet PICO |
|
Yland, 2020 |
C does not meet PICO |
|
Hodyl, 2014 |
C does not meet PICO |
|
Sobande, 2002 |
C does not meet PICO |
|
Sheiner, 2005 |
C does not meet PICO |
|
Breton, 2009 |
C does not meet PICO |
|
Breton, 2010 |
C does not meet PICO |
|
Jensen, 2020 |
I does not meet PICO |
|
Murphy, 2005 |
I does not meet PICO |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 12-04-2023
Laatst geautoriseerd : 12-04-2023
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financiers hebben geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor zwangere vrouwen met astma.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Nederveen-Bendien* |
longarts |
werkgroeplid NHG standaard astma, betaald |
Betaald: scholing gegeven voor huisartsen, LVPK en specialisten voor ALK, GSK, Sanofi en AstraZeneca |
Geen betaald adviseurschap gedurende de periode van de richtlijn ontwikkeling |
|
Feitsma |
gynaecoloog |
bestuurslid Integrale Geboortezorgorganisatie HJGC (IGO HJGC), onbetaald |
Geen |
Geen |
|
Koehorst-ter Huurne |
beherend apotheker |
lid special interest group (SIG) Long, KNMP |
Geen |
Geen |
|
Brons |
ervaringsdeskundige Longfonds |
Docent-onderzoeker, lid Cliëntenraad Merem (vrijwilligersvergoeding), |
Geen |
Geen |
|
Wittkampf |
longverpleegkundige |
Voorzitter V&VN longverpleegkundigen, onbetaald |
Geen |
Geen |
|
Kuiterman |
zelfstandig waarnemend verloskundige 1e lijn
|
Geen |
Geen |
Geen |
|
Van der Meer |
longarts
|
Geen |
Adviesraad Chiesi: triple therapie bij astma, betaald Unrestricted research grant MD-PhD traject: GlaxoSmithKline, Teva Stichtijng Longziekten Fryslan Medical Centre Leeuwarden research fund |
Geen |
|
De Kruif |
longarts |
Geen |
Geen |
Geen |
|
Hoolwerff |
kaderarts astma/COPD |
Werkzaam als huisarts, betaald. |
Geen |
Geen |
|
Poulissen |
sr. projectleider zorg |
Geen |
Geen |
Geen |
*voorzitter richtlijncommissie
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het organiseren van een focusgroep en het invullen van een patietenvragenlijst (ontworpen speciaal voor deze richtlijn m.b.v. de dialoogtool van PGO support), afvaardiging van patiëntenvereniging in de werkgroep en betrekken van patiëntenvertegenwoordigers bij het ontwikkelen van Thuisarts-situaties. Het verslag hiervan van de focusgroep (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de overwegingen (zie kop ‘waarden en voorkeuren van patiënten’ bij module ‘Monitoring’). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn (zie onderstaande tabel).
Module |
Uitkomst raming |
Toelichting |
|
Module 1a Veiligheid van astmamedicatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 1b Step-down in inhalatiemedicatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 1c ICS-formoterol ‘zo nodig’ therapie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 2 Astmamedicatie tijdens borstvoeding |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 3a Neonatale uitkomsten |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 3b Voorspellers van negatieve uitkomsten |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 4 Preceonceptioneel advies |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 5 Monitoring van astma bij zwnageren |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 6 Organisatie van zorg |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor zwangere vrouwen met astma door middel van een schriftelijke knelpunteninventarisatie (enquête). De volgende partijen zijn gevraagd om knelpunten aan te dragen: Inspectie Gezondheidszorg en Jeugd (IGJ), Lareb, Nederlandse Associatie Physician Assistants (NAPA), Nederlandse Vereniging van Longfunctieanalisten (NVLA), Nederlandse zorgautoriteit (NZA), Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlandse Vereniging van Ziekenhuizen (NVZ), Patiëntenfederatie Nederland, Samenwerkende Topklinische opleidingsZiekenhuizen (STZ), Vereniging Innovatieve Geneesmiddelen (VIG), Zorginstituut Nederland (ZiNL), Zelfstandige Klinieken Nederland (ZKN), Zorgverzekeraars Nederland (ZN), Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV), Longfonds, Nederlands Huisartsen Genootschap (NHG), Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (NVALT), Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG), Verpleegkundigen & Verzorgenden Nederland (V&VN). Het verslag van de schriftelijke knelpunteninventarisatie is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
